Слайд 2Цель урока
Изучить химические свойства и стадии получения серной кислоты

Слайд 3Химические свойства
С основаниями (реакция нейтрализации)
H2SO4 + NaOH -> NaHSO4 +
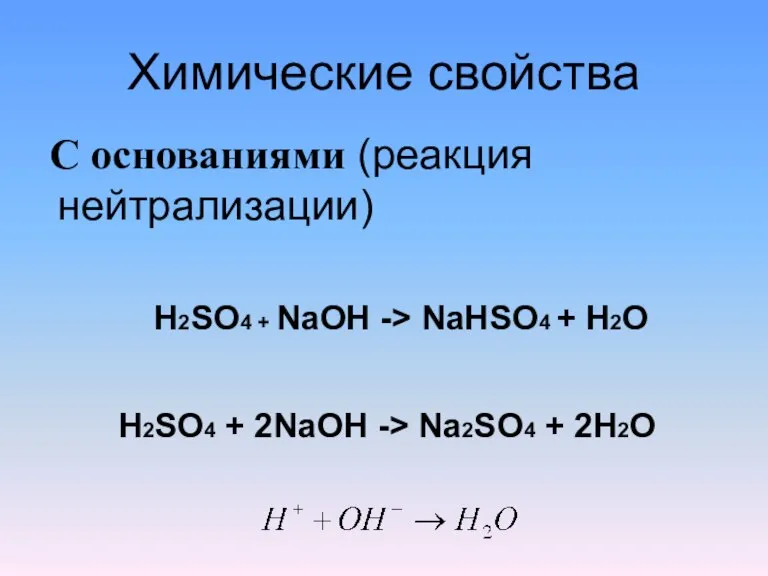
H2O
H2SO4 + 2NaOH -> Na2SO4 + 2H2O
Слайд 4Химические свойства
С металлами (стоящие в ряду напряжения до водорода)
Zn +

H2SO4 -> ZnSO4 + H2
Слайд 5Химические свойства
С солями
BaCl2 + H2SO4 -> BaSO4 + 2HCl
Хлорид бария

является качественным реактивом на H2SO4
Слайд 6Концентрированная серная кислота
Cu + 2H2SO4 -> CuSO4 + SO2 + 2H2O

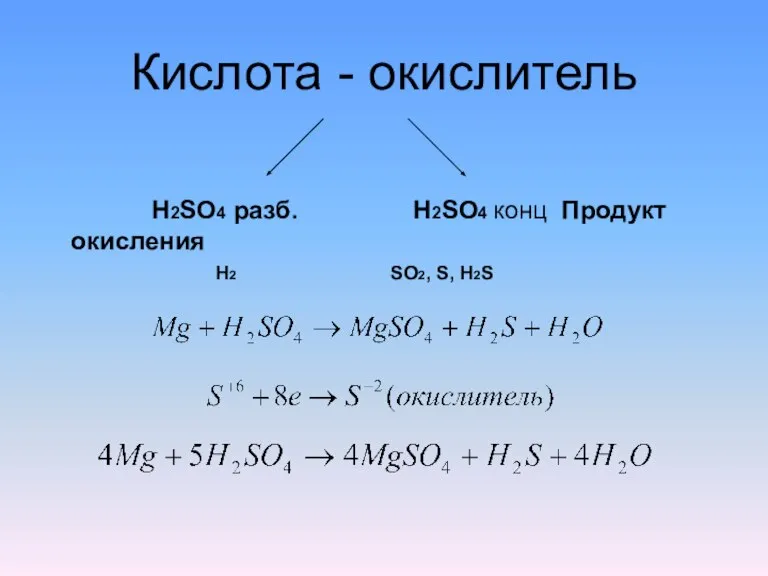
Слайд 7Кислота - окислитель
H2SO4 разб. H2SO4 конц Продукт окисления
H2 SO2, S, H2S
Слайд 8Производство серной кислоты
I стадия – получение сернистого газа SO2
Получение из пирита

Слайд 9Производство серной кислоты
II стадия – получение SO3
2-я стадия

Слайд 10Производство серной кислоты
III стадия – получение H2SO4
3-я стадия

Слайд 11Выводы
Серная кислота может являться реагентом для получения водорода
Серная кислота является сильным

окислителем
Серная кислота взаимодействует не только с металлами стоящие в ряду напряжений до водорода, но и со стоящими после него.
Хлорид бария может являться качественным реагентом на сульфат-анион
Производство серной кислоты является сложным многостадийным химическим процессом
Слайд 12Проверь себя
Вариант I Вариант II
В 1. А
Б 2. Г
А 3. А
А

4. В
В 5. Б











 Английский этикет
Английский этикет животные
животные Презентация на тему Человек прямоходящий (1 класс)
Презентация на тему Человек прямоходящий (1 класс) Строение солнечной системы
Строение солнечной системы Псалом 117, мессианский
Псалом 117, мессианский Часть 2.
Часть 2. Психология общения
Психология общения  Сибирский федеральный университет
Сибирский федеральный университет Мастер-класс для HR-ов на тему АССЕССМЕНТ:массовый (mass) и экспресс (express)(на примере проекта фонда В.Пинчука «ZAVTRA.UA»)
Мастер-класс для HR-ов на тему АССЕССМЕНТ:массовый (mass) и экспресс (express)(на примере проекта фонда В.Пинчука «ZAVTRA.UA») Творческая лаборатория. Педагогический проект по теме: «Сценическое воплощение литературного произведения». Автор проекта – уч
Творческая лаборатория. Педагогический проект по теме: «Сценическое воплощение литературного произведения». Автор проекта – уч Strategiia_i_taktika_upravleniia_biznesom_v_usloviiakh_konkurentsii_11507040
Strategiia_i_taktika_upravleniia_biznesom_v_usloviiakh_konkurentsii_11507040 Особенности организации управления в Вене
Особенности организации управления в Вене Праздники и традиции Великобритании
Праздники и традиции Великобритании Булат Окуджава
Булат Окуджава Давление твёрдых тел 7 класс
Давление твёрдых тел 7 класс Психологический климат в семье
Психологический климат в семье Внеурочная деятельность как составляющая образовательной деятельности
Внеурочная деятельность как составляющая образовательной деятельности Святковий концерт до Дня Святого МИколая презентували учні 3-А класу Бершадської ЗОШ №3
Святковий концерт до Дня Святого МИколая презентували учні 3-А класу Бершадської ЗОШ №3 Моктесума
Моктесума Удмуртская кухня
Удмуртская кухня Тренинг общения
Тренинг общения Объёмы тел
Объёмы тел Презентация на тему Страницы истории 19 века (4 класс)
Презентация на тему Страницы истории 19 века (4 класс) Форсайт. Взгляд в будущее
Форсайт. Взгляд в будущее Вариант 1 1. Органические соединения образуются в хлоропластах листьев: а. из воды и кислорода; в. хлорофилла; б. воды и
Вариант 1 1. Органические соединения образуются в хлоропластах листьев: а. из воды и кислорода; в. хлорофилла; б. воды и Антикафе Чтец
Антикафе Чтец «Золотое» сечение в архитектуре русских храмов
«Золотое» сечение в архитектуре русских храмов Урок 3 (Анимация. Движение по криволинейной)
Урок 3 (Анимация. Движение по криволинейной)