Слайд 2Цель урока:
Сформировать понятие о зависимости свойств соединений хрома от степени окисления элемента

через организацию исследовательской деятельности на уроке.
Слайд 3Планируемые результаты
Учащиеся должны знать: зависимость окислительно-восстановительных возможностей хрома от степени окисления (низшая,

промежуточная, высшая) в различных соединениях.
Учащиеся должны уметь: прогнозировать роль элемента как окислителя или восстановителя, а также продукты окислительно-восстановительного процесса в различных средах.
Слайд 4 «Ни одна наука не нуждается в эксперименте в такой степени, как

химия. Её основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим»
Майкл Фарадей
Слайд 5Открытие и название хрома
Минерал, содержащий хром, был открыт близ Екатеринбурга в 1766
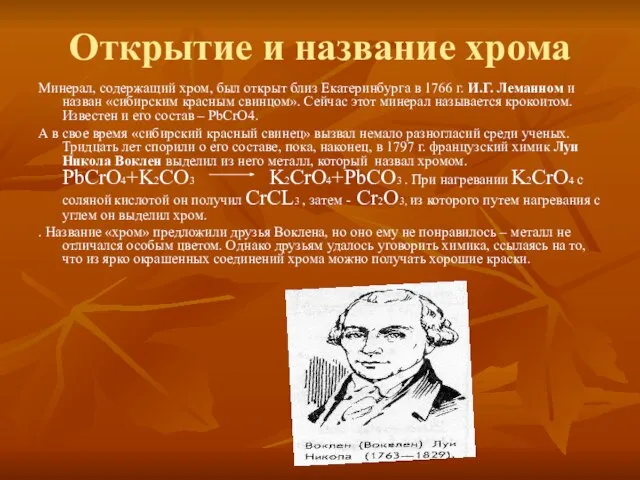
г. И.Г. Леманном и назван «сибирским красным свинцом». Сейчас этот минерал называется крокоитом. Известен и его состав – РbCrО4.
А в свое время «сибирский красный свинец» вызвал немало разногласий среди ученых. Тридцать лет спорили о его составе, пока, наконец, в 1797 г. французский химик Луи Никола Воклен выделил из него металл, который назвал хромом. PbCrO4+K2CO3 K2CrO4+PbCO3 . При нагревании K2CrO4 с соляной кислотой он получил CrCL3 , затем - Cr2O3, из которого путем нагревания с углем он выделил хром.
. Название «хром» предложили друзья Воклена, но оно ему не понравилось – металл не отличался особым цветом. Однако друзьям удалось уговорить химика, ссылаясь на то, что из ярко окрашенных соединений хрома можно получать хорошие краски.
Слайд 6Физические свойства хрома
Хром – это белый с голубоватым отливом блестящий металл,

один из самых твердых металлов. Обладает высокой химической стойкостью. Один из важнейших металлов, используемых в производстве легированных сталей. Большинство соединений хрома имеет яркую окраску, причем самых разных цветов. За эту особенность элемент и был назван хромом, что в переводе с греческого означает «краска». Атомная масса хрома 51,996. В менделеевской таблице он занимает место в шестой группе. Температура плавления хрома зависит от его чистоты. Сейчас считают, что хром плавится при температуре около 1875°C. Температура кипения 2199°C. Плотность хрома меньше, чем железа; она равна 7,19.
Слайд 7Химические свойства хрома
хром при обычных условиях неактивный металл. Это объясняется тем, что

его поверхность покрыта оксидной пленкой (Сr2О3). При нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами при высокой температуре:
4Сr +3О2 = 2Сr2О3
2Сr + 3S = Сr2S3
2Сr + 3Cl2 = 2СrСl3
Взаимодействие хрома со сложными веществами:
При очень высокой температуре хром реагирует с водой:
2Сr + 3 Н2О = Сr2О3 + 3Н2↑
Хром реагирует с разбавленной серной и соляной кислотами:
Сr + Н2SО4 = СrSО4 + Н2↑
Сr + 2НСl= СrСl2 + Н2↑
Концентрированные серная соляная и азотная кислоты пассивируют хром.
Слайд 10Интеллектуальная разминка
В 1843 г. немецкий химик Рудольф Беттгер, который прославился как

изобретатель современных спичек и взрывчатого вещества пироксилина, получил оранжево-красное кристаллическое вещество (NH4)2Cr2O7. Как обычно, он решил испытать это вещество на способность воспламеняться от горящей лучины. Насыпав на тарелку горку кристаллов, Беттгер поднес к ней горящую лучину. Перед ним предстала изумительная картина дымящего вулкана с вылетающими искрами, горка увеличивалась в размерах и приобрела зеленый цвет из-за образования оксида хрома(III).
(NH4)2Cr2O7 Cr2O3 + N2 + H2O ( внутримолекулярная ОВР)
Уравняйте данную реакцию методом электронного баланса.









 Методические рекомендации для разработкипроекта «Школа будущего»
Методические рекомендации для разработкипроекта «Школа будущего» Журнальный столик
Журнальный столик Лучшие футбольные клубы ОАЭ
Лучшие футбольные клубы ОАЭ Интерстициальное инфракрасное лазерное воздействие – эффективный органосохраняющий метод лечения доброкачественных узловых об
Интерстициальное инфракрасное лазерное воздействие – эффективный органосохраняющий метод лечения доброкачественных узловых об Визитная карточка компании
Визитная карточка компании Мафия
Мафия Русский национальный костюм
Русский национальный костюм Способы образования слов. Словосочетание
Способы образования слов. Словосочетание Законность и правопорядок
Законность и правопорядок Встало с краю улицы В длинном сапоге Чучело трёхглазое на одной ноге. Где машины движутся, Где сошлись пути, Помогает улицу Людям п
Встало с краю улицы В длинном сапоге Чучело трёхглазое на одной ноге. Где машины движутся, Где сошлись пути, Помогает улицу Людям п Использование йодной и серной шашек в птицеводстве
Использование йодной и серной шашек в птицеводстве текстовые задачи на дроби
текстовые задачи на дроби Моя будущая профессия юрист
Моя будущая профессия юрист СМИ
СМИ Ямайская денежная система
Ямайская денежная система Исполнение стратегии – Новый источник конкурентного преимуществаСистема сбалансированных показателей BSC
Исполнение стратегии – Новый источник конкурентного преимуществаСистема сбалансированных показателей BSC Живописная композиция в интерьере с небольшим количеством персонажей
Живописная композиция в интерьере с небольшим количеством персонажей Федеральный государственный образовательный стандарт общего образования в контексте государственной политики в образовании
Федеральный государственный образовательный стандарт общего образования в контексте государственной политики в образовании Storage Devices
Storage Devices Сложное дополнение
Сложное дополнение Административно-правовые формы и методы государственного управления
Административно-правовые формы и методы государственного управления ЦМС и ЦДАПрограммы для работы с испытательным стендом
ЦМС и ЦДАПрограммы для работы с испытательным стендом По творчеству Ф. М Достоевского
По творчеству Ф. М Достоевского КОРПОРАТИВНАЯ ПРОГРАММА «ДРУЖНАЯ СЕМЬЯ» ДЛЯ СЕМЕЙ РАБОТНИКОВ ОРГАНИЗАЦИЙ СИСТЕМЫ «ТРАНСНЕФТЬ»
КОРПОРАТИВНАЯ ПРОГРАММА «ДРУЖНАЯ СЕМЬЯ» ДЛЯ СЕМЕЙ РАБОТНИКОВ ОРГАНИЗАЦИЙ СИСТЕМЫ «ТРАНСНЕФТЬ» МПГУ в пространстве города
МПГУ в пространстве города Связьинвест: новые возможности роста
Связьинвест: новые возможности роста У Н И В Е Р С А Л
У Н И В Е Р С А Л Основи права України
Основи права України