Слайд 2
Нітратна кислота HNO3 характеризується деякими специфічними властивостями. Вона є сильним
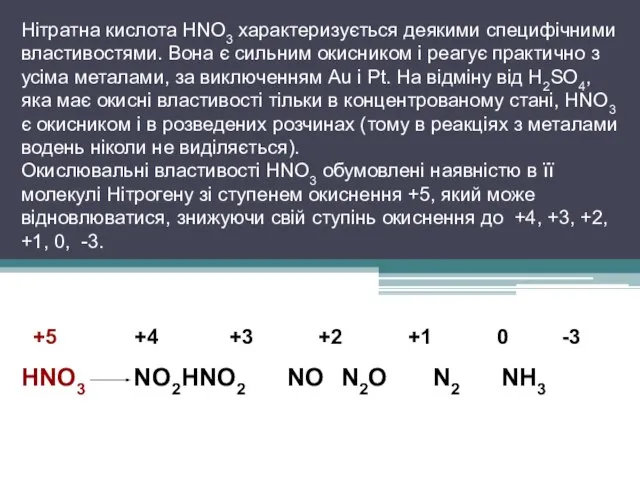
окисником і реагує практично з усіма металами, за виключенням Au і Pt. На відміну від H2SO4, яка має окисні властивості тільки в концентрованому стані, HNO3 є окисником і в розведених розчинах (тому в реакціях з металами водень ніколи не виділяється).
Окислювальні властивості HNO3 обумовлені наявністю в її молекулі Нітрогену зі ступенем окиснення +5, який може відновлюватися, знижуючи свій ступінь окиснення до +4, +3, +2, +1, 0, -3.
+5 +4 +3 +2 +1 0 -3
HNO3 NO2 HNO2 NO N2O N2 NH3
Слайд 3
Ме + HNO3 Ме(NO3)n+ + Н2О
Взаємодія HNO3 з металами.
водень не
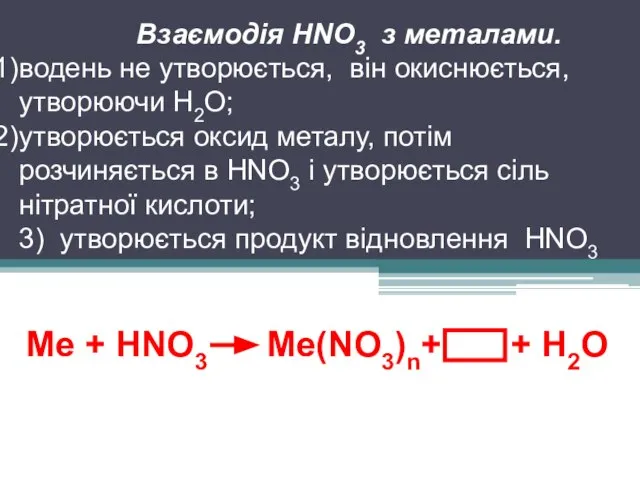
утворюється, він окиснюється, утворюючи Н2О;
утворюється оксид металу, потім розчиняється в HNO3 і утворюється сіль нітратної кислоти;
3) утворюється продукт відновлення HNO3
Слайд 4HNO3
Концентрована
Розведена
З лужно-
земельними,
а також
Zn
З
важкими
металами
+Fe
З лужними
і лужно-
земельними
металами.
З важкими
металами
Pb,Hg,
Ag,Cu.
На Au,
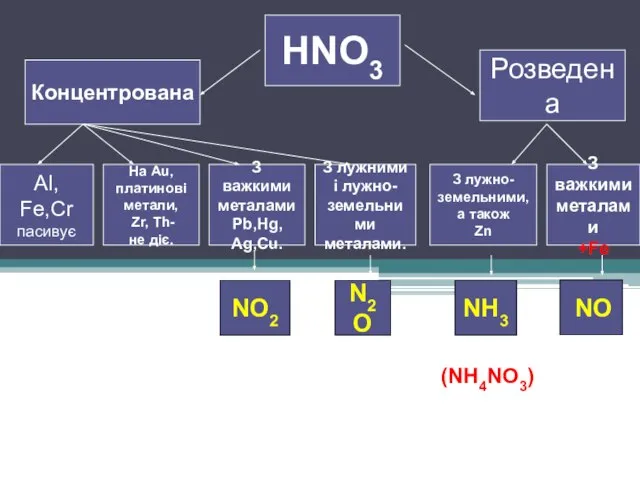
платинові
метали,
Zr, Th-
не діє.
Al, Fe,Cr
пасивує
NO2
N2O
NH3
NO
(NH4NO3)
Слайд 5Взаємодія HNO3 з міддю
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑+ H2O

бурий газ




 Русская литература 19 века в контексте мировой культуры
Русская литература 19 века в контексте мировой культуры YUFKIN FILMS Представляют Дерьмо,дерьмо, дерьмо Плачу 50 долларов.
YUFKIN FILMS Представляют Дерьмо,дерьмо, дерьмо Плачу 50 долларов. Преобразование двойных радикалов
Преобразование двойных радикалов От Петра І к Екатерине ІІ
От Петра І к Екатерине ІІ Презентация на тему История герба России
Презентация на тему История герба России Виды групповой работы и организация контроля учебной деятельности учащихся на уроке
Виды групповой работы и организация контроля учебной деятельности учащихся на уроке Стокгольмский синдром
Стокгольмский синдром Презентация на тему Островский "Гроза"
Презентация на тему Островский "Гроза" Сибирь
Сибирь Мы против терроризма
Мы против терроризма Пр4_Мод_Сист_Монга
Пр4_Мод_Сист_Монга 1663173619466__7x1efx (2)
1663173619466__7x1efx (2) Древняя и античная химия
Древняя и античная химия Финансовая система страны, ее сферы и звенья
Финансовая система страны, ее сферы и звенья Домашнее задание
Домашнее задание Презентация на тему Чудесные превращения воды в природе
Презентация на тему Чудесные превращения воды в природе  Походный мольберт, палитра, автомат
Походный мольберт, палитра, автомат Презентация Microsoft PowerPoint [Автосохраненный]
Презентация Microsoft PowerPoint [Автосохраненный] СП лекция-04ua
СП лекция-04ua Документальный фильм Аполлон-11
Документальный фильм Аполлон-11 Процессуальное право. Гражданский и арбитражный процесс
Процессуальное право. Гражданский и арбитражный процесс Анализ урока – один из главных инструментов управления качеством преподавания в школе
Анализ урока – один из главных инструментов управления качеством преподавания в школе Профилактика правонарушений. Профилактика вредных привычек
Профилактика правонарушений. Профилактика вредных привычек Презентация на тему Страницы истории Великой Отечественной войны
Презентация на тему Страницы истории Великой Отечественной войны внутриутробное развитие плода
внутриутробное развитие плода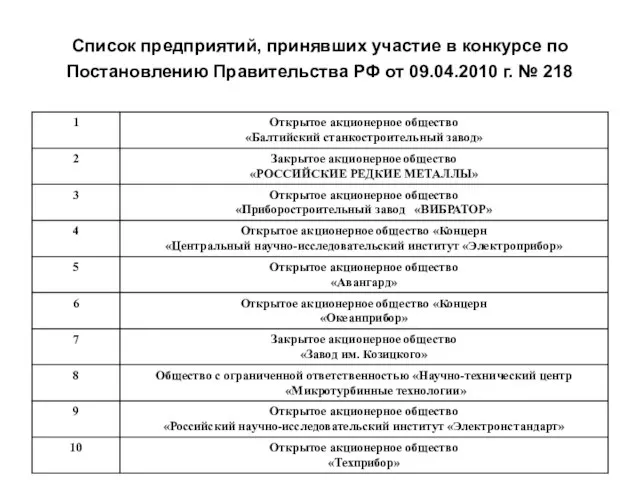 Список предприятий, принявших участие в конкурсе по Постановлению Правительства РФ от 09.04.2010 г. № 218
Список предприятий, принявших участие в конкурсе по Постановлению Правительства РФ от 09.04.2010 г. № 218 Авторское и смежное право
Авторское и смежное право Техника выполнения стойки на голове
Техника выполнения стойки на голове