Содержание
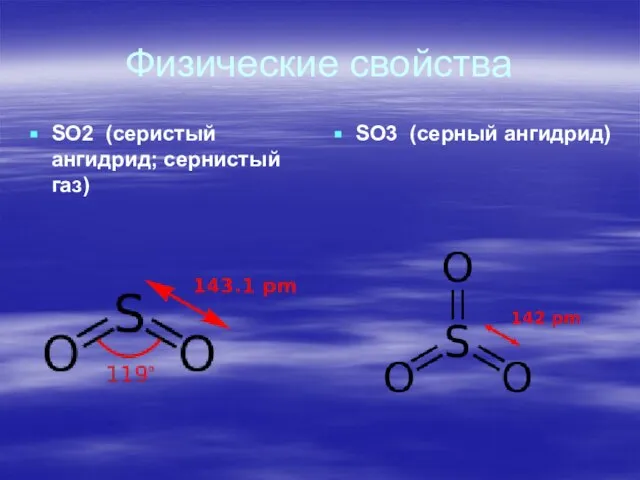
- 2. Физические свойства SO2 (серистый ангидрид; сернистый газ) SO3 (серный ангидрид)
- 3. Физические свойства Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных условиях представляет
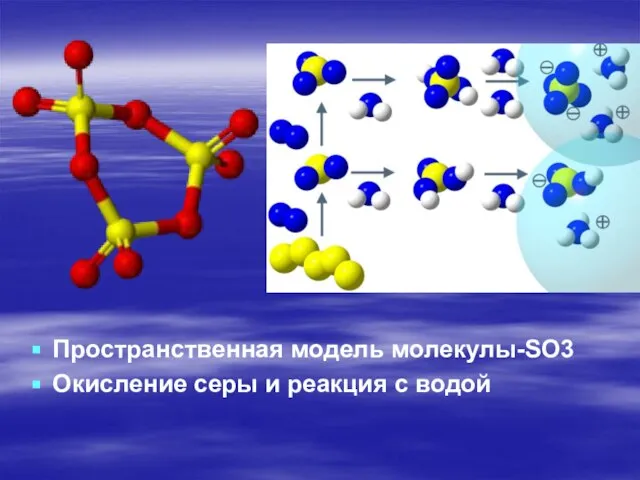
- 4. Пространственная модель молекулы-SO3 Окисление серы и реакция с водой
- 5. Применение SO2 обесцвечивает органические красителя и применяется для отбеливания шелка, шерсти и соломы. Этим газом окуривают
- 6. Главные источники Оксид серы (IV) поступает в воздух в результате сжигания топлива и плавки руд, содержащих
- 7. Поступления в организм Вещества могут поступать в организм различными путями: через рот, дыхательные пути, кожу, слизистые
- 8. Общий характер действия Раздражает дыхательные пути, вызывая спазм бронхов и увеличение сопротивления дыхательных путей. При воздействии
- 9. Острое отравление Кожный зуд, сыпи, фурункулез. Покраснение и опухание конъюнктивы. Появление мелких точечных дефектов на роговице.
- 10. Хроническое отравление SO2 токсичен. Симптомы - удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких,
- 11. Кислотные дожди скульптура из известняка одного из двенадцати апостолов на фронтоне церкви Святых Петра и Павла
- 12. Кислотные дожди Кислотный дождь — все виды метеорологических осадков — дождь, снег, град, туман, дождь со
- 13. Причины кислотных дождей Главной причиной кислотных дождей является присутствие в составе атмосферы Земли двуокиси серы SO2
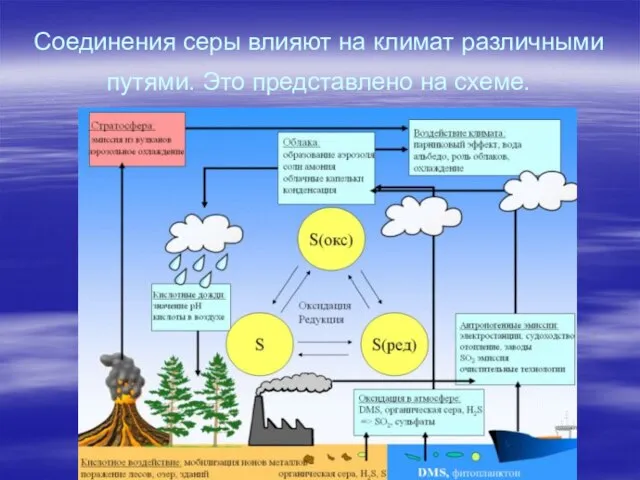
- 14. Соединения серы влияют на климат различными путями. Это представлено на схеме.
- 15. Экологические и экономические последствия Скульптура, пострадавшая от кислотного дождя Последствия выпадения кислотных дождей наблюдаются в США,
- 16. Экологические и экономические последствия Выделяют три стадии воздействия кислотных дождей на водоемы. Первая стадия — начальная.
- 17. Экологические и экономические последствия Лес после кислотного дождя Кислотный дождь наносит вред не только водной флоре
- 18. Интересные факты. Сера КИНОВАРЬ. Если в лаборатории разлили ртуть (возникла опасность отравления ртутными парами!), её первым
- 20. Скачать презентацию
Слайд 3Физические свойства
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных
Физические свойства
Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) — SO2. В нормальных

Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 - существует в двух аллотропных формах: жидкой и кристаллической. В природе не встречается, получается окислением диоксида серы. SO3 — высший оксид серы, тип химической связи: ковалентная полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Слайд 4
Пространственная модель молекулы-SO3
Окисление серы и реакция с водой
Пространственная модель молекулы-SO3
Окисление серы и реакция с водой
Слайд 5Применение
SO2 обесцвечивает органические красителя и применяется для отбеливания шелка, шерсти и соломы.
Применение
SO2 обесцвечивает органические красителя и применяется для отбеливания шелка, шерсти и соломы.

В пищевой промышленности диоксид серы используется как консервант и обозначается на упаковке под кодом Е220.
Применяется он также и в качестве растворителя в лабораториях. При таковом его применении следует помнить о возможном содержании в SO2 примесей в виде H2O и SO3. Их удаляют пропусканием через растворитель концентрированной H2SO4; это лучше делать под вакуумом или в другой закрытой аппаратуре
Серный ангидрид используют в основном в производстве серной кислоты.
Слайд 6Главные источники
Оксид серы (IV) поступает в воздух в результате сжигания топлива
Главные источники
Оксид серы (IV) поступает в воздух в результате сжигания топлива

Серный ангидрид SO3 выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке цветных металлов и производстве серной кислоты.
Слайд 7Поступления в организм
Вещества могут поступать в организм различными путями: через рот,
Поступления в организм
Вещества могут поступать в организм различными путями: через рот,

Слайд 8Общий характер действия
Раздражает дыхательные пути, вызывая спазм бронхов и увеличение
Общий характер действия
Раздражает дыхательные пути, вызывая спазм бронхов и увеличение

Слайд 9Острое отравление
Кожный зуд, сыпи, фурункулез.
Покраснение и опухание конъюнктивы.
Появление мелких точечных
Острое отравление
Кожный зуд, сыпи, фурункулез.
Покраснение и опухание конъюнктивы.
Появление мелких точечных

Ломота в бровях и глазных яблоках, ощущением песка в глазах.
Светобоязнь, слезотечение.
Общая слабость, головные боли, головокружение, тошнота.
Ослабление слуха.
Расстройства пищеварения, поносы.
Судороги и потеря сознания (при острой интоксикации).
Психические нарушения, понижение интеллекта
Слайд 10Хроническое отравление
SO2 токсичен. Симптомы - удушье, расстройство речи, затруднение глотания, рвота, возможен
Хроническое отравление
SO2 токсичен. Симптомы - удушье, расстройство речи, затруднение глотания, рвота, возможен

При длительном воздействии диоксида серы увеличивается число заболеваний раком.
Сернистый ангидрид может вызывать общее отравление организма, проявляющееся в изменении состава крови, поражении органов дыхания, повышении восприимчивости к инфекционным заболеваниям. Развивается нарушение обмена веществ, повышение артериального давления у детей, ларингит, конъюнктивит, ринит, бронхопневмония, аллергические реакции, острые заболевания верхних дыхательных путей и системы кровообращения. При кратковременном воздействии – раздражение слизистой оболочки глаз, слезотечение, затруднение дыхания, тошнота, рвота, головные боли. Повышенная утомляемость, ослабление мышечной силы, снижение памяти. Замедление восприятия, ослабление функциональной способности сердца, изменение бактерицидности кожи.
Слайд 11Кислотные дожди
скульптура из известняка одного из двенадцати апостолов на фронтоне церкви Святых
Кислотные дожди
скульптура из известняка одного из двенадцати апостолов на фронтоне церкви Святых

копия поврежденной оригинальной скульптуры апостола.
Слайд 12Кислотные дожди
Кислотный дождь — все виды метеорологических осадков — дождь, снег, град, туман, дождь
Кислотные дожди
Кислотный дождь — все виды метеорологических осадков — дождь, снег, град, туман, дождь

Впервые термин «кислотный дождь» был введен в 1872 году английским исследователем Робертом Смитом. Его внимание привлек викторианский смог в Манчестере. И хотя ученые того времени отвергли теорию о существовании кислотных дождей, сегодня уже никто не сомневается, что кислотные дожди являются одной из причин гибели жизни в водоемах, лесов, урожаев, и растительности. Кроме того, кислотные дожди разрушают здания и памятники культуры, трубопроводы, приводят в негодность автомобили, понижают плодородие почв и могут приводить к просачиванию токсичных металлов в водоносные слои почвы.
Слайд 13Причины кислотных дождей
Главной причиной кислотных дождей является присутствие в составе атмосферы
Причины кислотных дождей
Главной причиной кислотных дождей является присутствие в составе атмосферы

Слайд 14Соединения серы влияют на климат различными путями. Это представлено на схеме.
Соединения серы влияют на климат различными путями. Это представлено на схеме.
Слайд 15Экологические и экономические последствия
Скульптура, пострадавшая от кислотного дождя
Последствия выпадения кислотных дождей наблюдаются
Экологические и экономические последствия
Скульптура, пострадавшая от кислотного дождя
Последствия выпадения кислотных дождей наблюдаются

Слайд 16Экологические и экономические последствия
Выделяют три стадии воздействия кислотных дождей на водоемы.
Экологические и экономические последствия
Выделяют три стадии воздействия кислотных дождей на водоемы.

Слайд 17Экологические и экономические последствия
Лес после кислотного дождя
Кислотный дождь наносит вред
Экологические и экономические последствия
Лес после кислотного дождя
Кислотный дождь наносит вред

Слайд 18Интересные факты. Сера
КИНОВАРЬ. Если в лаборатории разлили ртуть (возникла опасность отравления ртутными
Интересные факты. Сера
КИНОВАРЬ. Если в лаборатории разлили ртуть (возникла опасность отравления ртутными

СЕРОБАКТЕРИИ. В природе постепенно происходит круговорот серы, подобный круговороту азота и углерода. Растения потребляют серу — ведь её атомы входят в состав белка. Растения берут серу из растворимых сульфатов, а гнилостные бактерии превращают серу белков в сероводород (отсюда — отвратительный запах гниения). Но есть так называемые серобактерии, которым вообще не нужна органическая пища. Они питаются сероводородом, и в их организмах в результате реакции между H2S, CO2 и O2 образуются углеводы и элементарная сера. Серобактерии нередко оказываются переполнены крупинками серы — почти всю их массу составляет сера с очень небольшой "добавкой" органических веществ.
 ОАО «Международный аэропорт Шереметьево»Программа инновационного развития 2011-2015
ОАО «Международный аэропорт Шереметьево»Программа инновационного развития 2011-2015 Государство и его граждане
Государство и его граждане Кейс — стади в современном языковом образовании
Кейс — стади в современном языковом образовании Критерии оценки организации личности. Пограничный и психотический уровень организации личности
Критерии оценки организации личности. Пограничный и психотический уровень организации личности Пограничное расстройство личности
Пограничное расстройство личности Система высшего образования США
Система высшего образования США Энергосберегающие технологии MITSUBISHI ELECTRIC
Энергосберегающие технологии MITSUBISHI ELECTRIC Индекс готовности регионов России к информационному обществу. 2005-2006ИКТ в социальной сфере(образование, здравоохранение, культур
Индекс готовности регионов России к информационному обществу. 2005-2006ИКТ в социальной сфере(образование, здравоохранение, культур Крымское республиканское общество по защите прав инвалидов «Надежда»
Крымское республиканское общество по защите прав инвалидов «Надежда» Правописание Н и НН в суффиксах отыменных прилагательных
Правописание Н и НН в суффиксах отыменных прилагательных Презентация на тему :
Презентация на тему : Возможности операционной системы Linux в учебном процессе
Возможности операционной системы Linux в учебном процессе Проблематика и поэтика сказок М.Е. Салтыкова-Щедрина
Проблематика и поэтика сказок М.Е. Салтыкова-Щедрина Приглашаем студентов ВУЗов 2 курса направления Строительство на профиль: Экспертиза и управление недвижимостью
Приглашаем студентов ВУЗов 2 курса направления Строительство на профиль: Экспертиза и управление недвижимостью Рисование в нетрадиционной технике
Рисование в нетрадиционной технике Росавиация: полномочия и функции в сфере обеспечения национальной безопасности
Росавиация: полномочия и функции в сфере обеспечения национальной безопасности Творчество Уильяма Шекспира
Творчество Уильяма Шекспира Ежегодно в нашей стране рождаются несколько тысяч детей с черепно-лицевыми деформациями различного происхождения. Из-за отсутств
Ежегодно в нашей стране рождаются несколько тысяч детей с черепно-лицевыми деформациями различного происхождения. Из-за отсутств Театры г. Красноярска
Театры г. Красноярска УПРАВЛЕНЧЕСКИЙКОНСАЛТИНГ
УПРАВЛЕНЧЕСКИЙКОНСАЛТИНГ презентация ис-21
презентация ис-21 Подростковая психология и воспитание
Подростковая психология и воспитание Миронов курсач1
Миронов курсач1 Сергей ЕсенинАнискова С.П.,учитель русского языка и литературыМОУ № 78
Сергей ЕсенинАнискова С.П.,учитель русского языка и литературыМОУ № 78 Презентация на тему Основные типы лечебно-профилактических учреждений
Презентация на тему Основные типы лечебно-профилактических учреждений  Музыкальный театр
Музыкальный театр f15daad05ea648dc9a6d519cf38d4de6
f15daad05ea648dc9a6d519cf38d4de6 Механическое полирование
Механическое полирование