Содержание
- 2. Основания - сложные вещества, состоящие из атомов металла, соединённых с одной или несколькими гидроксогруппами Общая формула:
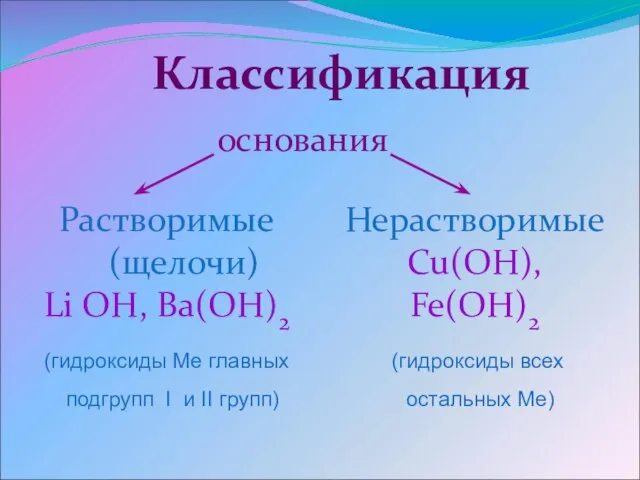
- 3. основания Растворимые (щелочи) Li OH, Ba(OH)2 (гидроксиды Ме главных подгрупп I и II групп) Нерастворимые Cu(OH),
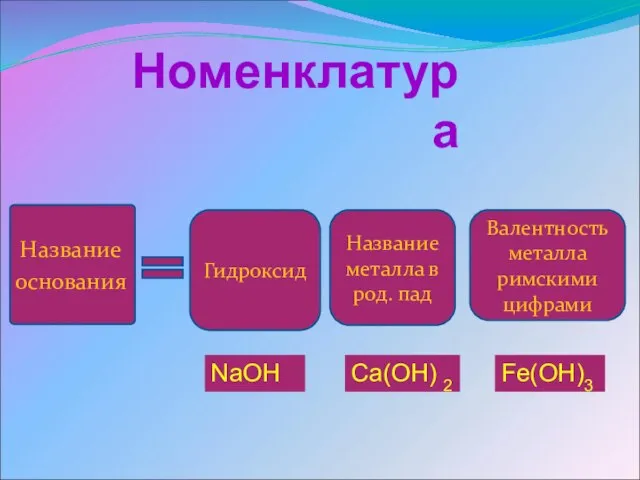
- 4. Номенклатура Название основания Гидроксид Название металла в род. пад Валентность металла римскими цифрами Fe(OH)3 Ca(OH) 2
- 5. Химические свойства оснований Качественные реакции Взаимодействия с кислотами Взаимодействие с оксидами неметаллов
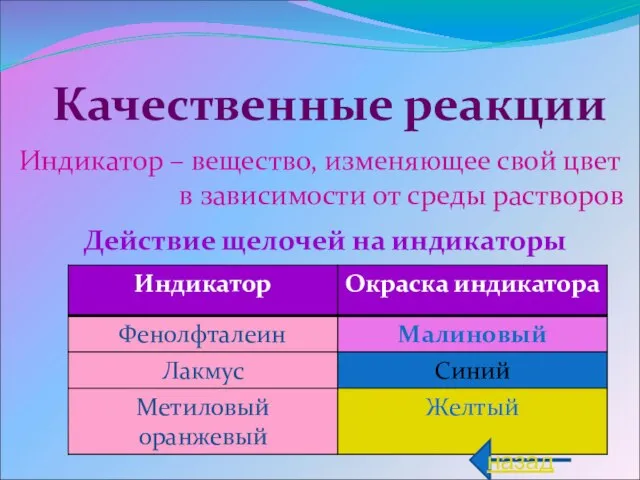
- 6. Индикатор – вещество, изменяющее свой цвет в зависимости от среды растворов Действие щелочей на индикаторы Качественные
- 7. Взаимодействие с кислотами
- 8. Нейтрализация Нейтрализация- реакция кислот с основаниями, приводящая к образованию соли и воды: NaOH + HCl =
- 9. Взаимодействие с оксидами неметаллов NaOH + CO2 = Na2CO3 + H2O Ca(OH)2 + CO2 = CaCO3
- 10. КИСЛОТЫ
- 11. Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл и кислотного остатка ОБЩАЯ
- 12. НОМЕНКЛАТУРА КИСЛОТ
- 13. А) по числу атомов водорода (основность) Кислоты кислородные бескислородные H2SO4 – серная кислота HNO3 - азотная
- 14. Химические свойства кислот Действие кислот на индикаторы Взаимодействие с металлами С основными оксидами С основаниями С
- 15. Качественные реакции назад Действие кислот на индикаторы
- 16. 2. Взаимодействие с металлами 2HCl + Fe=FeCl2 + H2 H2SO4 + Zn=ZnSO4 + H2 (стоящими в
- 17. 3. Взаимодействие с основными оксидами t 2HCl + CaO = CaCl2 + H2O t H2SO4+ CuO
- 18. 4. Взаимодействие с основаниями HCL + NaOH = NaCl + H2O H2SO4 + Ba(OH)2 = BaSO4
- 19. 5. Взаимодействие с солями Более сильные кислоты вытесняют из солей более слабые кислоты. 2HCl + Na2S
- 20. Нахождение кислот в природе (органические) яблочная щавелевая муравьиная лимонная молочная
- 21. Применение кислот Очистка поверхности металлов Очистка нефтепродуктов Получение красок Получение лекарств Получение пластмасс и искусственных волокон
- 23. Скачать презентацию

















 Текстовое ранжирование в Яндексе. Особенности подхода TF*IDF.
Текстовое ранжирование в Яндексе. Особенности подхода TF*IDF. Презентация на тему Роль инновационных технологий в повышении качества образования
Презентация на тему Роль инновационных технологий в повышении качества образования Химия в быту
Химия в быту Презентация на тему Направленность личности (10 класс)
Презентация на тему Направленность личности (10 класс) Убежища и укрытия
Убежища и укрытия Президенты США
Президенты США Конфликты, возникающие внутри организации
Конфликты, возникающие внутри организации Санкт Петербург, 03 декабря 2002 г.. Акционеры Банка До июля 2000 г. :53% ЕБРР 47% ФЭРС собственные средства: 3 млн. USD Увеличение капитала на 10
Санкт Петербург, 03 декабря 2002 г.. Акционеры Банка До июля 2000 г. :53% ЕБРР 47% ФЭРС собственные средства: 3 млн. USD Увеличение капитала на 10  EICC-KEMEROVO
EICC-KEMEROVO Как мы сделали это
Как мы сделали это The principles of design
The principles of design Обучение граждан, пострадавших вследствии короновирусной инфекции. Федеральная программа
Обучение граждан, пострадавших вследствии короновирусной инфекции. Федеральная программа Содержание
Содержание Технология обеспечения качества Компилятора
Технология обеспечения качества Компилятора Click to edit Master title style Click to edit Master subtitle style
Click to edit Master title style Click to edit Master subtitle style  Институциональные инвесторы на рынке ценных бумаг
Институциональные инвесторы на рынке ценных бумаг Взлетно-посадочная механизация крыла. Назначение и основные схемы шасси. Основы устройства силовых установок и их конструкция
Взлетно-посадочная механизация крыла. Назначение и основные схемы шасси. Основы устройства силовых установок и их конструкция Немного о программе: В 2010 году в Беларуси вышел первый сезон программ «Брэйн-ринг». После успешных эфиров и многочисленных заявок н
Немного о программе: В 2010 году в Беларуси вышел первый сезон программ «Брэйн-ринг». После успешных эфиров и многочисленных заявок н Программа Как быстро закрыть кредиты и увеличить свой доход в 2 раза за 90 дней
Программа Как быстро закрыть кредиты и увеличить свой доход в 2 раза за 90 дней Steps to Your Career (Doctor)
Steps to Your Career (Doctor) Буква Ы (1 класс)
Буква Ы (1 класс) Презентация по физике на тему:
Презентация по физике на тему: Am, is или are?
Am, is или are? Halloween. Ogtober, 31
Halloween. Ogtober, 31 Обучение технике перемещения на площадке
Обучение технике перемещения на площадке Изонить
Изонить Я родился
Я родился Порядок слов в предложении. Логическое ударение
Порядок слов в предложении. Логическое ударение