Содержание
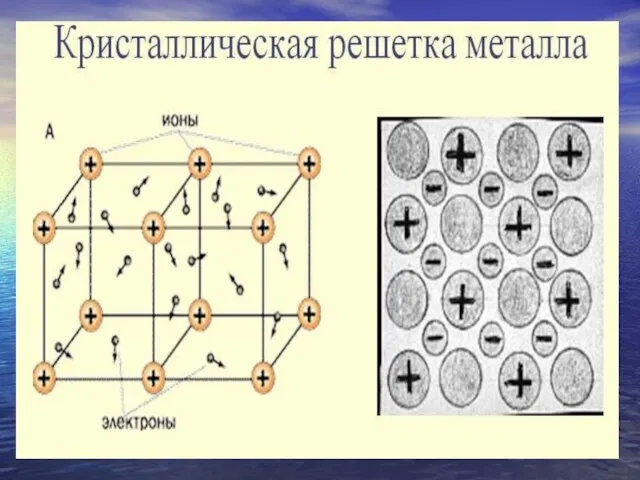
- 2. Химические элементы, в зависимости от строения и свойств их атомов: металлы неметаллы
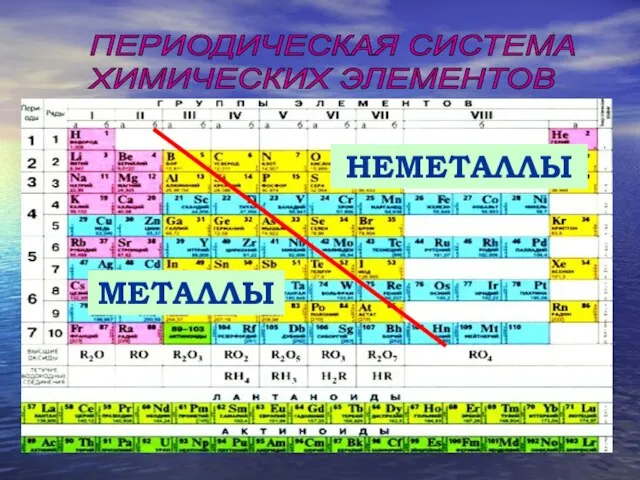
- 3. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ МЕТАЛЛЫ НЕМЕТАЛЛЫ
- 4. Положение неметаллических элементов в периодической системе химических элементов
- 5. Неметаллы Большое число е на внешнем уровне (4-8), иск. водород и бор Принимают недостающие е –
- 9. Щелочные металлы – главная подгруппа I группы – отдают 1 е – образуют щелочи Щелочноземельные металлы
- 10. Переходные элементы, проявляющие в соединениях амфотерные свойства 9 элементов главных подгрупп: бериллий(4), алюминий(13), галлий(31), германий(32), олово(50),
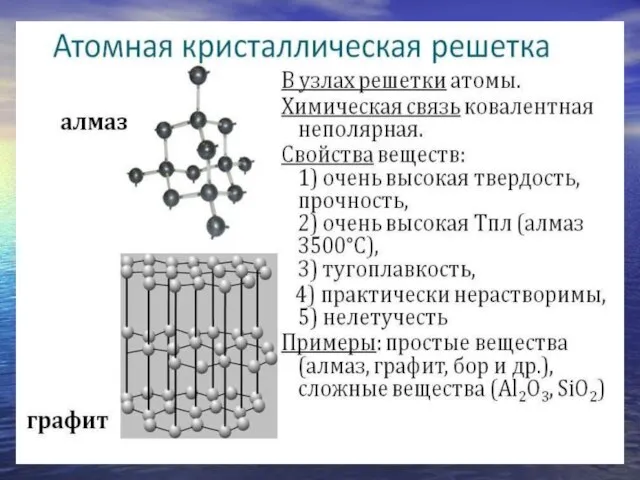
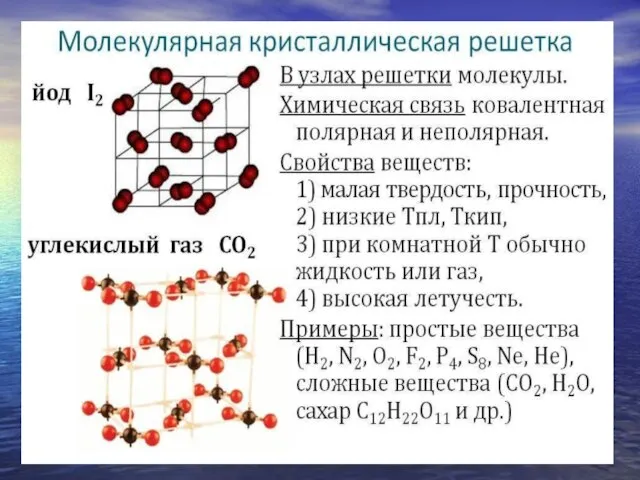
- 11. Сложные вещества по химическим свойствам: Оксиды Гидроксиды (Основания, Кислоты) Соли
- 12. Оксиды – сложные вещества, состоящие из двух элементов, одним из которых является О.
- 13. Оксиды солеобразующие (образуют соли – СuO, SO3) несолеобразующие (не дают солей – СО, NО)
- 14. Оксиды (по химическим свойствам) основные (гидраты которых являются основаниями – CaO, Na2O)
- 15. Оксиды (по химическим свойствам) кислотные (гидраты которых являются кислотами - SO3, CO2)
- 16. Оксиды (по химическим свойствам) амфотерные (проявляют либо основные, либо кислотные свойства – ZnO, Al2O3)
- 17. Основания – сложные вещества, молекула которых состоит из атома Ме и одной или нескольких гидроксильных групп.
- 18. Основания Гидроксиды щелочных и щелочно-земельных Ме – щелочи (КОН, NаОН, Ва(ОН)2)
- 19. Основания по количеству гидроксильных групп: однокислотные (NаОН), двукислотные (Ва(ОН)2), многокислотные (Fe(ОН)3).
- 20. Химические свойства щелочей растворы имеют рН>7 изменяют окраску индикаторов: - лакмус – синяя, - фенолфталеин –
- 21. Химические свойства нерастворимых оснований не изменяют окраску индикаторов. при нагревании разлагаются Cu(OH)2 → CuO + H2O
- 22. Кислоты сложные вещества, молекулы которых состоят из атомов Н и кислотного остатка. Общая формула - НnК,
- 23. Кислоты по количеству атомов водорода: одноосновные (HCl, HNO3), двухосновные (H2SO4 , H2S) многоосновные (H3PO4).
- 24. Кислоты по элементному составу: кислородсодержащие (HNO3 , H3PO4) бескислородные (HCl, H2S)
- 25. Номенклатура кислот и солей
- 26. Номенклатура кислот и солей
- 27. Номенклатура кислот и солей
- 28. Химические свойства кислот растворы имеют рН изменяют окраску индикаторов: - лакмус – красная, - фенолфталеин –
- 29. Амфотерные гидроксиды две формы Zn(OН)2 – основная и кислотная: Zn(OН)2 и H2ZnO2
- 30. Амфотерные гидроксиды и с основаниями, и с кислотами: Zn(OН)2 + 2NaOH = Na2ZnO2 + 2H2O Zn(OН)2
- 31. Соли – продукты полного или частичного замещения атомов Н в молекуле кислоты на Ме (искл. ион
- 32. Соли или продукт полного или частичного замещения -ОН в основании на кислотный остаток. Например, AlOHCl2 и
- 33. Соли от состава: средние – продукты полного замещения атомов Н в молекуле кислоты (MgSO4 , Ca3(PO4)2)
- 34. Соли от состава: кислые - частичного замещения Н (КН2PO4 , К2НPO4) – гидро-
- 35. Соли от состава: основные – частичного замещения ОН (Al(OH)2Cl , MgOHI) – гидроксо-
- 37. Скачать презентацию






























 Работа с неблагополучной семьёй. Документация
Работа с неблагополучной семьёй. Документация Программа духовно – нравственного развития и воспитания обучающихся Начальное общее образование
Программа духовно – нравственного развития и воспитания обучающихся Начальное общее образование СИСТЕМА УПРАВЛЕНИЯ БЕЗОПАСНОСТЬЮ ПОЛЕТОВАВИАЦИОННОГО КОМПЛЕКСА РОССИИ поправка 101 к Прил 8 ИКАОСУБП РОССИИSMS RUSSIA
СИСТЕМА УПРАВЛЕНИЯ БЕЗОПАСНОСТЬЮ ПОЛЕТОВАВИАЦИОННОГО КОМПЛЕКСА РОССИИ поправка 101 к Прил 8 ИКАОСУБП РОССИИSMS RUSSIA Нестудийный свет
Нестудийный свет Инициативное бюджетирование
Инициативное бюджетирование правда и вымыслы об акулах
правда и вымыслы об акулах Презентация на тему Европа и мир в конце XIX начале XX века
Презентация на тему Европа и мир в конце XIX начале XX века  Выпускная квалификационная работа: изучение параметров частотомера
Выпускная квалификационная работа: изучение параметров частотомера «Говорящие» фамилии в рассказах А.П. Чехова как средство художественной выразительности.
«Говорящие» фамилии в рассказах А.П. Чехова как средство художественной выразительности. Научный кружок Современные проблемы теории и практики перевода
Научный кружок Современные проблемы теории и практики перевода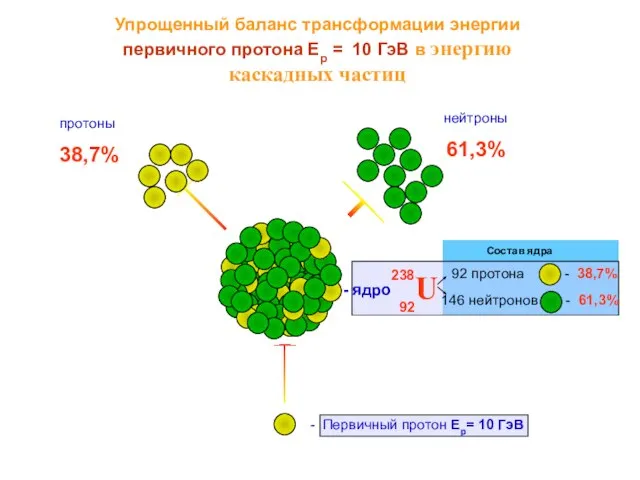 61,3%
61,3% ex 5 p 34 (for oral competency)
ex 5 p 34 (for oral competency)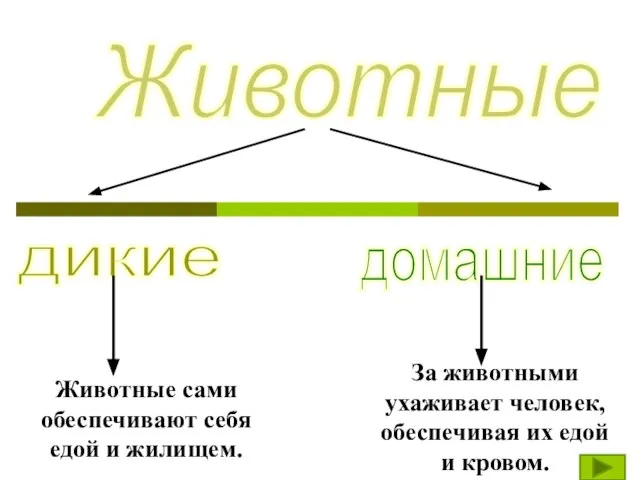 Животные
Животные Средства массовой информации в политической системе
Средства массовой информации в политической системе Куда же нас заведет Болонский процесс? Звонов Валерий Степанович, профессор кафедры физики и теплотехники Санкт-Петербургского
Куда же нас заведет Болонский процесс? Звонов Валерий Степанович, профессор кафедры физики и теплотехники Санкт-Петербургского  РАСЧЕТНО-КАССОВЫЕ УСЛУГИ БАНКА «УРАЛСИБ» ДЛЯ ЮРИДИЧЕСКИХ ЛИЦ И ИНДИВИДУАЛЬНЫХ ПРЕДПРИНИМАТЕЛЕЙ
РАСЧЕТНО-КАССОВЫЕ УСЛУГИ БАНКА «УРАЛСИБ» ДЛЯ ЮРИДИЧЕСКИХ ЛИЦ И ИНДИВИДУАЛЬНЫХ ПРЕДПРИНИМАТЕЛЕЙ Языкознание – наука о развитии языка, об общественной природе, о выполняемых функциях и о классификации языков. Язык может быть ка
Языкознание – наука о развитии языка, об общественной природе, о выполняемых функциях и о классификации языков. Язык может быть ка Зевс – бог неба, грома и молний!
Зевс – бог неба, грома и молний! Итоги XXII Олимпийских зимних игр в Сочи
Итоги XXII Олимпийских зимних игр в Сочи 100VG-AnyLAN
100VG-AnyLAN Вихретоковый Неразрушающий Контроль
Вихретоковый Неразрушающий Контроль Худшее в практике интранета, или 10 способов загубить интранет Sam Marshall
Худшее в практике интранета, или 10 способов загубить интранет Sam Marshall  Аудитория интернета Украины
Аудитория интернета Украины Анализ отраслевых методов идентификации спиртов
Анализ отраслевых методов идентификации спиртов 2_Биология_7 кл_Позвоночные и беспозвоночные животные
2_Биология_7 кл_Позвоночные и беспозвоночные животные Литературный ринг по изученным произведениям
Литературный ринг по изученным произведениям Имиджевое значение цветов на основе концепции Люшера Ткачук Илья PR 401
Имиджевое значение цветов на основе концепции Люшера Ткачук Илья PR 401 Расчет дуговой сталеплавильной печи емкостью 60 т, кислый процесс
Расчет дуговой сталеплавильной печи емкостью 60 т, кислый процесс