Содержание
- 3. Понятие атом возникло ещё в античном мире для обозначения частиц вещества.
- 4. Ученые древности о строении вещества Древнегреческий ученый Демокрит 2500 лет назад считал, что любое вещество состоит
- 5. СТОНЕИ (Стони) Джордж Джонстон (Stoney George Johnstone) (15.II.1826 – 5.VII.1911) — ирландский физик и математик, член
- 6. История открытия строения атома. Уильям Крукс В 1879 году открыл катодные лучи.
- 7. Джозеф Томсон и Жан Перрен доказали, что электроны несут на себе отрицательный заряд Джозеф Томсон Жан
- 8. История открытия строения атома. Дж. Томсон. Доказал, что электроны несут на себе отрицательный заряд, определил массу
- 10. Открытие радиоактивности Анри Беккерель Расщепление радиоактивного излучения
- 11. Эрнест Резерфорд В 1910 г. Эрнест Резерфорд со своими учениками и коллегами изучал рассеивание альфа-частиц, проходящих
- 12. Доказал, что атом имеет плотное ядро. Предложил планетарную теорию строения атома. Э. Резерфорд
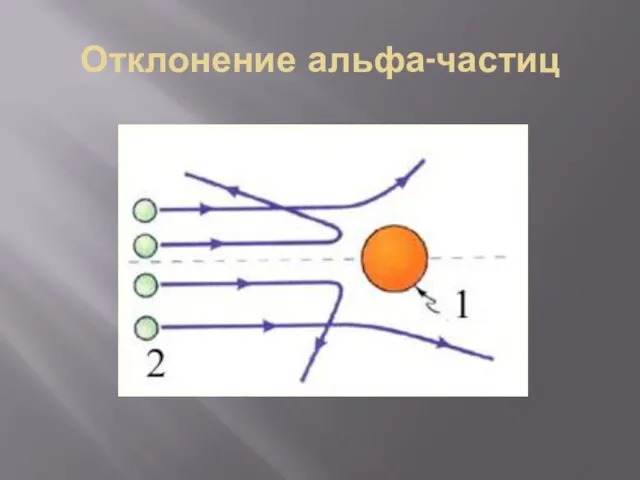
- 15. Отклонение альфа-частиц
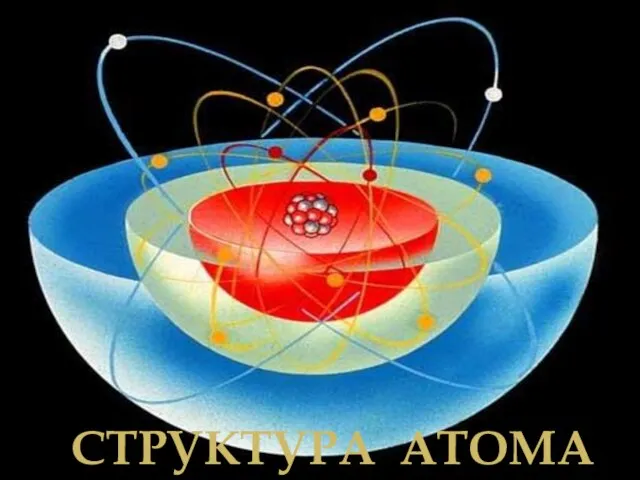
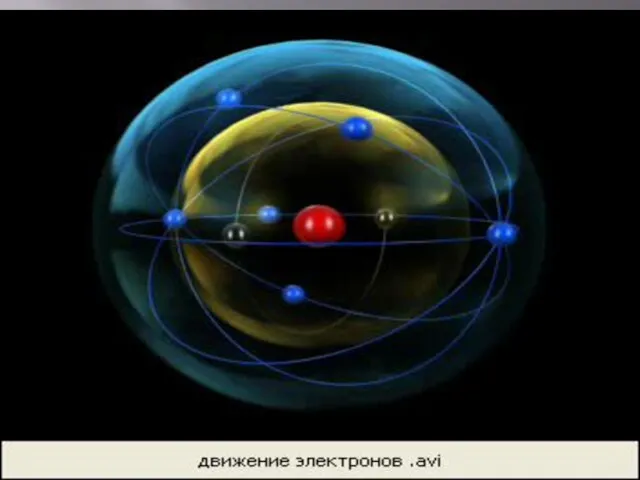
- 16. СТРУКТУРА АТОМА
- 17. В 1911 г. английский ученый Э. Резерфорд доказал ,что в центре атома имеется положительно заряженное ядро.
- 18. Планетарная модель строения атома РЕЗЕРФОРД ПРЕДПОЛОЖИЛ, ЧТО АТОМ УСТРОЕН ПОДОБНО ПЛАНЕТАРНОЙ СИСТЕМЕ. СУТЬ МОДЕЛИ СТРОЕНИЯ АТОМА
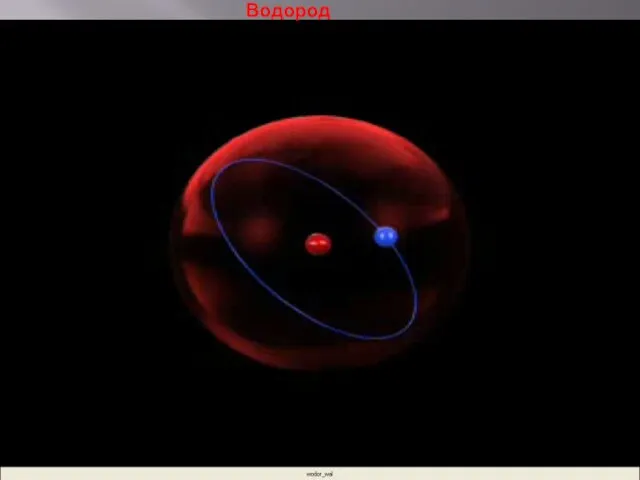
- 19. Водород
- 21. Характеристики элементарных частиц
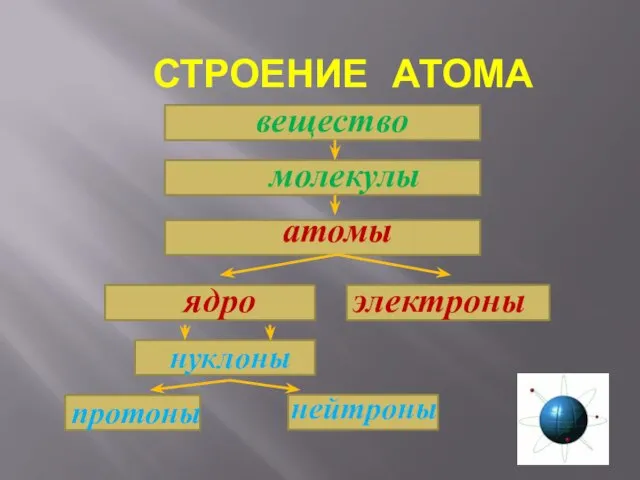
- 22. СТРОЕНИЕ АТОМА вещество молекулы атомы нуклоны
- 23. Число протонов в атоме равно порядковому номеру. Число электронов в атоме равно числу протонов. Число нейтронов
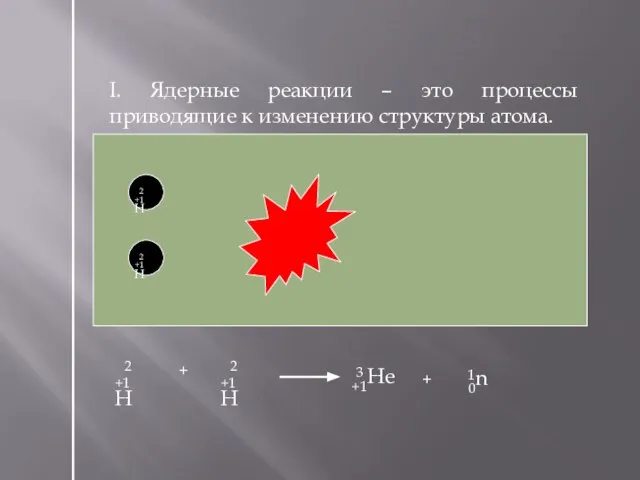
- 24. Изменение в составе ядер атомов химических элементов. Ядерные реакции. Изотопы
- 25. I. Ядерные реакции – это процессы приводящие к изменению структуры атома. +1Н 2 +1Н 2 +1Не
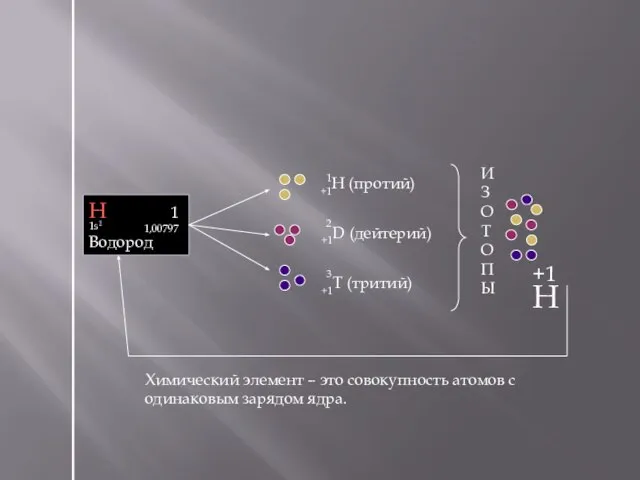
- 27. +1H (протий) +1D (дейтерий) +1T (тритий) Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
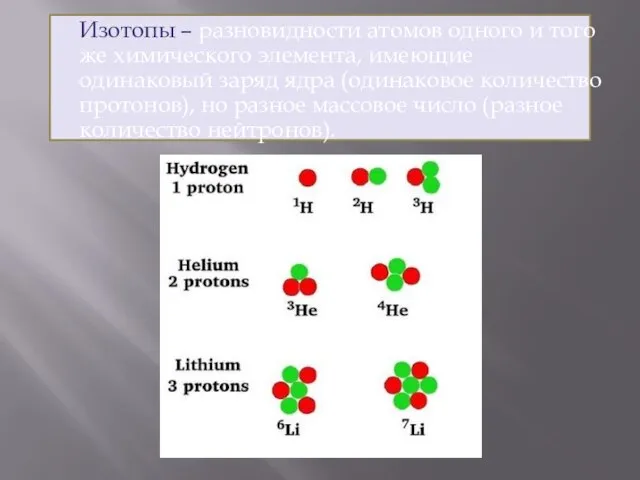
- 28. Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра (одинаковое количество
- 32. Скачать презентацию




















 MadameTussaud’s Музей Восковых фигур Мадам Тюссо
MadameTussaud’s Музей Восковых фигур Мадам Тюссо Место учебного исследования в программе Intel «Обучение для будущего»
Место учебного исследования в программе Intel «Обучение для будущего» Потребительские кредиты
Потребительские кредиты Организация пастбищного содержания животных
Организация пастбищного содержания животных А
А Структура ВС РФ
Структура ВС РФ Северная Америка
Северная Америка «Как продолжается детство»
«Как продолжается детство» Молодые менеджеры и предприниматели Кубани
Молодые менеджеры и предприниматели Кубани Презентация на тему Углекислый газ СО2
Презентация на тему Углекислый газ СО2  Солнце воздух и вода – наши лучшие друзья
Солнце воздух и вода – наши лучшие друзья Лапта. История развития
Лапта. История развития Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз
Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз Презентация на тему Экологические кризисы и экологические катастрофы
Презентация на тему Экологические кризисы и экологические катастрофы История Громова Процессы на постсоветском пространстве
История Громова Процессы на постсоветском пространстве Шамшур
Шамшур Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности»
Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности» Тема урока
Тема урока Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс
Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс Презентация на тему Свет и его законы
Презентация на тему Свет и его законы  Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК
Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК Art City. Подбор квартиры
Art City. Подбор квартиры Фалсафа - 5
Фалсафа - 5 врол
врол Бабаево – взгляд с любовью (городской путеводитель)
Бабаево – взгляд с любовью (городской путеводитель) Бесприборные тесты для подтверждения ВИЧ-Инфекции
Бесприборные тесты для подтверждения ВИЧ-Инфекции Техника безопасностииорганизация рабочего места
Техника безопасностииорганизация рабочего места Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).
Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).