Слайд 3Необходимость в биоинформатических методах обусловлена:
Накоплением знаний в различных областях биологии, необходимость в

систематизации и обработке
2001-2003 Закончено секвенирование человеческого генома. Следующий этап – описание всех белков и их взаимодействий
Необходимость моделирования в процессе создания новых лекарств
Слайд 4Материя
Из чего сделаны живые организмы и Вселенная
Все что имеет массу и занимает

место
Виды материи
Твердая – имеет определенный объем и форму
Жидкая – имеет определенный объем и меняющуюся форму
Газовая – имеет меняющуюся форму и объем
Слайд 5Энергия
Способность выполнять какую-либо работу
Типы энергии
Кинетическая – энергия в действии
Потенциальная – энергия

позиции; неактивная энергия запаса
Слайд 6Формы энергии
Химическая – энергия, запасенная в химических связях
Электрическая – происходит в результате

движения заряженных частиц
Механическая – прямо включена в движение материи
Электромагнетическая – энергия, передвигающаяся в виде волн (например, видимый свет, ультрафиолетовый свет, рентгеновские лучи
Слайд 7Трансформация энергии
Одна форма энергии может легко переходить в другую
В процессе такой трансформации,

часть энергии может быть потеряна в виде «тепла»
Клетка – поддерживает внутреннюю упорядоченность как неизолированная система, выделяющая часть энергии в виде тепла
Слайд 8Состав материи
Элементы – уникальные вещества, которые не могут быть разрушены обыкновенными химическими

способами
Атомы – более или менее идентичные составные части всех элементов
Одна или две латинские буквы обозначают каждый элемент
Слайд 9Свойства элемента
Каждый элемент имеет уникальные химические и физические свойства
Физические свойства – могут

быть восприняты органами чувств
Химические свойства – описывают как атомы реагируют между собой
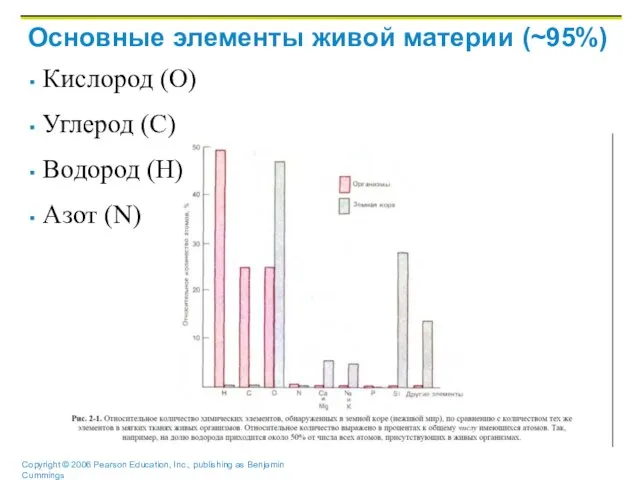
Слайд 10Основные элементы живой материи
Кислород (O)
Углерод (C)
Водород (H)
Азот (N)

Слайд 11Кислород (O)
Углерод (C)
Водород (H)
Азот (N)
Основные элементы живой материи (~95%)
Слайд 12Менее часто встречающиеся элементы
Составляют до 3,9% организма человека:
Кальций (Ca), фосфор (P), калий

(K), сера (S), натрий (Na), хлор (Cl), магний (Mg), йод (I), железо (Fe)
Слайд 13Следовые элементы
Составляют менее 0,01%
Часто являются частями ферментов или ко-ферментов
Примеры: кобальт,

медь
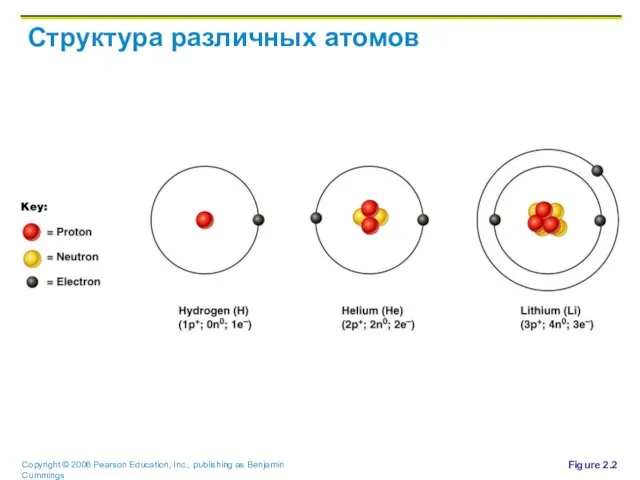
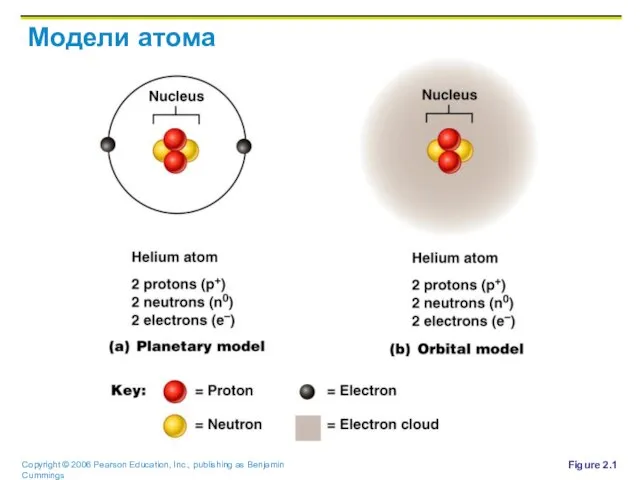
Слайд 14Структура атома
Ядро атома состоит из протонов и нейтронов
Нейтроны – не имеют заряда

и имеют вес (массу) =1 amu
Протоны – имеют положительный заряд и вес = 1 amu
Электроны – вращаются вокруг ядра
Электроны – имеют отрицательный заряд и вес = 1/2000 массы протона (0 amu)
Слайд 15Модели атома
Планетная – электроны вращаются вокруг ядра по фиксированным орбитам i
Орбитальная (более

точная) – участки вокруг ядра, где вероятность нахождения электронов повышена
Слайд 17Идентификация элементов
Номер атома – равен числу протонов
Вес атома – равен массе протонов

и нейтронов
Атомная масса – среднее масс (веса) всех изотопов
Слайд 18Идентификация элементов
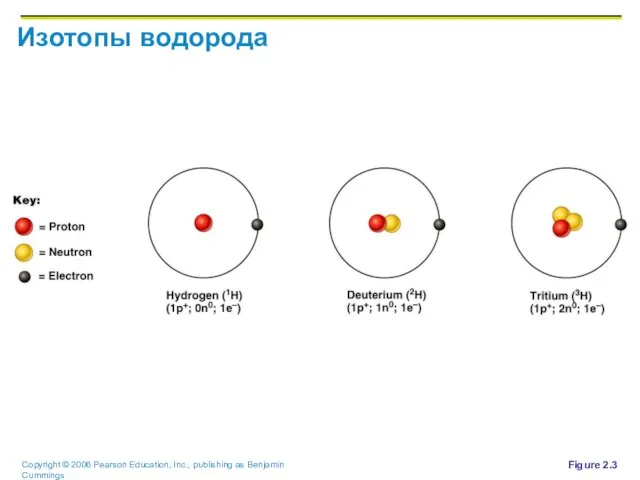
Изотоп – атомы с одинаковым количеством протонов и различным количеством нейтронов
Радиоизотопы

– атомы, подвергающиеся спонтанному разложению, называемому радиоактивностью
Примеры – P31, P32, ….
Слайд 19Структура различных атомов
Figure 2.2
Слайд 21Молекулы и вещества
Молекула – два или более атомов, соединенных химическими связями
Вещество –

складывается из молекул
Слайд 22Смеси и растворы
Смеси – два или более компонента, смешанных физически (не связанных

химическими связями)
Растворы – равномерные смеси веществ
Растворитель – присутствует в большем количестве
Растворенное вещество – присутствует в меньших количествах
Слайд 23Концентрация веществ
Молярность – количество молей на литр (M)
1 моль вещества = молекулярному

весу (сумме весов всех его атомов) в граммах
Например, молекулярный вес NaCl=58:
22.99 + 35.45 = 58.44 grams/mole
50 M раствор - ?
%, или часть на 100 частей (например, 0,9% раствор NaCl– это?)
Слайд 24Коллоидные растворы и суспензии
Коллоидные растворы и эмульсии – гетерогенные смеси, где растворенные

вещества не выпадают из раствора
Суспензии – гетерогенные смеси, где растворенные вещества заметно выпадают из раствора
Слайд 25Сравнение смесей и веществ
В смесях нет химических связей
Большинство смесей могут быть разделены

физическими методами
Вещества – не могут быть разделены физически
Вещества – только гомогенные
Слайд 26Химические связи
Ядро атома окружено электронной оболочкой
Связи формируются с использованием электронов наиболее внешнего

уровня
Валентная оболочка – внешний уровень, содержащий химически активные электроны
Валентность – количество химических связей, образуемых атомами данного вещества
Примеры - ….
Слайд 27Tипы химических связей
Ионная
Ковалентная
Водородная

Слайд 28Ионные связи
Ионы – это заряженные атомы, полученные путем потери или приобретения электронов
2

типа
Анионы – приобретают электроны
Катионы – теряют электроны
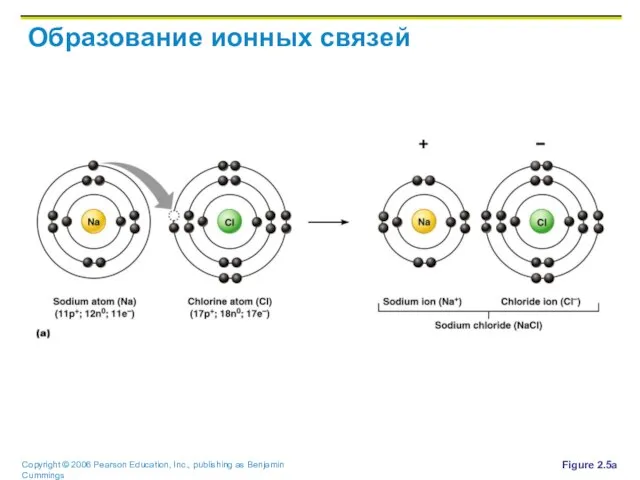
Слайд 29Образование ионных связей
Ионные связи образуются путем отдачи или приобретения одного и более

электронов между двумя атомами
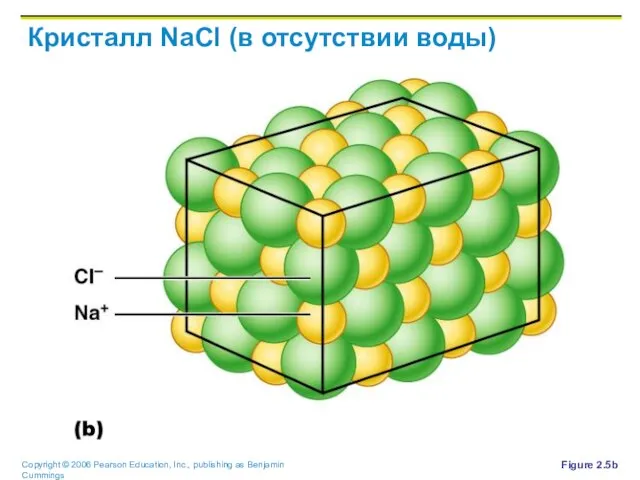
Ионные вещества образуют кристаллы вместо индивидуальных молекул
Пример: хлорид натрия (NaCl)
Слайд 30Образование ионных связей
Figure 2.5a
Слайд 31Кристалл NaCl (в отсутствии воды)
Figure 2.5b
Слайд 32Ковалентные связи
Ковалентные связи образуются совместным использованием одного и более электронов
Это образует молекулы,
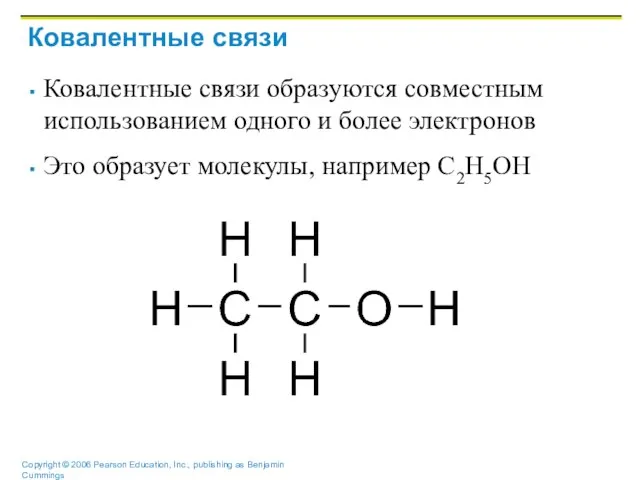
например С2Н5ОН
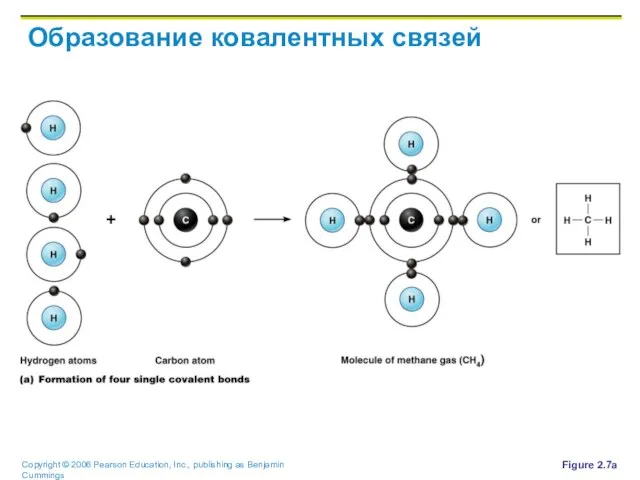
Слайд 33Образование ковалентных связей
Figure 2.7a
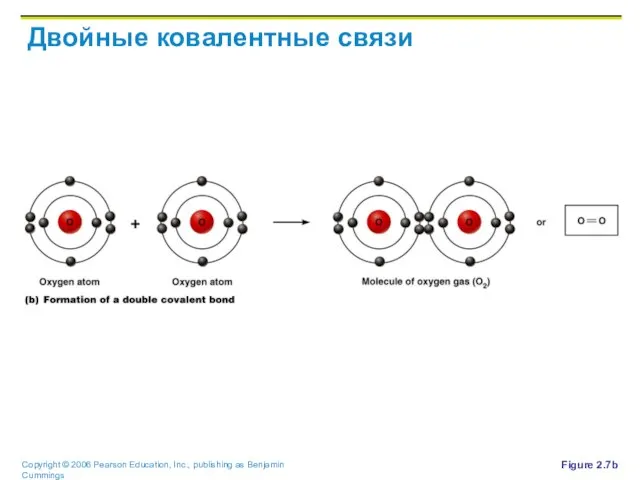
Слайд 34Двойные ковалентные связи
Figure 2.7b
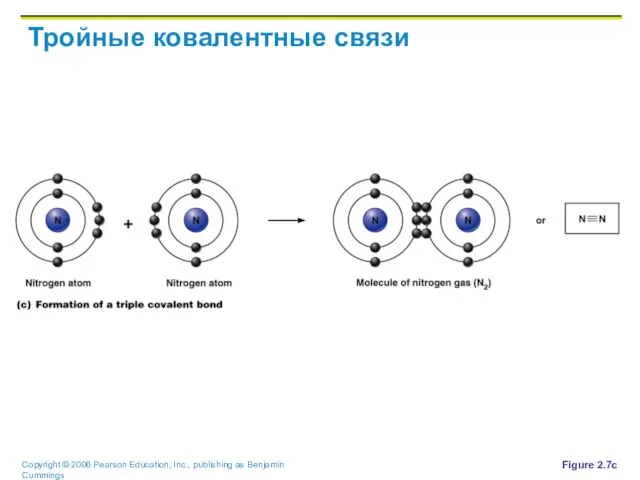
Слайд 35Тройные ковалентные связи
Figure 2.7c
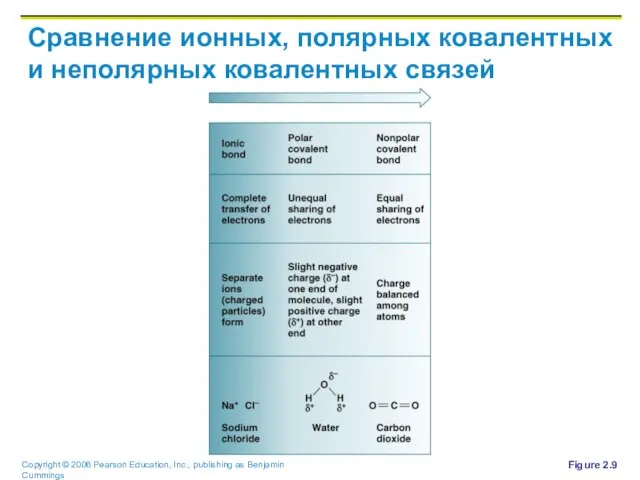
Слайд 36Полярные и неполярные молекулы
Электроны, равно поделенные между атомами, образуют неполярные молекулы
Электроны, неравно

поделенные между атомами, образуют полярные молекулы
Атомы с 6-7 электронами валентной оболочки – электронегативные
Атомы с 1-2 электронами валентной оболочки - электропозитивные
Слайд 37Сравнение ионных, полярных ковалентных и неполярных ковалентных связей
Figure 2.9
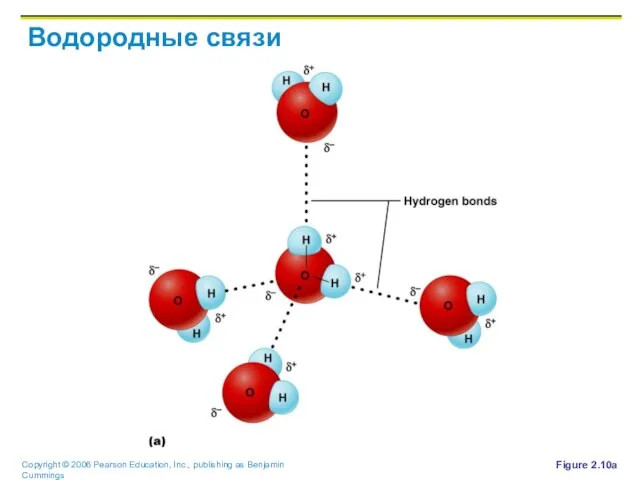
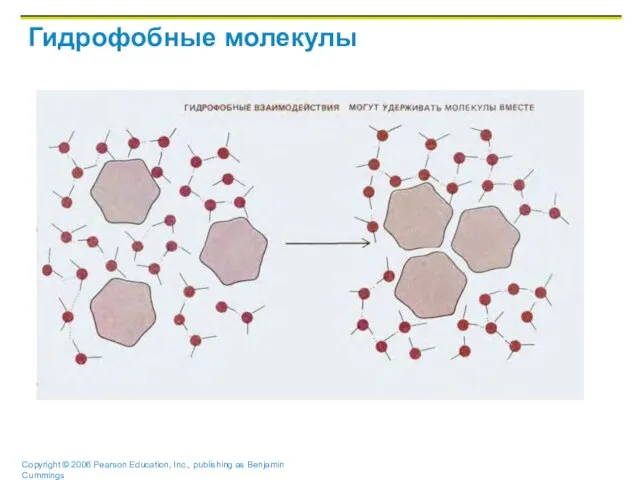
Слайд 38Водородные связи
Слишком слабые, чтобы связать 2 атома вместе
Но часто встречающиеся в воде
Отвечают

за поверхностное натяжение воды
Важны для образования 3-х мерных молекул (интра-молекулярные связи)
Слайд 42Химические реакции
Происходят, когда химические связи образуются, разрушаются или реорганизуются
Пишутся с использованием химических

символов
Уравнение химической реакции содержит:
Номер и количество реагентов и названия продуктов реакции
Относительное количество реагентов и продуктов
Слайд 44Типы химических реакций
Реакции соединения: реакции синтеза, включающие образование химических связей
A +

B → AB
Слайд 45Типы химических реакций
Реакции разложения: Молекулы разрушаются до более маленьких молекул
AB → A

+ B
Слайд 46Типы химических реакций
Реакции обмена: Связи образуются и разрушаются одновременно
AB + C →

AC + B
Слайд 47Реакции окисления-восстановления
Вещества, теряющие электроны, называются электронными донорами и они ОКИСЛЯЮТСЯ
Вещества, принимающие

электроны, называются электронными акцепторами, и они ВОССТАНАВЛИВАЮТСЯ
Важно в процессе генерации клеточной энергии – т.н. электронно-транспортная цепь
Слайд 48Перенос энергии в химических реакциях
Экзотермические реакции – реакции, которые выделяют энергию
Эндотермические реакции

– реакции, в которых продукты реакции содержат больше энергии, чем реагенты
Слайд 49Обратимость в химических реакциях
Все химические реакции теоретически обратимы
A + B → AB
AB

→ A + B
Если не одно из направлений не доминантное, то устанавливается химическое равновесие
Слайд 50Факторы, влияющие на скорость химических реакций
Температура – химические реакции идут с более

высокой скоростью при высоких температурах
Размер частиц – чем меньше частицы, тем быстрее идет реакция
Концентрация – чем больше концентрация, тем быстрее идут реакции
Слайд 51Факторы, влияющие на скорость химических реакций
Катализаторы – увеличивают скорость реакции, сами при

этом не претерпевая химические изменения
Ферменты– биологические катализаторы
Слайд 52Биохимия
Органические вещества
Содержат углерод, ковалентные связи, и часто очень большие
Углерод может образовать 4

ковалентные связи и уникально подходит для создания больших молекул
Неорганические компоненты
Не содержат углерод
Вода, соли, многие кислоты и основания
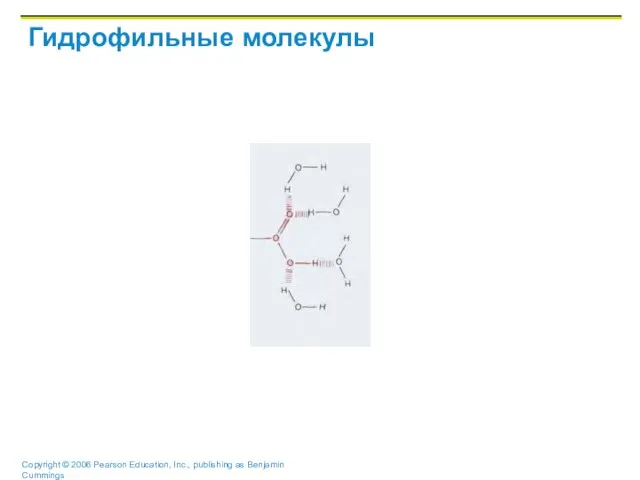
Слайд 53Свойства воды
Высокая способность сохранять и выделять тепло
Высокая температура испарения
Полярный растворитель –

растворяет ионные вещества, образует водородные связи с полярными молекулами и является основным транспортным средством в живых организмах
Живые существа на 70-90% состоят из воды, почему?
Слайд 54Свойства воды
Реактивность – участвует в реакциях гидролиза и дегидратации – важные реакции

в метаболизме
Образует защитную «подушку» в некоторых органах
Слайд 55Соли
Содержат катионы (не H+) и анионы (не OH–)
Электролиты – проводят электрический ток

Слайд 56Кислоты и основания
Кислоты выделяют Н+ и следовательно являются донорами протонов
HCl → H+

+ Cl –
Основания выделяют ОН- и следовательно являются акцепторами протонов
NaOH → Na+ + OH–
Примеры кислот и оснований
Слайд 57Концентрация кислот-оснований - pH
pH= - lg [H+], измерение кислотности раствора
Кислотные растворы имеют
![Концентрация кислот-оснований - pH pH= - lg [H+], измерение кислотности раствора Кислотные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381035/slide-56.jpg)
более высокое содержание H+ и следовательно более низкий рН
Основные растворы имеют более низкое содержание H+ и следовательно более высокий рН
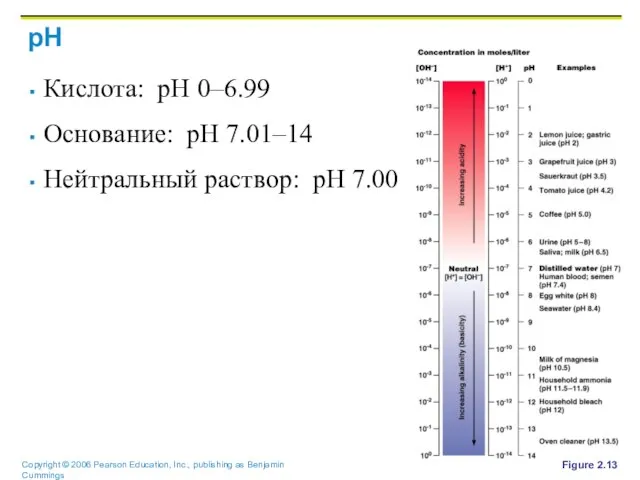
Слайд 58pH
Кислота: pH 0–6.99
Основание: pH 7.01–14
Нейтральный раствор: pH 7.00
Figure 2.13
Слайд 59Буферные растворы
Растворы, удерживающие свое значение кислотности в ответ на значительные изменения pH

в жидкостях организма


















































![Концентрация кислот-оснований - pH pH= - lg [H+], измерение кислотности раствора Кислотные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381035/slide-56.jpg)



 ВодорастворимыеРастительныеМасла (ВРМ)
ВодорастворимыеРастительныеМасла (ВРМ) Областные особенности русского костюма
Областные особенности русского костюма Проект на тему: Фэн-шуй ( | ) в классной комнате. - презентация
Проект на тему: Фэн-шуй ( | ) в классной комнате. - презентация Панели стеновые CPL
Панели стеновые CPL Подготовка к ЕГЭ. Решение задач на движение
Подготовка к ЕГЭ. Решение задач на движение Презентация замороженных фруктовых пюре и ягод Dira
Презентация замороженных фруктовых пюре и ягод Dira Зеленый наряд нашего города
Зеленый наряд нашего города Техника квиллинг
Техника квиллинг «Атлас флоры и фауны Белого моря» это коллективная монография, подготовленная большой группой специалистов. Книга дает возможнос
«Атлас флоры и фауны Белого моря» это коллективная монография, подготовленная большой группой специалистов. Книга дает возможнос Текхнология блокчейн: инвестиции в будущее
Текхнология блокчейн: инвестиции в будущее Выгода открытия бизнеса в 2020 году
Выгода открытия бизнеса в 2020 году Изменение фоновых картинок в презентациях PowerPoint и текстовом редакторе Word
Изменение фоновых картинок в презентациях PowerPoint и текстовом редакторе Word Романтизм в русской живописи XIX века
Романтизм в русской живописи XIX века Развитие методов синтеза, исследование физико-химических и электрофизических свойств модифицированных наноуглеродных и фторугл
Развитие методов синтеза, исследование физико-химических и электрофизических свойств модифицированных наноуглеродных и фторугл Профи-digest
Профи-digest lecture_5
lecture_5 Виды сказуемых
Виды сказуемых Radiographic Interpretation of Infections of Jaws
Radiographic Interpretation of Infections of Jaws phpm2fa0e_ovosibirskaya-oblast
phpm2fa0e_ovosibirskaya-oblast Итоги 2-й четверти
Итоги 2-й четверти Математика-царица наук?
Математика-царица наук? Экономический смысл налогообложения
Экономический смысл налогообложения Локализация концепции шлюза на примере ОАО Манотомь
Локализация концепции шлюза на примере ОАО Манотомь Презентация на тему Справедливость и равенство
Презентация на тему Справедливость и равенство Protection of environment
Protection of environment Статусы пассажиров. Служебные пассажиры
Статусы пассажиров. Служебные пассажиры Буквы Ч и Щ в суффиксах имён существительных
Буквы Ч и Щ в суффиксах имён существительных Отдыхаем на отлично
Отдыхаем на отлично