Содержание
- 2. * Самостоятельная работа Что называется внутренней энергией? Запишите формулу для работы газа. От каких величин зависит
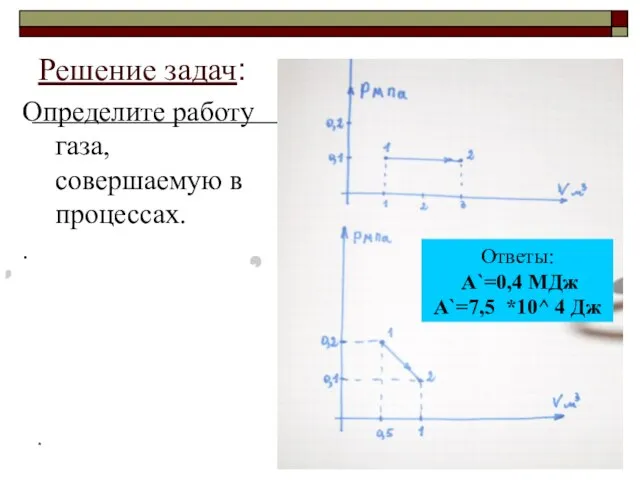
- 3. * Определите работу газа, совершаемую в процессах. . Ответы: А`=0,4 МДж А`=7,5 *10^ 4 Дж Решение
- 4. * Обсуждение вопросов: Как рассчитать количество теплоты, необходимого для нагревания тела? Что называется удельной теплоёмкостью? Как
- 5. * Первый закон термодинамики- это закон сохранения энергии, распространённый на тепловые явления. Он показывает от каких
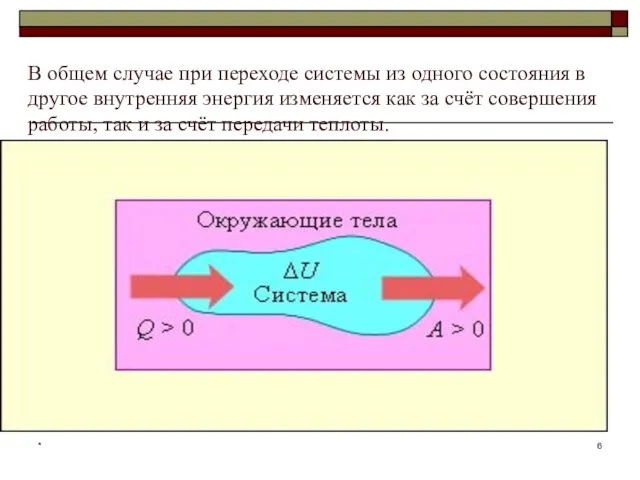
- 6. * В общем случае при переходе системы из одного состояния в другое внутренняя энергия изменяется как
- 7. * Формулировка закона для случая, если работа совершается над газом: Изменение внутренней энергии системы при переходе
- 8. * Формулировка закона для случая, если работа совершает сам газ: Количество теплоты, переданное системе, идёт на
- 9. * Углубление знаний и умений Какое количество теплоты получил идеальный газ, взятый в количестве двух молей
- 10. * Задача повышенной сложности 3.Объём кислорода массой 160г, температура которого 27 градусов Цельсия, при изобарном нагревании
- 11. * Итоги урока Параграф 80 (вопросы) Упр. 15 (3, 11)
- 12. * Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только
- 13. * Ответы к задачам №1, 2 1. А`=Р*ΔV=m/М*R*ΔT= =ν*R*ΔT ΔU= 3/2*ν*R*ΔT Q = ΔU + A`
- 14. * Решение сложной задачи А`= Р*ΔV=m/М*R*ΔT Так как V2/V1=T2/T1, T2/T1=2, T2 = 2*T1 Тогда А`= m/М*R*(2*T1-T1)
- 15. * Ответы на вопросы сам. работы. Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения
- 16. *
- 18. Скачать презентацию













 Станковая скульптура: бюст
Станковая скульптура: бюст Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г
Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г Системный подход на благо людей и природы
Системный подход на благо людей и природы Живете
Живете Этико-правовые проблемы конца жизни человека
Этико-правовые проблемы конца жизни человека ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ.
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ. УСПЕНСКИЙ СОБОР
УСПЕНСКИЙ СОБОР Опале листя: користь чи шкода
Опале листя: користь чи шкода Государственное управление в области природопользования и охраны окружающей среды
Государственное управление в области природопользования и охраны окружающей среды Магнитная гидродинамика солнечных явлений
Магнитная гидродинамика солнечных явлений Пишем проект!
Пишем проект! Этапы речевого развития
Этапы речевого развития Растения Чувашской республики
Растения Чувашской республики Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование)
Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование) Стресс и пути его преодоления
Стресс и пути его преодоления Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л
Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л Западный и Восточный типы культуры
Западный и Восточный типы культуры Упражнение Настроение
Упражнение Настроение Выполняй правила безопасности на дороге!
Выполняй правила безопасности на дороге! Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150
Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150 ОРКиСЭ
ОРКиСЭ Непревзойденные преимущества систем T2Red + T2Reflecta
Непревзойденные преимущества систем T2Red + T2Reflecta Модели данных
Модели данных  Модель организации внеурочной деятельности на основе краткосрочных курсов
Модель организации внеурочной деятельности на основе краткосрочных курсов История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России
История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России Высокоранговые и Низкопримативные правят миром
Высокоранговые и Низкопримативные правят миром Ртуть
Ртуть Презентация на тему: клавиатура.Авторы: Суханов Г.
Презентация на тему: клавиатура.Авторы: Суханов Г.