Содержание
- 2. НЕМНОГО ИСТОРИИ Монах-алхимик Бонавентура в 1270 году в поисках универсального растворителя «алкагеста» решил нагреть смесь железного
- 3. 2 FeSO4 · 7Н2О + 4 КNO3 = Fe2О3 + 2 К2SO4 + 2НNO3 +13Н2О +2NO2
- 4. АЗОТНАЯ КИСЛОТА
- 5. HNO3 – азотная кислота Физические свойства 1. Молярная масса 63,016 г/моль 2. Бесцветная жидкость с резким
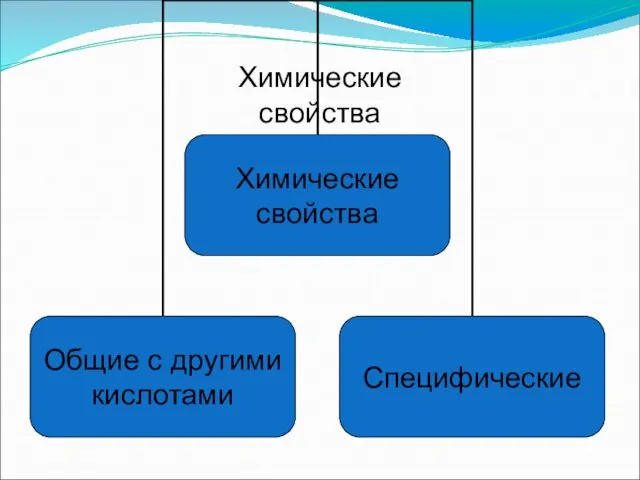
- 6. Химические свойства
- 7. 1) Изменяет цвет индикаторов (диссоциация) HNO3 ⮀ 2) Взаимодействие с основными и амфотерными оксидами CuO+2HNO3⭢ 3)
- 8. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 9. Разбавленная
- 10. Концентрированная
- 11. Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления,
- 12. Действие на органические вещества Белки при взаимодействии с конц.азотной кислотой разрушаются и приобретают жёлтую окраску .
- 13. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет
- 15. Скачать презентацию











 Практическая работа №1
Практическая работа №1 Использование кинезиологических упражнений в работе педагогов-психологов
Использование кинезиологических упражнений в работе педагогов-психологов Реклама в социальных медиа Евгений Шевченко Интернет-агентство UaMaster MediaCamp Киев, 7 ноября 2009 г.
Реклама в социальных медиа Евгений Шевченко Интернет-агентство UaMaster MediaCamp Киев, 7 ноября 2009 г. Устройства компьютера. Урок 3
Устройства компьютера. Урок 3 Презентация на тему Инсулинокоматозная терапия
Презентация на тему Инсулинокоматозная терапия  Определить сменную эксплуатационную производительность крана и продолжительность монтажа (в сменах) элементов здания
Определить сменную эксплуатационную производительность крана и продолжительность монтажа (в сменах) элементов здания Романтизм в русской живописи XIX века
Романтизм в русской живописи XIX века Добровольский Михаил Осипович
Добровольский Михаил Осипович Влияние ландшафтов на творчество художников
Влияние ландшафтов на творчество художников Общественные центры – возможность для СО НКО получить помещение в безвозмездное пользование
Общественные центры – возможность для СО НКО получить помещение в безвозмездное пользование Как научиться писать своё имя и фамилию на английском языке
Как научиться писать своё имя и фамилию на английском языке Трудовой договор -
Трудовой договор - Возникновение исламского мира
Возникновение исламского мира Presentation Title Your company information
Presentation Title Your company information  Профили защиты средств доверенной загрузки
Профили защиты средств доверенной загрузки Проект Русский национальный костюм
Проект Русский национальный костюм медузы
медузы Н.С.Лесков «Очарованный странник»
Н.С.Лесков «Очарованный странник» Единая информационная среда Северо-Западного образовательного округа
Единая информационная среда Северо-Западного образовательного округа Диетомания
Диетомания Презентация на тему Сложение и вычитание дробей с одинаковыми знаменателями
Презентация на тему Сложение и вычитание дробей с одинаковыми знаменателями Сектор Уфа 3. План товарной выручки на август 2016
Сектор Уфа 3. План товарной выручки на август 2016 Центральная библиотека Пущинского научного центра РАНВасильчиков Виктор Всеволодович
Центральная библиотека Пущинского научного центра РАНВасильчиков Виктор Всеволодович Николай Васильевич Гоголь
Николай Васильевич Гоголь Школьная компания МАОУ «Панковская СОШ»
Школьная компания МАОУ «Панковская СОШ» Понятие профессиональной деятельности
Понятие профессиональной деятельности Нагнетатели и тепловые двигатели
Нагнетатели и тепловые двигатели Картошка - «второй» хлеб
Картошка - «второй» хлеб