Содержание
- 2. Электроны в атоме Из основного свойства заряженных тел и частиц следует, что неподвижными электроны в атоме
- 3. Первая особенность. Энергия свободного электрона, так же как и энергия тела, может изменяться непрерывно, но энергия
- 4. Вторая особенность. Электрон в одних случаях проявляет свойства частицы вещества, а в других – волновые свойства.
- 5. Третья особенность. Чем с большей точностью определяют положение электрона в пространстве, тем с меньшей точностью можно
- 6. Неопределенность установления положения и скорости электрона столь велика, что необходимо вообще отказаться от анализа траектории его
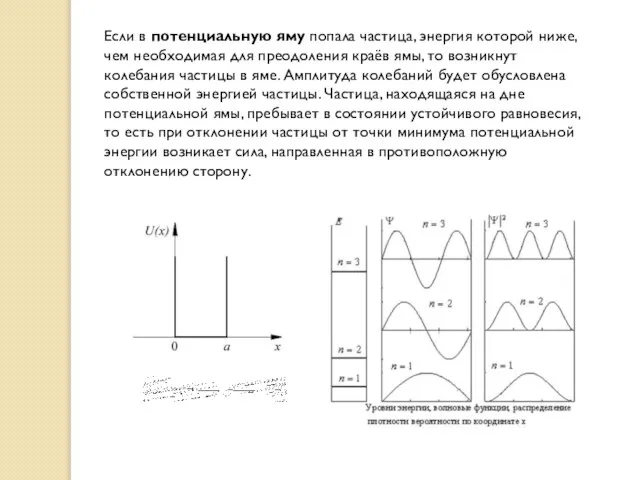
- 7. Если в потенциальную яму попала частица, энергия которой ниже, чем необходимая для преодоления краёв ямы, то
- 8. Наличие трех измерений пространства приводит к тому, что в выражении волновой функции Ψ, являющейся решением уравнения
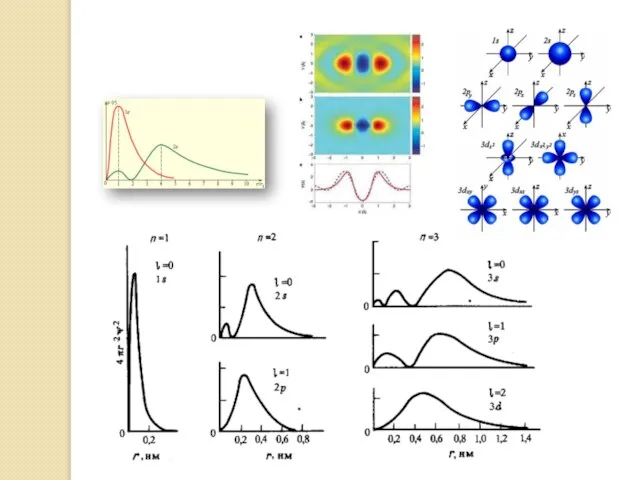
- 9. Характеристика электронов квантовыми числами состоит в следующем. а) Главное квантовое число (n) определяет средний радиус электронного
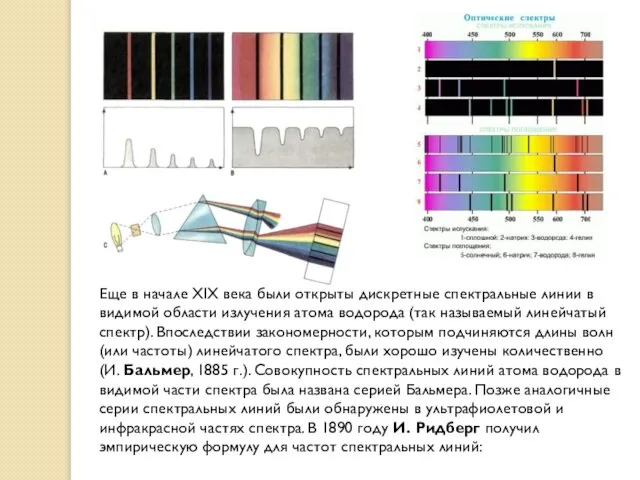
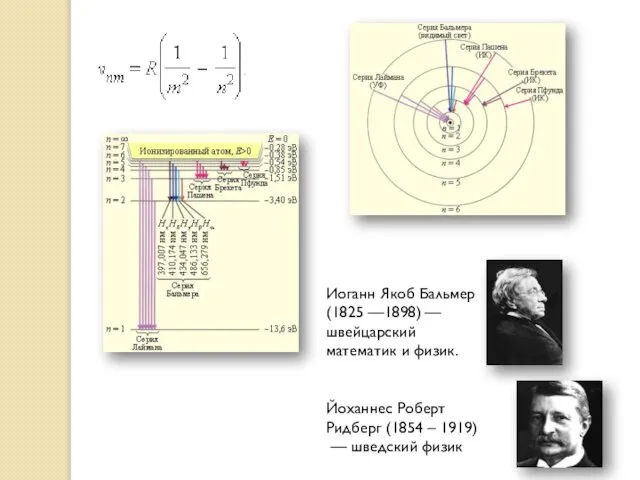
- 11. Еще в начале XIX века были открыты дискретные спектральные линии в видимой области излучения атома водорода
- 12. Иоганн Якоб Бальмер (1825 —1898) — швейцарский математик и физик. Йоханнес Роберт Ридберг (1854 – 1919)
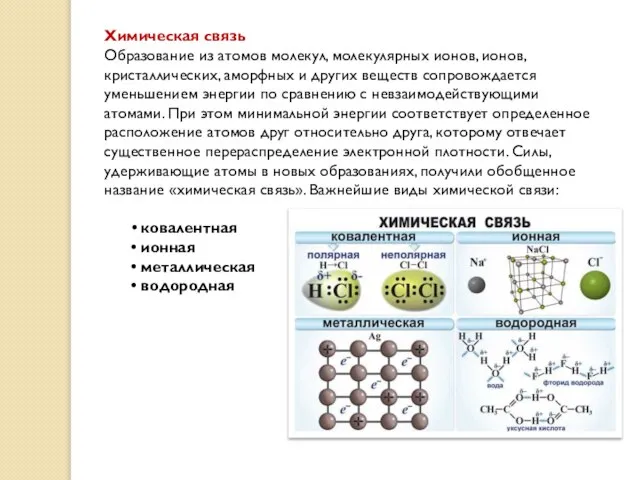
- 14. Химическая связь Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением
- 15. Формы электронных облаков и химическая связь Согласно квантовой модели фтома форма электронного облака определяется решением волноавого
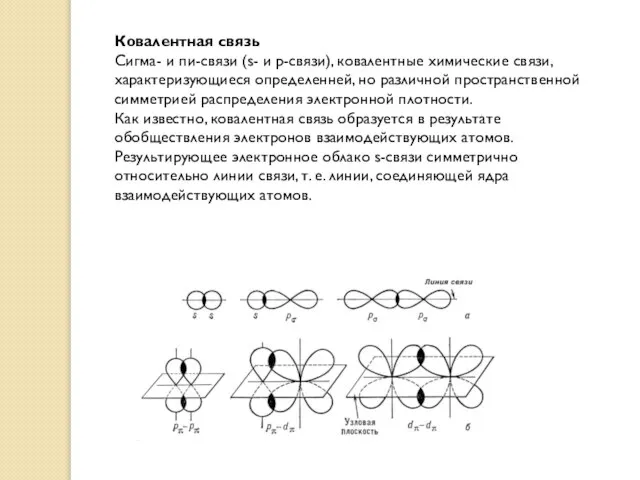
- 16. Ковалентная связь Сигма- и пи-связи (s- и p-связи), ковалентные химические связи, характеризующиеся определенней, но различной пространственной
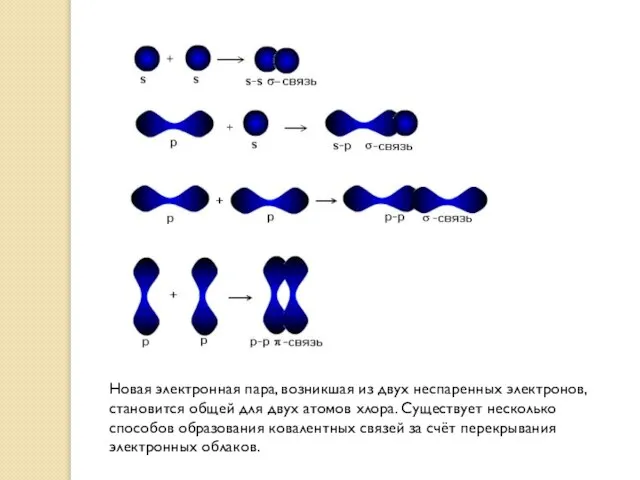
- 17. Новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора. Существует несколько
- 18. Выше были показаны орбитали, которые связывают между собой два определенных атома. Такие связывающие орбитали называются локализованными
- 19. Ионная связь Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается
- 20. Одноатомные катионы и одноатомные анионы возникают при химической реакции между нейтральнами атомами путем взаимопередачи электронов. При
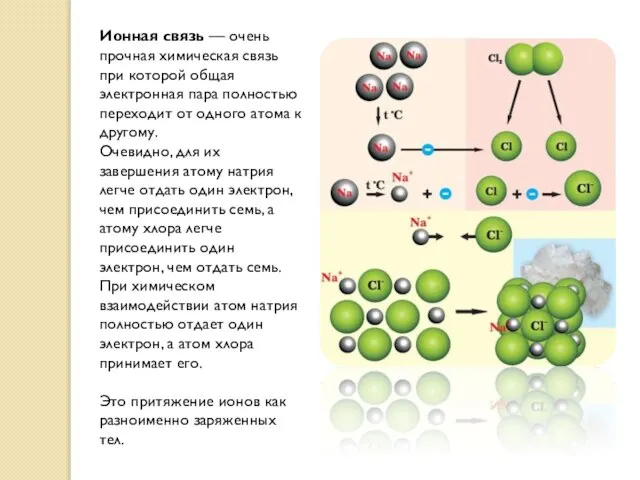
- 21. Ионная связь — очень прочная химическая связь при которой общая электронная пара полностью переходит от одного
- 22. Металлическая связь. В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без
- 23. Свободное движение электронов в металле подтверждено в 1913 году опытом Мандельштама–Папалекси по резкому торможению быстро вращающейся
- 25. Скачать презентацию














 Презентация на тему Личные местоимения (3 класс)
Презентация на тему Личные местоимения (3 класс) Репка
Репка Потребностно-мотивационная сфера личности
Потребностно-мотивационная сфера личности 65 лет Великой Победы
65 лет Великой Победы Научитесь делать красивые и понятные презентации за 1 месяц
Научитесь делать красивые и понятные презентации за 1 месяц Современное искусство Египта
Современное искусство Египта Презентация на тему Проблемы социально-эмоционального воспитания дошкольников
Презентация на тему Проблемы социально-эмоционального воспитания дошкольников Презентация на тему Подобные слагаемые (6 класс)
Презентация на тему Подобные слагаемые (6 класс) Магазин Ягуар
Магазин Ягуар 第一课 part 4
第一课 part 4 Формирование навыков морфемного членения слова как основы орфографической грамотности учащихся
Формирование навыков морфемного членения слова как основы орфографической грамотности учащихся http://www.gilev.ru
http://www.gilev.ru Хорошее настроение
Хорошее настроение Логические элементы. Генераторы импульсов
Логические элементы. Генераторы импульсов Ақпаратты жинақтап қою
Ақпаратты жинақтап қою Как не разбиться в тумане
Как не разбиться в тумане Психология лжи
Психология лжи Презентация Беларусь
Презентация Беларусь Презентация на тему Адаптация
Презентация на тему Адаптация Игра Brawl Stars. Обучение. Захват кристаллов
Игра Brawl Stars. Обучение. Захват кристаллов Российский экономический кризис:пространственное измерение
Российский экономический кризис:пространственное измерение Good morning! Доброе утро! 早上好! Machine learning lecture 3
Good morning! Доброе утро! 早上好! Machine learning lecture 3 Требование потребителей
Требование потребителей Рекомендуемое оборудование для ремонта инструментов Макита
Рекомендуемое оборудование для ремонта инструментов Макита Политическая онтология. Лекция 6
Политическая онтология. Лекция 6 Презентация на тему Минэнерго
Презентация на тему Минэнерго  Repas en France
Repas en France Ieslodzījuma vietu pārvaldes ētikas kodekss 10.pants
Ieslodzījuma vietu pārvaldes ētikas kodekss 10.pants