Содержание
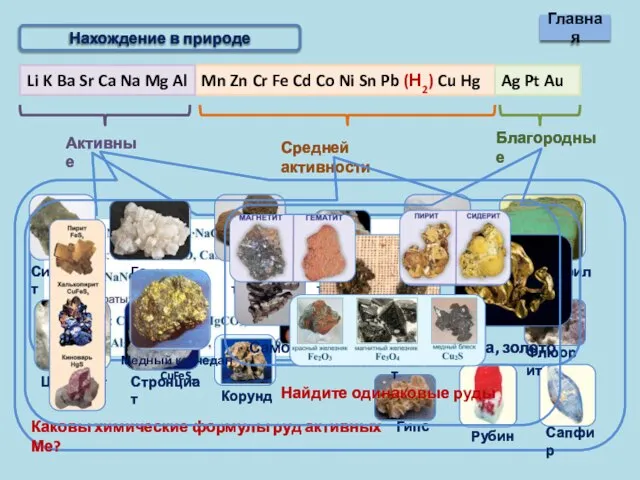
- 2. Металлы Нахождение в природе Внешний вид и условия хранения Получение металлов Химические свойства металлов Соединения металлов
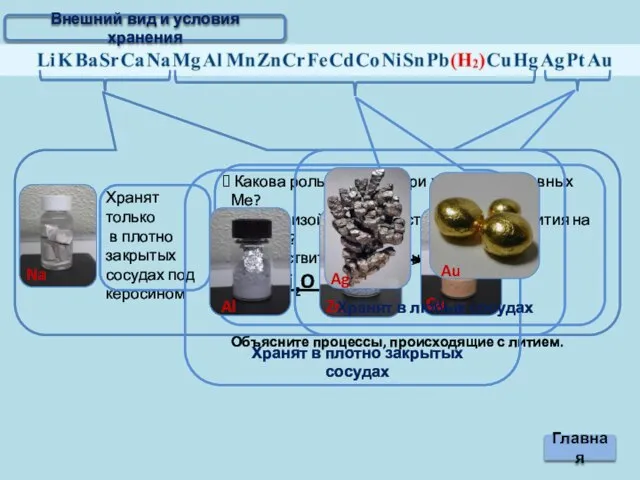
- 3. Внешний вид и условия хранения
- 4. Внешний вид и условия хранения Главная
- 5. Mn Zn Cr Fe Cd Co Ni Sn Pb (Н2) Cu Hg Li K Ba Sr
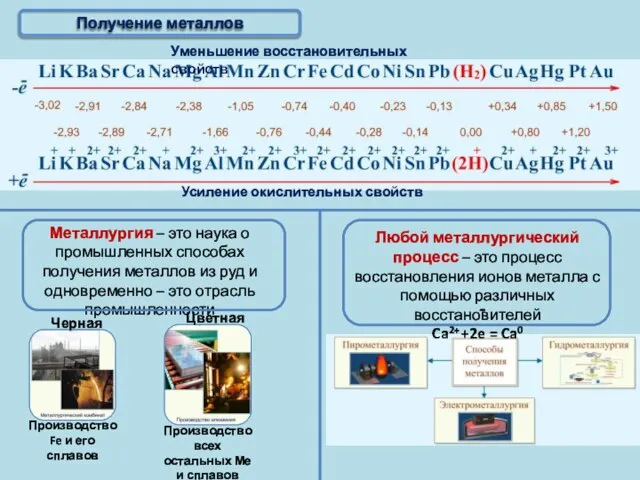
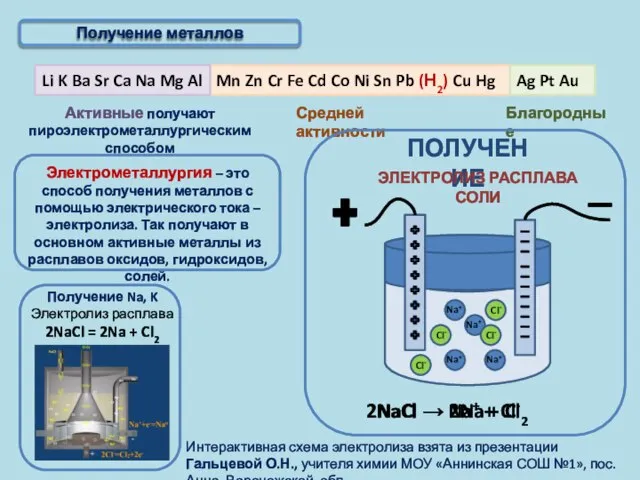
- 6. Получение металлов
- 7. Активные получают пироэлектрометаллургическим способом Благородные Получение металлов Электрометаллургия – это способ получения металлов с помощью электрического
- 8. Активные получают пироэлектрометаллургическим способом Благородные Получение металлов T 950°C, Al2O3 в расплаве криолита (Na3AlF6); на катоде:
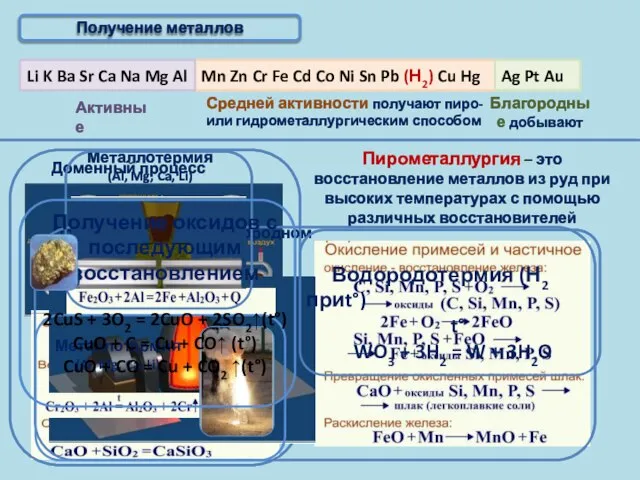
- 9. Получение металлов Пирометаллургия – это восстановление металлов из руд при высоких температурах с помощью различных восстановителей
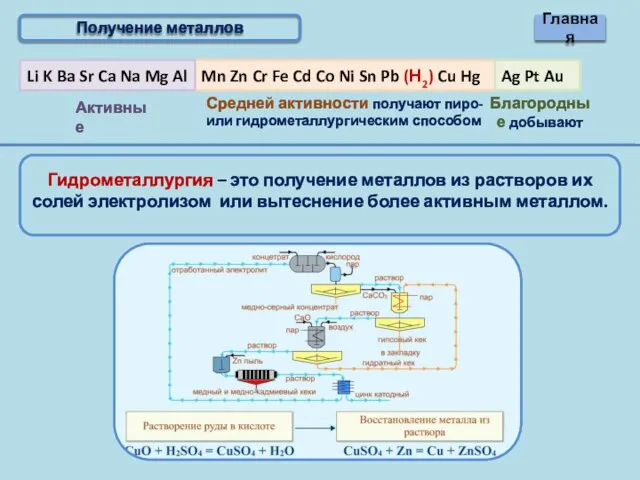
- 10. Получение металлов Главная
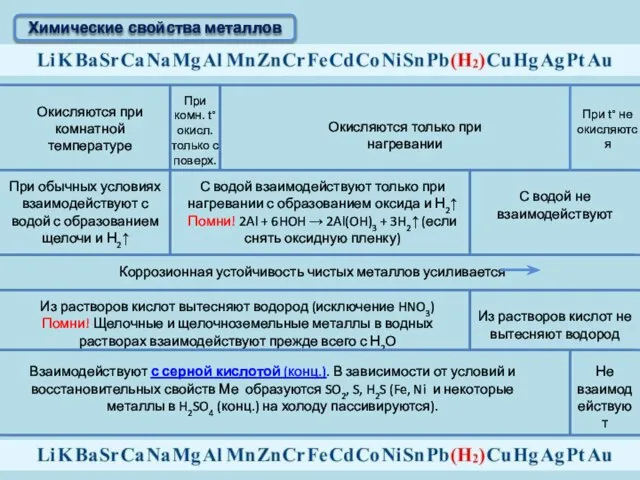
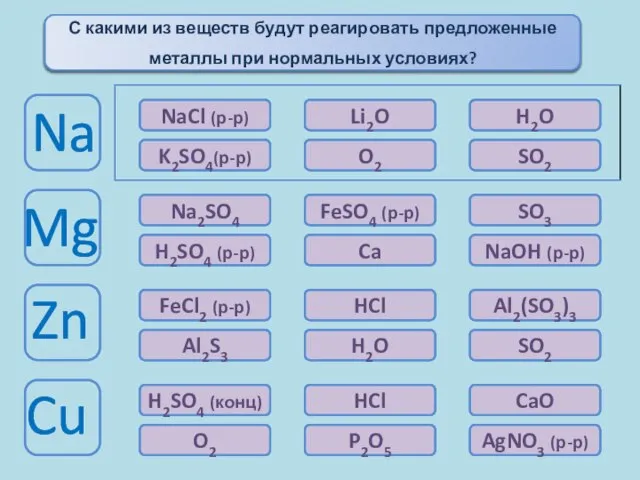
- 11. Химические свойства металлов Окисляются при комнатной температуре При комн. t°окисл. только с поверх. Окисляются только при
- 12. Химические свойства металлов Взаимодействуют с разбавленной и концентрированной азотной кислотой и в зависимости от условий, восстановительных
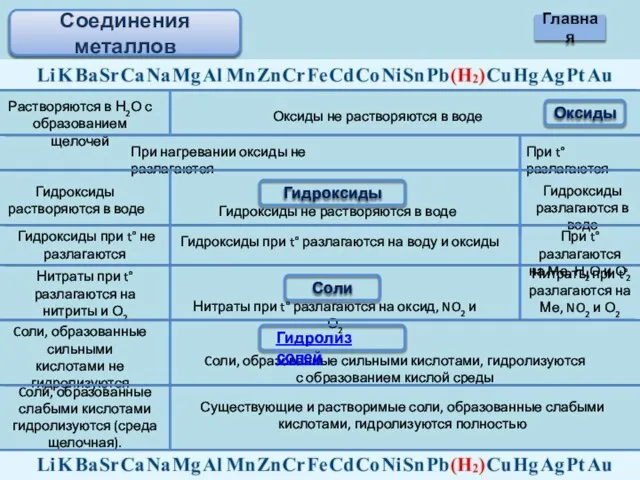
- 13. Соединения металлов Оксиды Растворяются в Н2О с образованием щелочей Оксиды не растворяются в воде При нагревании
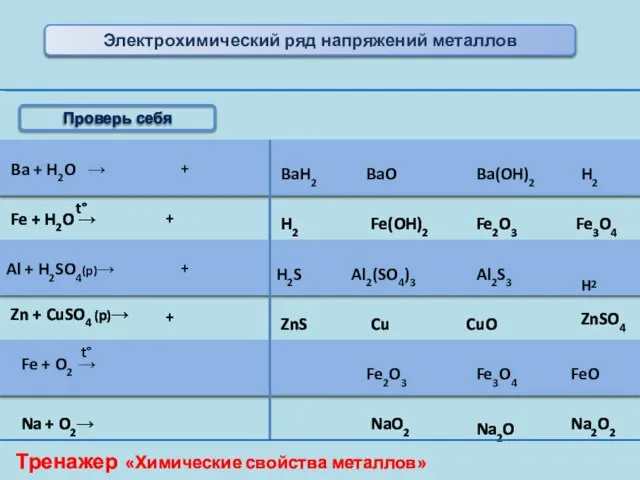
- 14. Ba + H2O → BaH2 BaO Ba(OH)2 H2 Fe + H2O → H2 Fe(OH)2 Fe2O3 Fe3O4
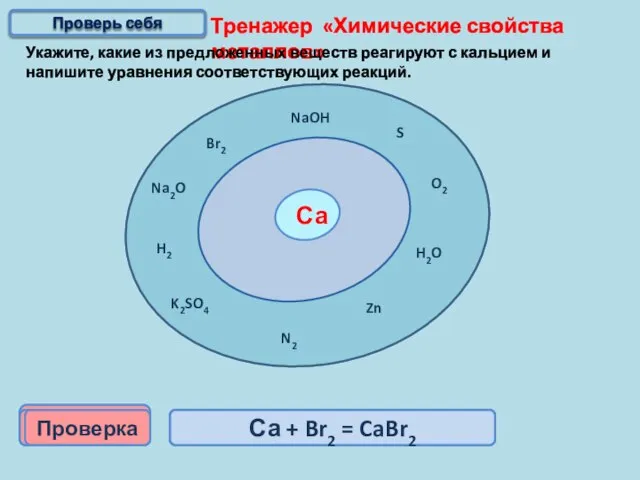
- 15. Тренажер «Химические свойства металлов» Укажите, какие из предложенных веществ реагируют с кальцием и напишите уравнения соответствующих
- 16. Коэффициент перед формулой восстановителя в реакции, схема которой Ca + HNO3 (конц.) → Ca(NO3)2 + N2↑+
- 17. ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка
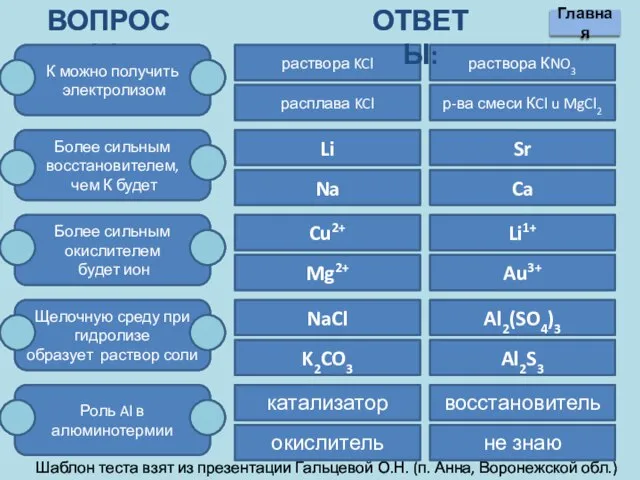
- 18. Вопросы: К можно получить электролизом Более сильным восстановителем, чем К будет Более сильным окислителем будет ион
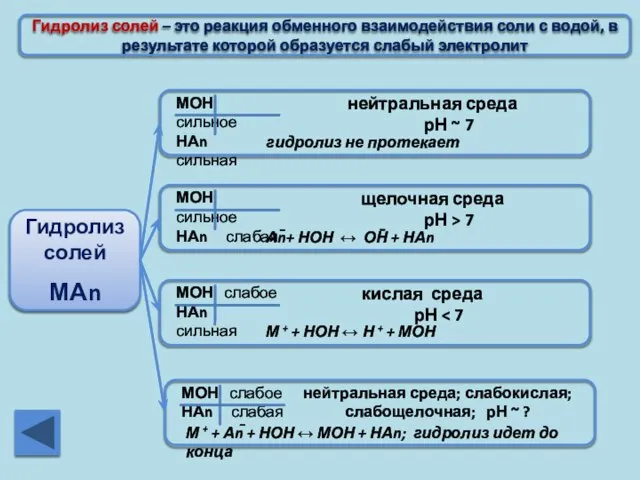
- 19. Гидролиз солей – это реакция обменного взаимодействия соли с водой, в результате которой образуется слабый электролит
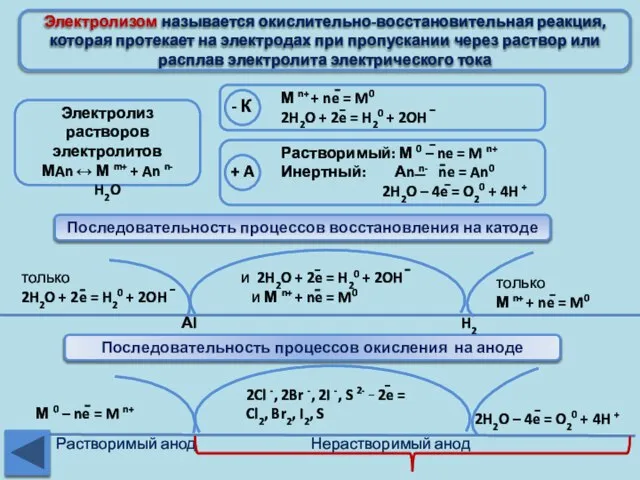
- 20. Электролизом называется окислительно-восстановительная реакция, которая протекает на электродах при пропускании через раствор или расплав электролита электрического
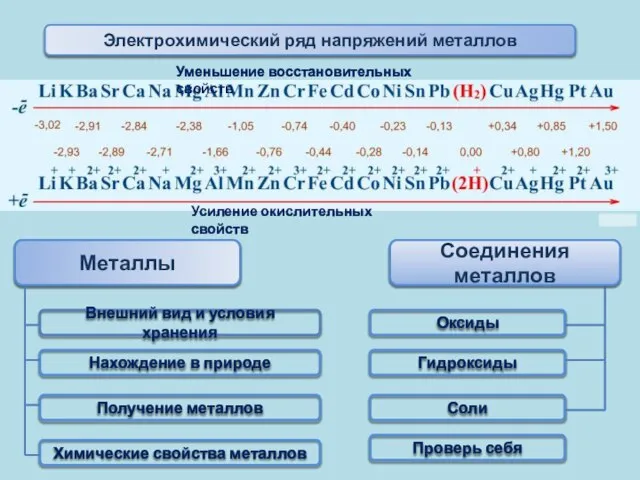
- 21. Электрохимический ряд напряжений металлов Уменьшение восстановительных свойств Усиление окислительных свойств Факторы, определяющие положение металла в электрохимическом
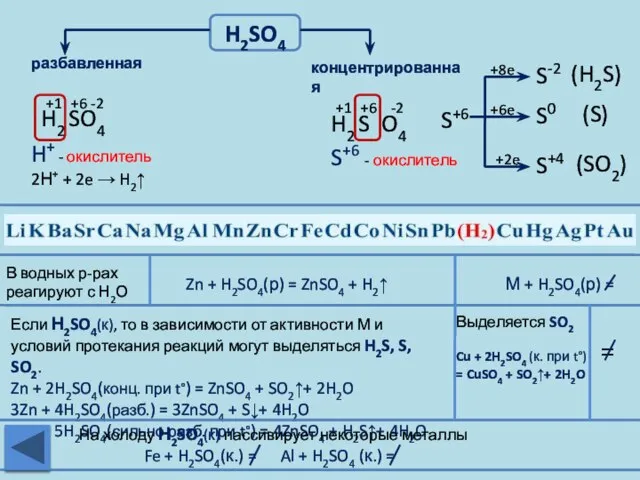
- 22. H2SO4 разбавленная концентрированная Zn + H2SO4(р) = ZnSO4 + H2↑ М + H2SO4(р) = В водных
- 24. Скачать презентацию





 Модерн
Модерн Художественные работы
Художественные работы www.marketing.rbc.ru
www.marketing.rbc.ru ИТ инфраструктура колледжа (для студентов)
ИТ инфраструктура колледжа (для студентов) Размеры и оборудование баскетбольной площадки
Размеры и оборудование баскетбольной площадки Рынок ценных бумаг
Рынок ценных бумаг Знаю, что горцам, Хоть нравы их строги,В облачном крае скалистых земельПесня нужна, словно лошадь В дороге,Песня н
Знаю, что горцам, Хоть нравы их строги,В облачном крае скалистых земельПесня нужна, словно лошадь В дороге,Песня н Каша - радость наша
Каша - радость наша Khudozhestvennaya_obrabotka_dereva
Khudozhestvennaya_obrabotka_dereva Введение стандартов ISO на системы менеджмента в практику российской компанииКейс в продолжение доклада «Международные ст
Введение стандартов ISO на системы менеджмента в практику российской компанииКейс в продолжение доклада «Международные ст Однофазные линейные электрические цепи синусоидального тока. Электродвижущие силы, напряжения и токи
Однофазные линейные электрические цепи синусоидального тока. Электродвижущие силы, напряжения и токи Рациональный потребительский бюджет
Рациональный потребительский бюджет Интегрированное производство шприцев III поколения с усовершенствованной иглой для внутримышечных инъекций
Интегрированное производство шприцев III поколения с усовершенствованной иглой для внутримышечных инъекций Социально-значимое проектирование в формировании метапредметных компетенций в условиях перехода к ФГОС ООО
Социально-значимое проектирование в формировании метапредметных компетенций в условиях перехода к ФГОС ООО Развитие творческого мышления на урокахинформатики.
Развитие творческого мышления на урокахинформатики. Presentation Title Here
Presentation Title Here 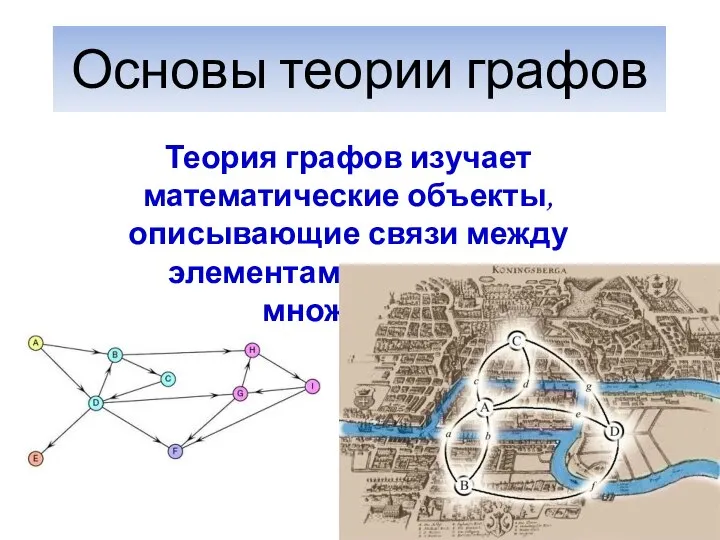 Основы теории графов
Основы теории графов source(3)
source(3) «1С:Подрядчик строительства 3.0. Управление строительным производством»
«1С:Подрядчик строительства 3.0. Управление строительным производством» Газгольдеры. Газгольдеры для нефтебаз
Газгольдеры. Газгольдеры для нефтебаз Особенности проведения государственной (итоговой) аттестации выпускников общеобразовательных учреждений в 2012 году
Особенности проведения государственной (итоговой) аттестации выпускников общеобразовательных учреждений в 2012 году Символические образы в романе И.А. Гончарова «Обломов»
Символические образы в романе И.А. Гончарова «Обломов» Деление
Деление  Венера в знаках Зодиака
Венера в знаках Зодиака Fairy Pairs. Площадки для рекламы
Fairy Pairs. Площадки для рекламы Автоматизация водоснабжения
Автоматизация водоснабжения Презентация на тему КВН по сказкам Пушкина
Презентация на тему КВН по сказкам Пушкина Разбор статьи 7 нестандартных решений в бизнесе
Разбор статьи 7 нестандартных решений в бизнесе