Содержание
- 2. Тема урока. Микропараметры вещества 1. Молекулярная физика 1.1. Основы МКТ План урока 2. Размеры молекул. 3.
- 3. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Джон Дмитрий Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
- 4. Микропараметры вещества характеризуют каждую частицу вещества в отдельности, в отличие от макропараметров, характеризующих вещество в целом.
- 5. Основные положения МКТ • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы
- 6. ПЕРВОЕ ПОЛОЖЕНИЕ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц –
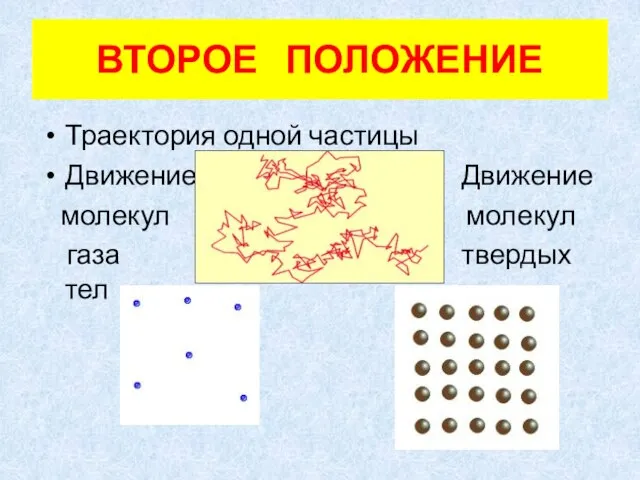
- 7. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение Движение молекул молекул газа твердых тел
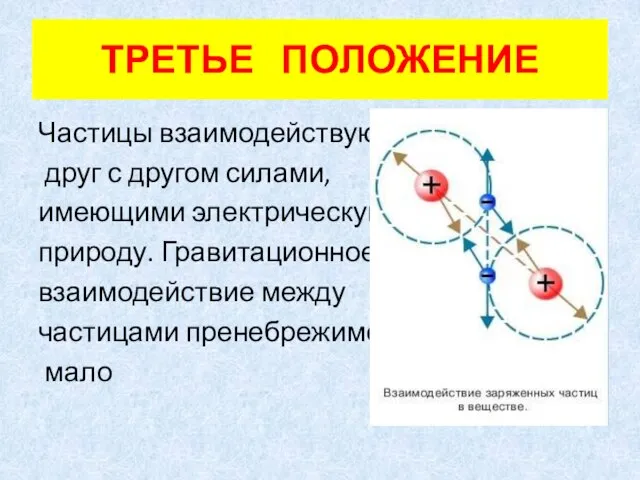
- 8. ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо
- 9. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании
- 10. II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных в жидкости
- 11. III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
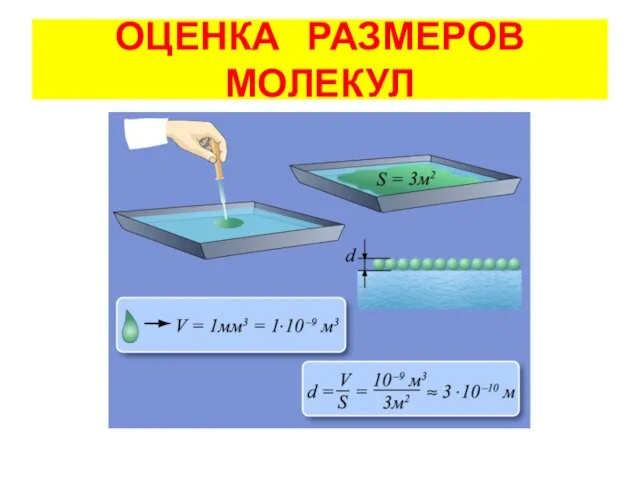
- 12. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
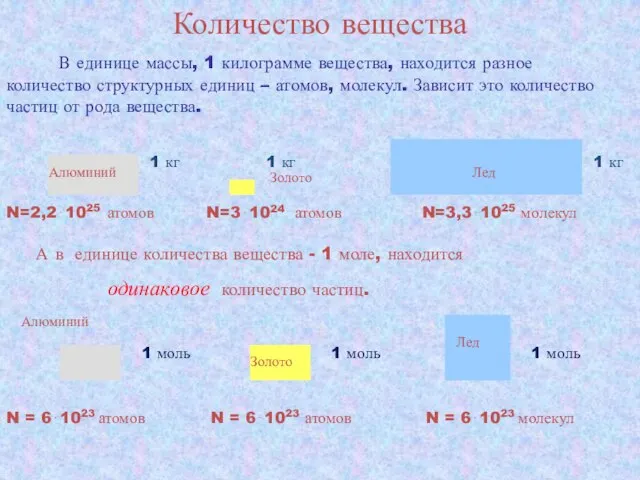
- 13. Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул.
- 14. КОЛИЧЕСТВО ВЕЩЕСТВА В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется
- 15. ФОРМУЛЫ
- 16. В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется
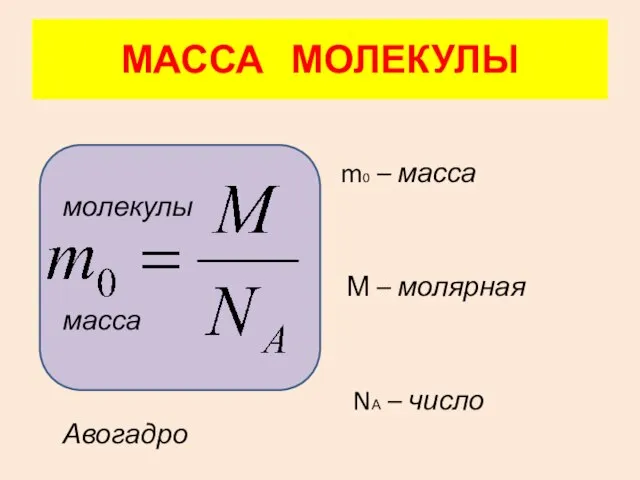
- 17. МАССА МОЛЕКУЛЫ m0 – масса молекулы М – молярная масса NА – число Авогадро
- 18. ЗАДАЧИ 1. Рассчитать массу молекулы Н2SО4. М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль
- 19. 2. Сколько молекул содержится в 50г Аℓ? М(Аℓ) = 27г/моль N = νNA ν = m/M
- 21. Скачать презентацию













 Зодчество Галицкой земли 12 века
Зодчество Галицкой земли 12 века Внешняя политика России
Внешняя политика России Прощание с Букварем
Прощание с Букварем Презентация на тему Реформация и Контрреформация в Европе
Презентация на тему Реформация и Контрреформация в Европе  Ася. Иван Тургенев
Ася. Иван Тургенев Диаграммы и графики.
Диаграммы и графики. © Министерство информатизации и связи Красноярского края 2012 г. Вебинар для сотрудников ОМСУ Красноярского края: - Готовность Реест
© Министерство информатизации и связи Красноярского края 2012 г. Вебинар для сотрудников ОМСУ Красноярского края: - Готовность Реест Языческие праздники на Руси
Языческие праздники на Руси Fandrayzing
Fandrayzing Г. А. Цукерман, К. Н. Поливанова
Г. А. Цукерман, К. Н. Поливанова Генетический анализ вместо химиотерапии
Генетический анализ вместо химиотерапии Презентация на тему Театр в XVIII веке в России
Презентация на тему Театр в XVIII веке в России  Инженерная компьютерная графика
Инженерная компьютерная графика Акробатические элементы
Акробатические элементы Презентация_МР_Чистодей
Презентация_МР_Чистодей РЕАБИЛИТАЦИЯ СЕГОДНЯ и ЗАВТРА Докладчик: Булекбаева Ш.А., Председатель Правления АО РДРЦ, дмн, внештатный медицинский реабилитолог
РЕАБИЛИТАЦИЯ СЕГОДНЯ и ЗАВТРА Докладчик: Булекбаева Ш.А., Председатель Правления АО РДРЦ, дмн, внештатный медицинский реабилитолог Обратная пропорциональность
Обратная пропорциональность Уважаеми работодатели,
Уважаеми работодатели, Генограмма семьи
Генограмма семьи Polish language
Polish language Gobozov
Gobozov Презентация "Азбука Архитектуры" - скачать презентации по МХК
Презентация "Азбука Архитектуры" - скачать презентации по МХК Основные положения закона Российской Федерации в области физической культуры, спорта, туризма, охраны здоровья
Основные положения закона Российской Федерации в области физической культуры, спорта, туризма, охраны здоровья Роза
Роза Деловая графика MS Exel
Деловая графика MS Exel Білезік фото
Білезік фото 4
4 Методическая разработка мастер-класса
Методическая разработка мастер-класса