Содержание
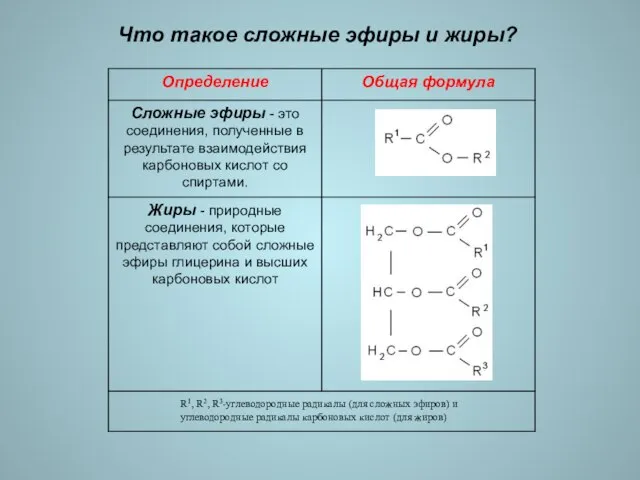
- 2. Что такое сложные эфиры и жиры? R1, R2, R3-углеводородные радикалы (для сложных эфиров) и углеводородные радикалы
- 3. Номенклатура Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания
- 4. Изомерия Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с
- 5. 2. Изомерия положения сложноэфирной группировки —СО—О— Этот вид изомерии начинается со сложных эфиров, в молекулах которых
- 6. 3. Межклассовая изомерия -например, метилацетату изомерна пропановая кислота. СН3―СО―О―СН3 метилацетат С2Н5―СО―ОН пропионовая кислота Изомерия
- 7. 4. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия
- 8. Физические свойства сложных эфиров Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в
- 9. Физические свойства жиров Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в
- 10. Химические свойства сложных эфиров Процесс расщепления сложного эфира при действии воды с образованием карбоновой кислоты и
- 11. Химические свойства сложных эфиров Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт,
- 12. Одно из важнейших свойств жиров ― их способность расщепляться на составляющие: глицерин и карбоновые кислоты. Если
- 13. Химические свойства жиров Если на выделяющуюся карбоновую кислоту действовать щелочью ― она превратится в соль: C17H35COOH
- 14. Химические свойства жиров Твердые животные жиры более ценны и дорогостоящи, чем растительные масла. Способ превращения непредельных
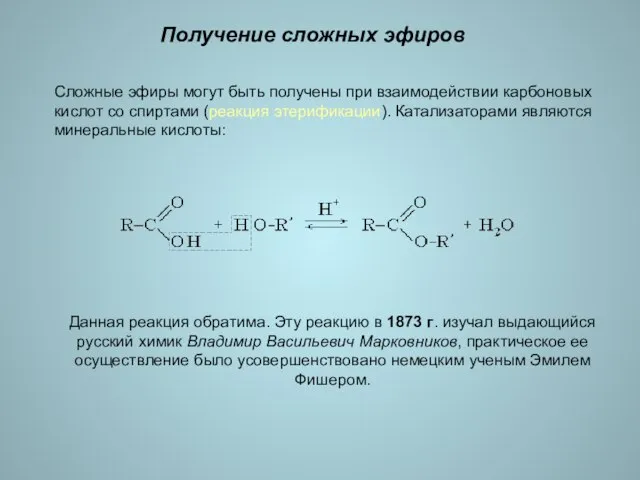
- 15. Получение сложных эфиров
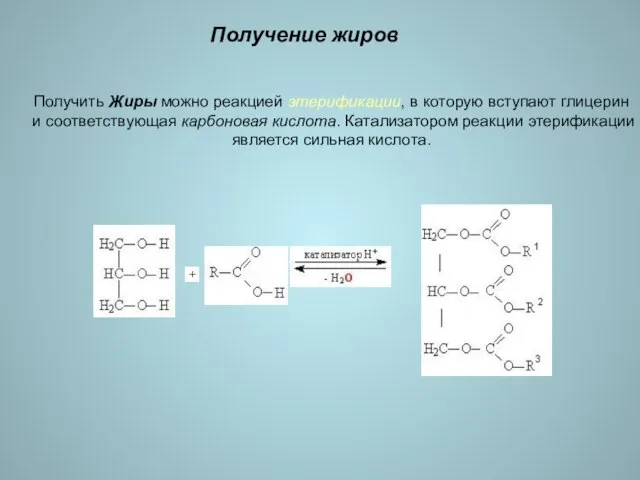
- 16. Получение жиров Получить Жиры можно реакцией этерификации, в которую вступают глицерин и соответствующая карбоновая кислота. Катализатором
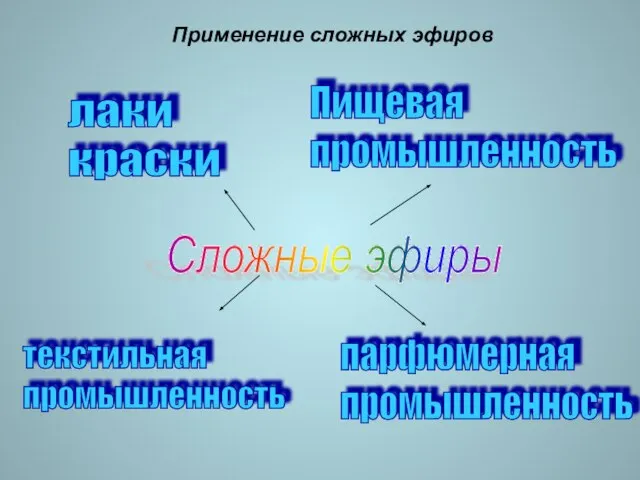
- 17. Применение сложных эфиров лаки краски Пищевая промышленность парфюмерная промышленность Сложные эфиры текстильная промышленность
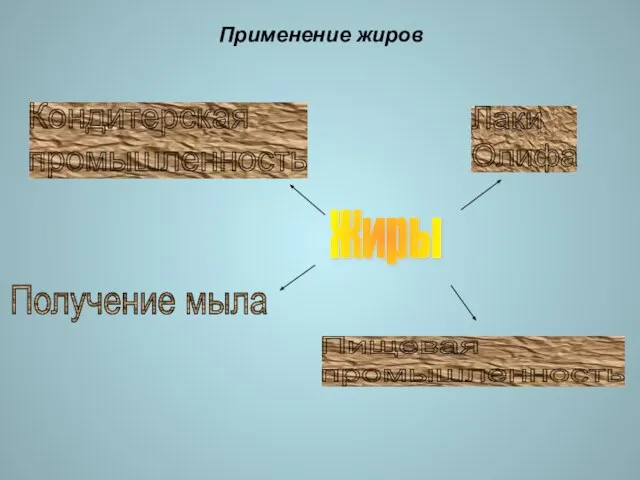
- 18. Применение жиров Жиры Лаки Олифа Кондитерская промышленность Получение мыла Пищевая промышленность
- 19. Интересное о жирах Жиры являются одной из трех главных составляющих пищи человека и животных , наряду
- 21. Скачать презентацию












 Изображения изделий и их обозначения при выполнении графических конструкторских документов
Изображения изделий и их обозначения при выполнении графических конструкторских документов Использование функций
Использование функций Математические задачи от русских, советских и зарубежных писателей
Математические задачи от русских, советских и зарубежных писателей Каникулы в международном детском лагере
Каникулы в международном детском лагере Язык есть исповедь народа
Язык есть исповедь народа Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных
Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных Физико-географическое районирование Северной Евразии
Физико-географическое районирование Северной Евразии  Узоры “тетёрки ” на печенье
Узоры “тетёрки ” на печенье Презентация на тему Постоянные магниты
Презентация на тему Постоянные магниты Весенний фестиваль для учащихся
Весенний фестиваль для учащихся 23 февраля. Поздравляем!
23 февраля. Поздравляем! Российский государственный университет нефти и газа имени И.М.Губкина Кафедра машин и оборудования нефтяной и газовой промышленн
Российский государственный университет нефти и газа имени И.М.Губкина Кафедра машин и оборудования нефтяной и газовой промышленн Звук и свет в лирике И. Анненского
Звук и свет в лирике И. Анненского Книжка-раскраска
Книжка-раскраска Взаимодействие научного руководителя со студентами через личный кабинет с использование сервиса Антиплагиат
Взаимодействие научного руководителя со студентами через личный кабинет с использование сервиса Антиплагиат Зачем живые организмы запасают питательные вещества?
Зачем живые организмы запасают питательные вещества? Особенности приема 2020 (колледж). Дистанционная подача документов
Особенности приема 2020 (колледж). Дистанционная подача документов Ресурсный Центр «Кристина»
Ресурсный Центр «Кристина» Проверка правильности кирпичной кладки
Проверка правильности кирпичной кладки Смешанное обучение – blended learning
Смешанное обучение – blended learning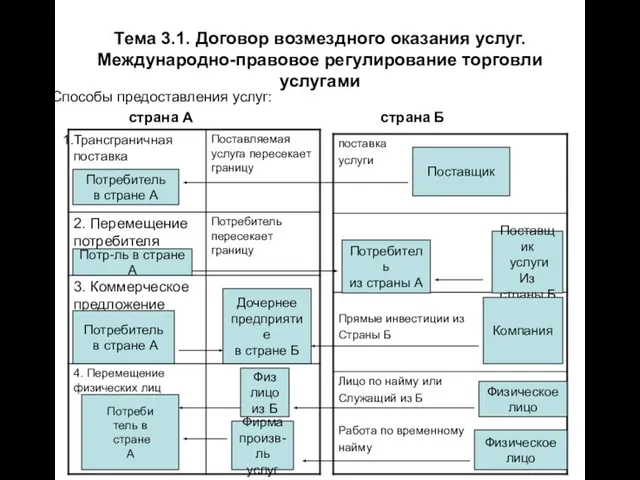 Тема 3.1. Договор возмездного оказания услуг. Международно-правовое регулирование торговли услугами Способы предоставления услуг
Тема 3.1. Договор возмездного оказания услуг. Международно-правовое регулирование торговли услугами Способы предоставления услуг Конвенция о правах ребенка
Конвенция о правах ребенка Богомолова Роза Александровна
Богомолова Роза Александровна Renault Assistance. Служба маркетинга запасных частей и послепродажного обслуживания
Renault Assistance. Служба маркетинга запасных частей и послепродажного обслуживания Принцип действия жидкокристаллических дисплеев
Принцип действия жидкокристаллических дисплеев Правила работы с обучающей презентацией
Правила работы с обучающей презентацией плакат
плакат ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития
ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития