Слайд 2 «Просто знать – еще не все,
знания нужно уметь использовать»

И.В.Гете
Слайд 3Ион аммония образован только неметаллами.
Так же, как и ионы металлов, он образует

свои соли.
Все соли аммония растворимы в воде.
Качественная реакция на ион аммония- действие щелочи при нагревании.
В состав пекарского порошка входит гидрокарбонат аммония, поэтому его используют в хлебопечении.
Нашатырь используют при паянии.
Агроному-почвоведу, а также любому дачнику необходимы знания по химии.
Без азота нет белка, без белка нет жизни.
Слайд 4 Цели урока
сформировать знания о характерных свойствах солей аммония,
ознакомить с представителями

этих солей и их применением,
развивать умения выделять главное, классифицировать, представлять результаты работы.
Слайд 5Соли аммо́ния — соли, содержащие одновалентный
ион аммония NH4+; по строению, цвету

и другим
свойствам они похожи на соответствующие соли калия.
Все соли аммония растворимы в воде, полностью диссоциируют в водном растворе.
Слайд 6 Химические свойства
1. Сильные электролиты (диссоциируют в водных растворах):

NH4Cl ↔ NH4 ++ Cl-
2. С кислотами (реакция обмена):
(NH4) 2CO3 + 2НCl → 2NH 4Cl + Н2O + CO2 ↑
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2 ↑
CO32- + 2H+ → Н2O + CO2 ↑
Слайд 7 Химические свойства
3. C солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2

→ BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 ↓ + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4 ↓
4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония):
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
Слайд 8Применение солей аммония
в пиротехнике;
в хлебопечении и кондитерской промышленности;
в сельском хозяйстве- удобрения;
при

паянии металлов (нашатырь- хлорид аммония);
электролит в сухих элементах (хлорид аммония).
Слайд 9применение солей аммония
Нитрат аммония NH4NО3 в смеси с порошками алюминия и угля

используют в качестве взрывчатого вещества - аммонала , который широко применяют при разработке горных пород.
Слайд 10применение солей аммония
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 применяют в кондитерском

деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например:
NH4HCO3 = NH3↑ + Н2O↑ + CO2↑
Слайд 11применение солей аммония
Соли аммония
используются
в качестве удобрений

Слайд 12применение солей аммония
Хлорид аммония NH4Cl используют при паянии, так как он очищает

поверхность металла от оксидной плёнки и к ней хорошо пристаёт припой.
Слайд 13применение солей аммония
в гальванических элементах (сухих батареях)
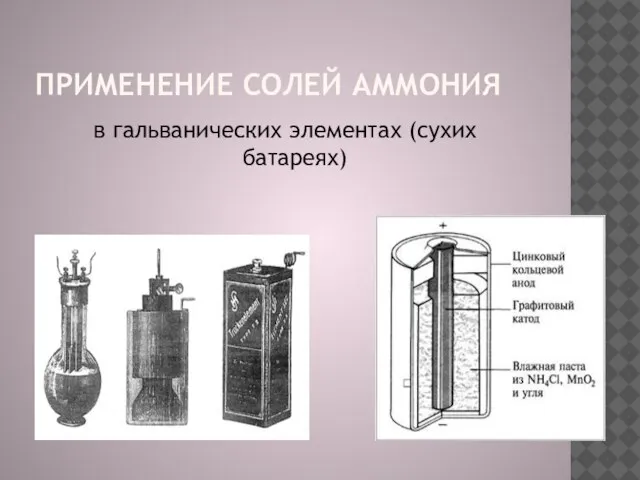
Слайд 14применение солей аммония
Хлорид аммония применяется при изготовлении дымовых шашек

Слайд 15
получение солей аммония
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 =

NH4NO3
2NH4OH + H2SO4 =(NH4) 2SO4+ 2Н2O
Слайд 16Задания на развитие творческого мышления.
Предложите способ очистки поваренной соли от содержащейся в

ней примеси хлорида аммония.
Объясните, можно ли смешивать аммиачную селитру (нитрат аммония) с известью?
Слайд 17Заключение
Роль азотистых соединений в жизни человека и общества очень велика, а применении

разнообразно. Азот – основа жизни на Земле. На Земле постоянно происходят процессы превращения веществ живой и неживой природы. В результате этих превращений неорганические вещества неживой природы – соли аммония могут превращаться в сложные органические вещества – белки. А белки – это основа всего живого В белках содержится 18 % азота. Без азота нет белка, без белка нет жизни!
















 Госзакупки. С чего начать
Госзакупки. С чего начать Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов.
Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов. Всього одна чарка
Всього одна чарка ИЗУЧАЕМ EXCEL
ИЗУЧАЕМ EXCEL Институт кураторов — копия
Институт кураторов — копия Богатыри - герои былин
Богатыри - герои былин Острые респираторные заболевания и их профилактика
Острые респираторные заболевания и их профилактика Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га
Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га Геометрия в моде
Геометрия в моде Презентация на тему Аллея героев Первой мировой войны
Презентация на тему Аллея героев Первой мировой войны Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз
Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз CHOOSING A PROFESSION
CHOOSING A PROFESSION внутреннее строение насекомых
внутреннее строение насекомых 984967 (3)
984967 (3) Условие не превышения границы области допустимых состояний конструкции
Условие не превышения границы области допустимых состояний конструкции Положение об общественном совете муниципального образования
Положение об общественном совете муниципального образования Традиции модернизма в искусстве 2-й пол. ХХ века
Традиции модернизма в искусстве 2-й пол. ХХ века Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус
Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус Полные квадратные уравнения
Полные квадратные уравнения Сегментация изображений
Сегментация изображений Конституция Республики Молдова
Конституция Республики Молдова Методическая работа школы
Методическая работа школы Набор в секции. Отделение сложно-координационных видов
Набор в секции. Отделение сложно-координационных видов Виктор Федорович Боков
Виктор Федорович Боков Chapter-8. Learning goals
Chapter-8. Learning goals Методи цитологічних досліджень
Методи цитологічних досліджень Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра
Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force
Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force