Содержание
- 2. 4. Что такое кислоты? 1. Какие классы веществ вы знаете? 2. Что такое оксиды? 3. Что
- 3. К какому классу соединений относятся формулы веществ? Назовите их. H2SO4 Na2O Ba(OH)2 H2CO3 N2O5 KOH
- 4. О каком веществе идёт речь? У травоядных животных потребность в этом веществе велика. В тех странах,
- 5. • научить составлять формулы солей и давать им названия; • узнать классификацию, свойства солей, способы получения
- 6. Задачи: Научить находить среди неорганических веществ формулы солей; составлять формулы солей; называть соли.
- 7. План урока: 6. Химические свойства. 1. Что такое соли? 2. Классификация солей. 3. Номенклатура солей. 4.
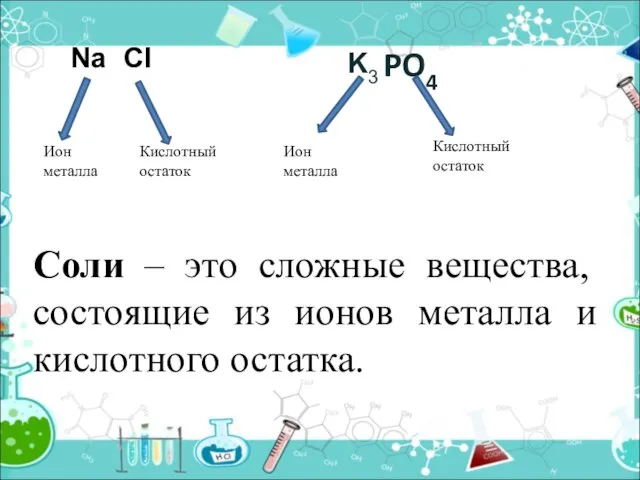
- 8. PO4 Ион металла Кислотный остаток Ион металла Кислотный остаток Na Cl K3 Соли – это сложные
- 9. Найдите среди формул веществ- формулы солей CO2 H2 SO4 CaO BaSO4 K2SO4 Fe(OH)3 HCl MgCO3 H2O
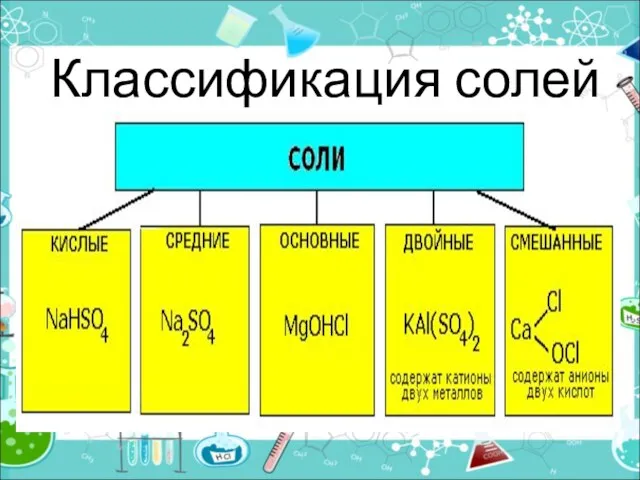
- 10. Классификация солей
- 11. Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла (KCl) Кислые
- 12. Двойные соли — в их составе присутствует два различных катиона, получаются кристаллизацией из смешанного раствора солей
- 13. Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
- 14. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 15. Номенклатура основных солей Указать название кислотного остатка К названию кислотного остатка прибавить «основной-» Наименование металла в
- 16. Номенклатура двойных солей таллия (I) -натрия Название кислотного остатка Наименование металлов в родительном падеже NaTl(NO3)2 нитрат
- 17. Номенклатура смешанных солей кальция Название кислотных остатков Наименование металла в родительном падеже CaCLOCL хлорид-гипохлорит
- 18. Составить формулы солей: нитрита магния, силиката натрия, фосфата кальция.
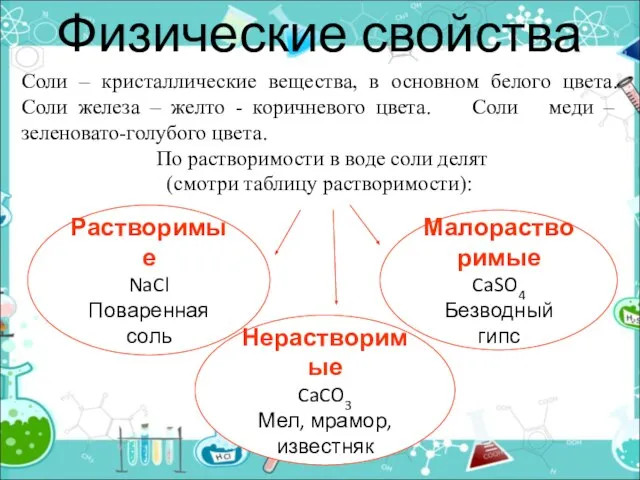
- 19. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 20. Химические свойства 1. Взаимодействие с металлами. Каждый левее стоящий металл в ряду напряжений вытесняет последующий из
- 21. Химические свойства 2. Взаимодействие со щелочами: В результате обязательно должно образоваться нерастворимое основание. 3. Взаимодействие солей
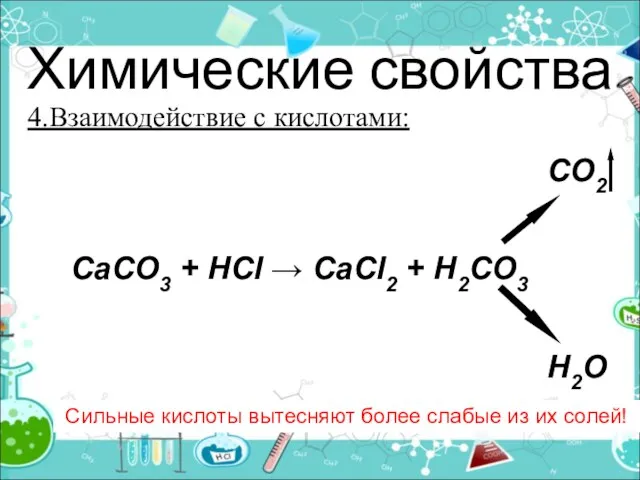
- 22. Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +
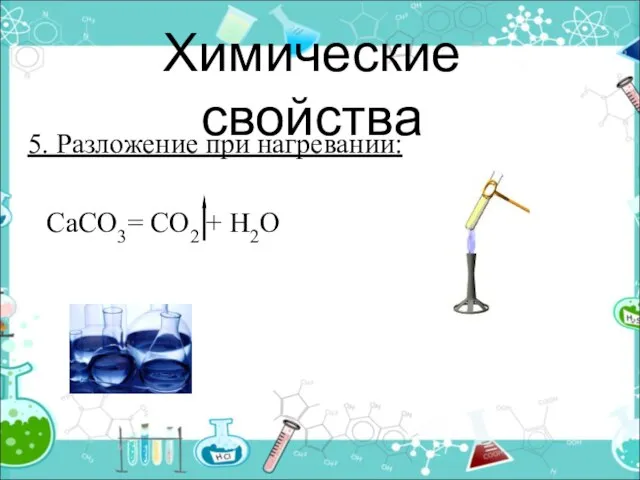
- 23. Химические свойства 5. Разложение при нагревании: СаСО3= СО2 + Н2О
- 24. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 25. Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 =
- 26. Применение солей Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и хлорид калия. Хлорид
- 27. Применение солей Соли серной кислоты. В строительстве и в медицине широко используют полуводный гипс, получаемый при
- 28. Применение солей Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим
- 29. Применение солей Соли угольной кислоты. Карбонат кальция используют в качестве сырья для получения извести. Карбонат натрия
- 30. О соли Мёртвое море
- 31. Розовое озеро в Сенегале Это озеро имеет такой цвет из-за большого количества микроорганизмов и полезных ископаемых.
- 32. Самое большое солевое озеро в мире расположено на юге пустынной равнины Альтиплано, в Боливии, на высоте
- 33. Химический диктант 1 вариант 1.соли металла 2. сульфат алюминия 3. белого 4. Cu(OH)2 5. хлора, соды
- 34. Сиквейн 1. В первой строчке тема называется одним словом (обычно существительным). 2. Вторая строчка — это
- 35. Сиквейн 1. Соль 2. Белая, кристаллическая 3. Солит, удобряет, растворяется 4. Соль наносит вред здоровью 5.
- 36. Домашнее задание §33, Упр.2, 3, 6 (письменно)
- 37. СПАСИБО ЗА УРОК!
- 39. Скачать презентацию































 Реализация проекта. План проекта мебель-трансформер
Реализация проекта. План проекта мебель-трансформер Урок презентация на тему Храм Василия Блаженного
Урок презентация на тему Храм Василия Блаженного  EISBERG MODELL
EISBERG MODELL «Преобразование транспортно-коммуникационных пространств городов. Санкт-Петербург. Площадь Балтийского вокзала»
«Преобразование транспортно-коммуникационных пространств городов. Санкт-Петербург. Площадь Балтийского вокзала» История одного города
История одного города Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне
Опыт использования учебников «Органическая химия» и «Общая химия» для обучения школьников на профильном уровне Презентация на тему Секреты долголетия
Презентация на тему Секреты долголетия Профсоюзы
Профсоюзы Налоговая реформа княгини Ольги
Налоговая реформа княгини Ольги Здоровьесберегающие образовательные технологии в педиатрии
Здоровьесберегающие образовательные технологии в педиатрии  Управление качеством образования на основе совершенствования научно-методической работы
Управление качеством образования на основе совершенствования научно-методической работы Практика стратегического анализа в российских городах
Практика стратегического анализа в российских городах МИСПИ(1)
МИСПИ(1) Анна Ахматова
Анна Ахматова Ребёнок один в машине
Ребёнок один в машине Китайские картины
Китайские картины Презентация на тему Требования к оформлению презентации
Презентация на тему Требования к оформлению презентации Требования к курсовой работе
Требования к курсовой работе Быстрая настройка рекламы в свадебной сфере!
Быстрая настройка рекламы в свадебной сфере! Калькулювання виробничой собівартості продукціи (робіт, послуг)
Калькулювання виробничой собівартості продукціи (робіт, послуг) СКОРО В ПРОДАЖЕ Артикул: 116012 Размер: 56,62 Лот 8 шт. Цвет: желтый, розовый, голубой, белый Полотно: капитон Примечания: застежка – кнопки
СКОРО В ПРОДАЖЕ Артикул: 116012 Размер: 56,62 Лот 8 шт. Цвет: желтый, розовый, голубой, белый Полотно: капитон Примечания: застежка – кнопки Street-Art et immeubles peints
Street-Art et immeubles peints Выбор ниши
Выбор ниши Презентация на тему Детство Пушкина (9 класс)
Презентация на тему Детство Пушкина (9 класс)  Полевые транзисторы. Самостоятельная работа
Полевые транзисторы. Самостоятельная работа Презентация на тему Жизнь и творчество А.Т. Твардовского
Презентация на тему Жизнь и творчество А.Т. Твардовского  Модерн в природе
Модерн в природе Закономерности эволюции
Закономерности эволюции