Содержание
- 2. Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных
- 3. По некоторым другим сведениям, аммиак мог получить современное название от древнеегипетского слова «амониан». Так называли всех
- 4. Сокращенное название «аммиак» которым мы всегда пользуемся, ввел в обиход в 1801 году русский ученый -
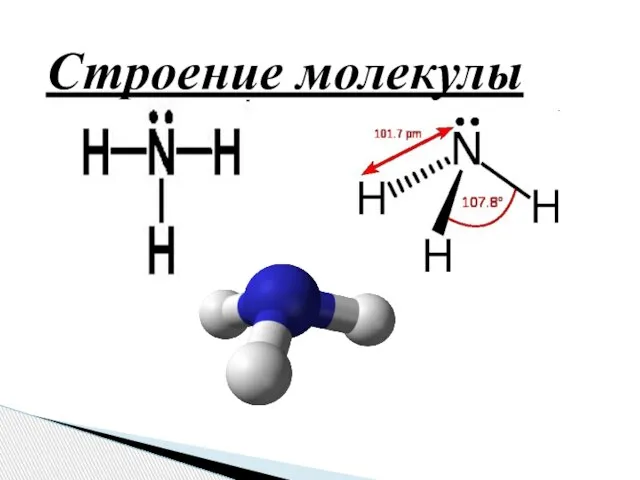
- 5. Строение молекулы
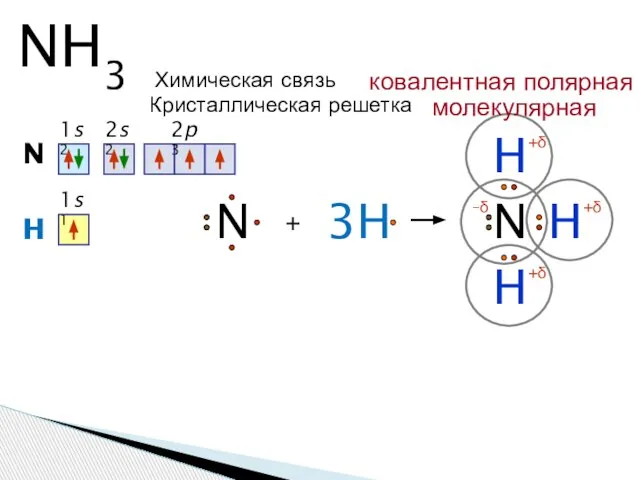
- 6. NH3 N 1s2 2s2 2p3 + H N H H 3H H N 1s1 +δ +δ
- 7. Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота
- 8. Физические свойства (при н.у. ) бесцветный газ с резким характерным запахом (запах нашатырного спирта) легче воздуха
- 9. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать токсический
- 10. Получение аммиака Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: 2NH4Cl +
- 11. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г)
- 12. Химические свойства аммиака Для аммиака характерны реакции: 1) с изменением степени окисления атома азота (реакции окисления);
- 13. Реакции с изменением степени окисления атома азота (реакции окисления) N-3 → N0→ N+2 NH3-сильный восстановитель
- 14. с кислородом Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 Каталитическое окисление амииака
- 15. с оксидами металлов 2NH3 +3CuO =3Cu + N2 +3H2O
- 16. с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl (при нагревании)
- 17. Реакции без изменения степени окисления атома азота (присоединение - образование иона аммония NH4+ по донорно-акцепторному механизму
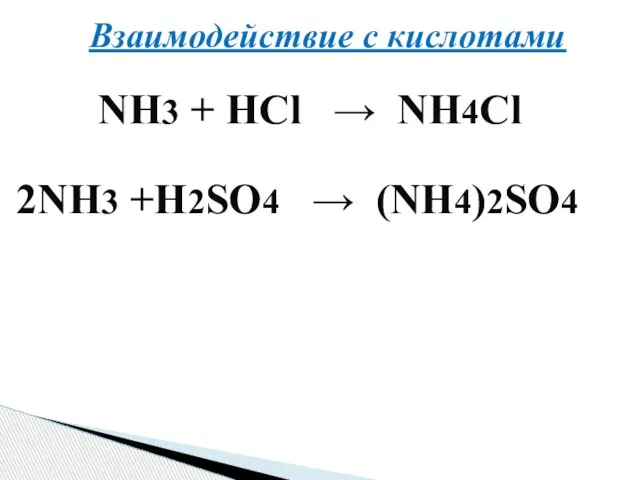
- 18. Взаимодействие с кислотами NH3 + HCl → NH4Cl 2NH3 +H2SO4 → (NH4)2SO4
- 19. Взаимодействие с водой NH3 + H2O = NH4OH При добавлении фенолфталеина‑ раствор становится малиновым, так как
- 20. Применение аммиака Производство пластмасс и волокон 2. В составе моющих средств
- 21. 3. Производство азотных удобрений 4. В сельском хозяйстве
- 22. 5. Производство азотной кислоты 6. Получение взрывчатых веществ
- 23. 7. В медицине
- 24. По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
- 26. Скачать презентацию



















 New Year Merry Christmas
New Year Merry Christmas Компания DominiSoft www.dominisoft.ru Компания “БУКА” www.buka.ru www.bukasoft.ru
Компания DominiSoft www.dominisoft.ru Компания “БУКА” www.buka.ru www.bukasoft.ru ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ, КАК ВЗАИМОДЕЙСТВИЕ УЧЕНИКА И УЧИТЕЛЯ.
ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ, КАК ВЗАИМОДЕЙСТВИЕ УЧЕНИКА И УЧИТЕЛЯ. Презентация на тему природа коми края
Презентация на тему природа коми края Синдром эмоционального выгорания
Синдром эмоционального выгорания Система образования и проблемы её структуры
Система образования и проблемы её структуры Волейбол. 5-7 классы
Волейбол. 5-7 классы Война — жесточе нету слова,Война — печальней нету слова. Война — святее нету слова В тоске и славе этих лет.И на устах у нас иного
Война — жесточе нету слова,Война — печальней нету слова. Война — святее нету слова В тоске и славе этих лет.И на устах у нас иного Евгений Львович Шварц (1896-1958)
Евгений Львович Шварц (1896-1958) Водоёмы нашей местности
Водоёмы нашей местности Фармакоэпидемиологические и фармакоэкономические аспекты нежелательных реакций лекарственных препаратов – неявная проблема и
Фармакоэпидемиологические и фармакоэкономические аспекты нежелательных реакций лекарственных препаратов – неявная проблема и  Зиянкестердің экономикалық шекті. Зиянын табиғи жауларының тиімділігінің деңгейін анықтау. (Лекция 15)
Зиянкестердің экономикалық шекті. Зиянын табиғи жауларының тиімділігінің деңгейін анықтау. (Лекция 15) Séjour d’études linguistiques Découverte de la Provence
Séjour d’études linguistiques Découverte de la Provence Символи України. Національний український одяг
Символи України. Національний український одяг Законы развития теории судебной экспертизы
Законы развития теории судебной экспертизы Командный проект. Бизнес-задача
Командный проект. Бизнес-задача Взаимодействие с заинтересованными сторонами при подготовке интегрированных отчетов
Взаимодействие с заинтересованными сторонами при подготовке интегрированных отчетов Экономить - значит зарабатывать! Плакат для рабочих
Экономить - значит зарабатывать! Плакат для рабочих Что такое деятельность
Что такое деятельность Микеланджело
Микеланджело  Лучший центр. Белорецк. Скалодром
Лучший центр. Белорецк. Скалодром Здоровьесберегающие технологии в образовательном процессе. Подготовил: зам.директора по УВР Павлов В.В.
Здоровьесберегающие технологии в образовательном процессе. Подготовил: зам.директора по УВР Павлов В.В. Лекция 5. Проблема психологического контроля и управления спортивной деятельностью
Лекция 5. Проблема психологического контроля и управления спортивной деятельностью Опорные схемы и рисунки в помощь учащимся
Опорные схемы и рисунки в помощь учащимся Топология компьютерных сетей
Топология компьютерных сетей Процессоры фирм Intel и AMD
Процессоры фирм Intel и AMD Стили в одежде
Стили в одежде «1С:Предприятие 8. Управление водоканалом»
«1С:Предприятие 8. Управление водоканалом»