найденных в природе веществ, но при этом довольно хрупок. Алмазы очень редки и ценны, их вес измеряется в каратах (1 карат=200мг). Ограненный алмаз называют бриллиантом. Крупнейшие в мире алмазы: “Куллинан” - 3106 карат, “Эксельсиор” - 971,5 карат, “Звезда Сьерра-Леоне” - 968,9 карат, «Орлов» (синевато-зелёный) Вес бриллианта 190 карат. 180 граней. Собственность России. Значительные месторождения алмазов находятся в Южной Африке, Бразилии, Якутии. Крупнейший в мире синий алмаз “Хоуп” - 44,5 карат, владельцы которого нередко погибали при загадочных обстоятельствах, хранится в музее Смитсоновского института (США).
Куллинан
Эксельсиор
Орлов
Хоуп








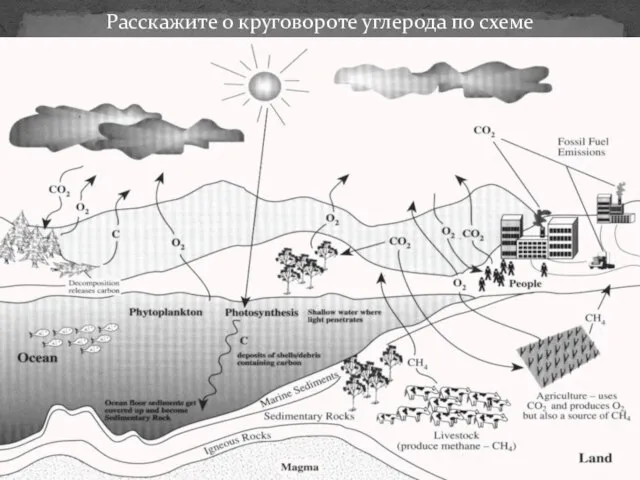
 Организация подготовки населения в области защиты от чрезвычайных ситуаций
Организация подготовки населения в области защиты от чрезвычайных ситуаций William Somerset Maugham
William Somerset Maugham Оноре де Бальзак
Оноре де Бальзак Перевод клиринга по фондовому рынку в НКЦ
Перевод клиринга по фондовому рынку в НКЦ Организация ремонта исторических зданий с помощью систем автоматизированного мониторинга
Организация ремонта исторических зданий с помощью систем автоматизированного мониторинга Мал шаруашылығы өнімдерінің ауыр металл тұздарымен ластануын анықтау және оларға қарсы ветсаншараларды ұйымдастыру
Мал шаруашылығы өнімдерінің ауыр металл тұздарымен ластануын анықтау және оларға қарсы ветсаншараларды ұйымдастыру О проведении культурно-массовых мероприятий, посвященных празднованию Нового года и Рождества
О проведении культурно-массовых мероприятий, посвященных празднованию Нового года и Рождества Множества. Элемент множества. Подмножества.
Множества. Элемент множества. Подмножества. Христианство
Христианство Презентация на тему Праздничный шар
Презентация на тему Праздничный шар Первичное отделение / Участковая избирательная комиссия № 326; Школа № 36
Первичное отделение / Участковая избирательная комиссия № 326; Школа № 36 Факторы успеха вовнедрении ИКТ
Факторы успеха вовнедрении ИКТ Заповеди Божьи
Заповеди Божьи Презентация по английскому Конструкция There is/are
Презентация по английскому Конструкция There is/are  Об организации аттестации и аттестационной экспертизы в 2010-2011гг.
Об организации аттестации и аттестационной экспертизы в 2010-2011гг. Два художника (Дружба Чехова и Левитана)
Два художника (Дружба Чехова и Левитана) Презентация на тему Искусство скифов
Презентация на тему Искусство скифов  Доля России в мировых запасах цветных металлов
Доля России в мировых запасах цветных металлов Принципы уголовного процесса. Лекция 2
Принципы уголовного процесса. Лекция 2 Творческий подход к ограничениям по Р. Акоффу: процесс решения проблем
Творческий подход к ограничениям по Р. Акоффу: процесс решения проблем Метод проектов как одно из условий формирования ключевых компетенций
Метод проектов как одно из условий формирования ключевых компетенций День Учителя
День Учителя  Сегментация изображений
Сегментация изображений Презентация 10-Э класса
Презентация 10-Э класса Имиджи и основы в торговый зал м-н Павлодар ТЦ Батыр Молл
Имиджи и основы в торговый зал м-н Павлодар ТЦ Батыр Молл Презентация на тему Первая российская революция (1905-1907гг)
Презентация на тему Первая российская революция (1905-1907гг) Профессия Врач
Профессия Врач Назначение и классификация ТЭЦ
Назначение и классификация ТЭЦ