Содержание
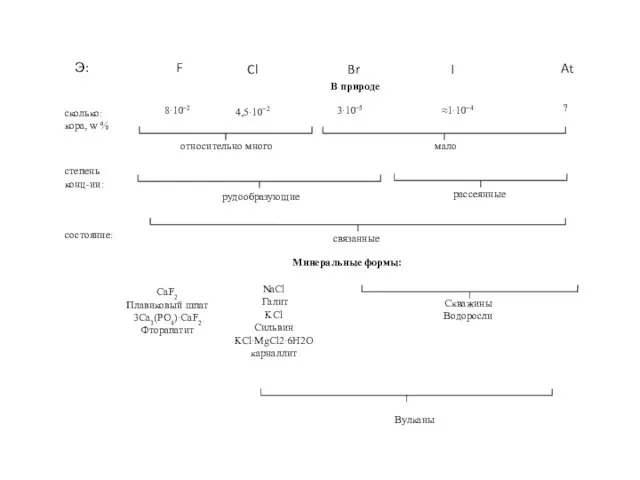
- 6. Нахождение в природе В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в
- 7. Сильвин KCl Сильвин, Германия. Музей им. А.Е.Ферсмана Сильвин и галит, Соликамск. Музей им. А.Е.Ферсмана Сильвинит KCl
- 8. Бишофит MgCl2·6H2O Бишофит. Минерал Волгоградской области
- 9. Карналлит KCl·MgCl2·6Н2O Рудник №2, Прикарпатье, Украина Галит и карналлит
- 10. Каинит KCl·MgSO4·3Н2О Каинит. Брауншвейг, Германия Калуш,Украина
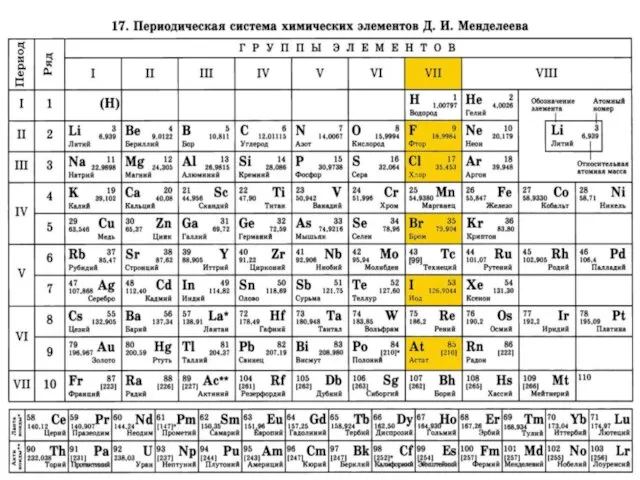
- 11. Характеристика химического элемента Хлор – элемент VII А группы. Порядковый номер 17 Относительная атомная масса: 35,4527
- 12. Электронная формула: Типичные степени окисления: -1, 0, +1, +3, +4, +5, +7 Энергия ионизации: 1254,9(13,01) кДж/моль
- 13. Характеристика простого вещества Тип связи: ковалентная неполярная Молекула двухатомная Изотопы: 35Cl (75,78 %) и 37Cl(24,22 %)
- 14. Термодинамические параметры
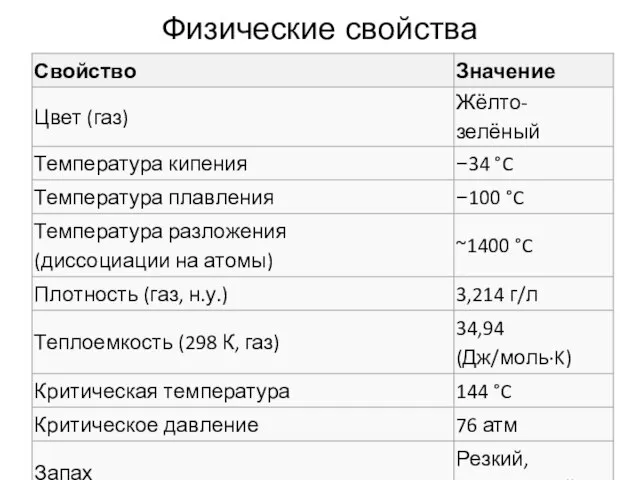
- 15. Физические свойства
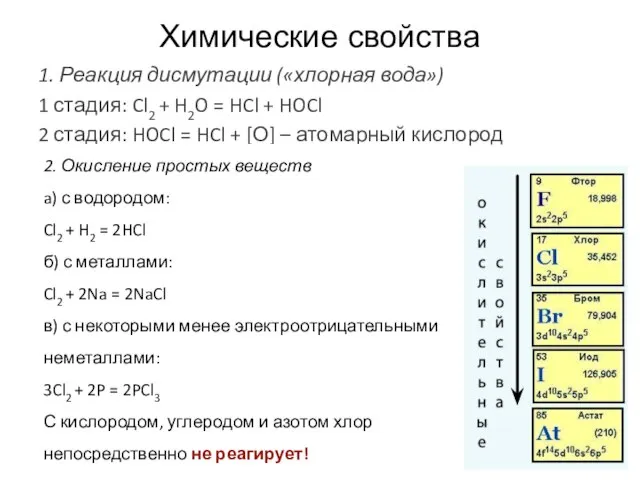
- 16. Химические свойства 1. Реакция дисмутации («хлорная вода») 1 стадия: Cl2 + H2O = HCl + HOCl
- 17. 3. Взаимодействие со сложными веществами а) с водой: см. выше реакция дисмутации б) с кислородсодержащими кислотами:
- 18. Важнейшие соединения хлора Хло́роводоро́д, хло́ристый водоро́д (HCl) Бесцветный, термически устойчивый газ (при н.у.) с резким запахом,
- 19. Свойства соляной кислоты: Очень устойчива к нагреванию В воде кислота Слабый окислитель по протону Под действием
- 20. Как окислитель реагирует: Mg + 2 HCl → MgCl2 + H2↑ Конц. соляная кислота реагирует с
- 21. Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину.
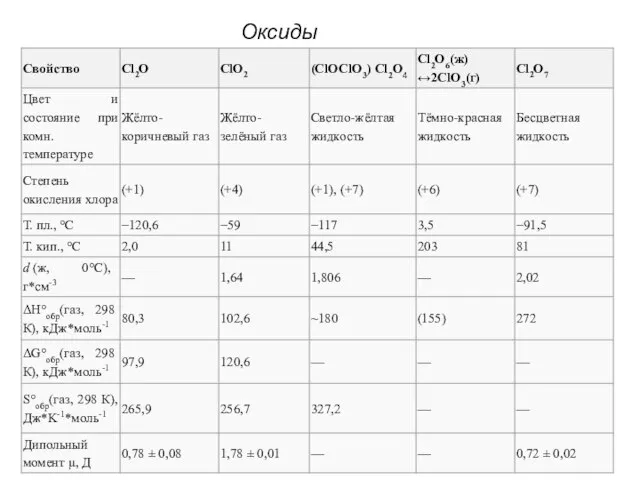
- 22. Оксиды хлора
- 23. Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты (Cl2O) В нормальных условиях представляет собой буровато-жёлтый газ
- 24. Диоксид хлора, оксид хлора (IV), (ClO2) В нормальных условиях газ красновато-жёлтого цвета, с характерным запахом. При
- 25. Проявляет окислительно-восстановительные свойства. 2ClO2 + 5H2SO4 (разб.) + 10FeSO4 = 5Fe2(SO4)3 + 2HCl + 4H2O ClO2
- 26. Хлорноватистая кислота (HClO) Очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь
- 27. Хлористая кислота (HClO2) Одноосновная кислота средней силы. В свободном виде неустойчива, даже в разбавленном водном растворе
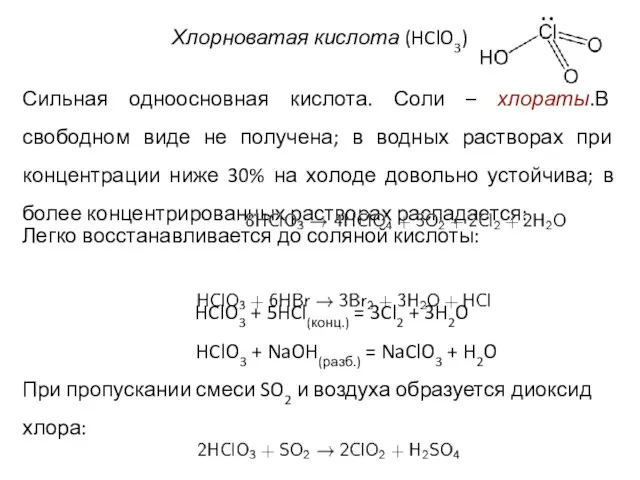
- 28. Хлорноватая кислота (HClO3) Сильная одноосновная кислота. Соли – хлораты.В свободном виде не получена; в водных растворах
- 29. Получение Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение:
- 30. Получение Метод Дикона Метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Электрохимические методы Сегодня хлор в
- 31. Самые большие запасы хлора содержатся в составе солей вод морей и океанов
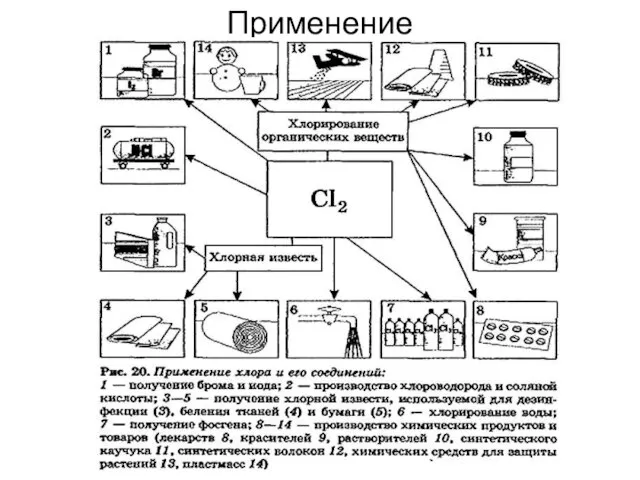
- 32. Применение
- 33. Физиологическое действие Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье.
- 34. Бром и его пары сильно токсичны. Уже при содержании брома в воздухе в концентрации около 0,001
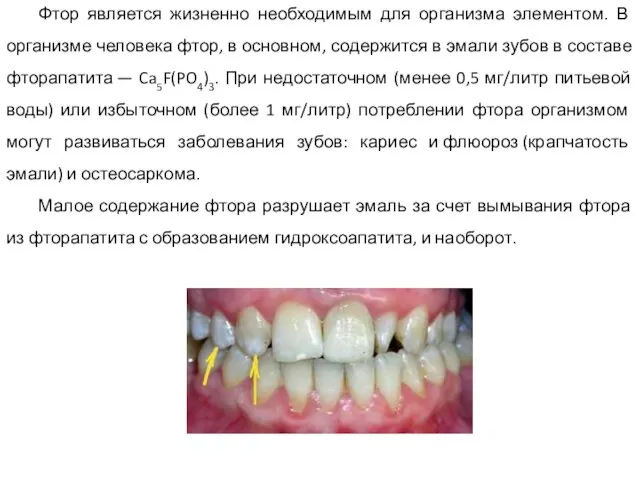
- 35. Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали
- 37. Скачать презентацию


























 Авторы: Семёнова Софья Петрова Елена 8 класс МОУ Бондарская СОШ 2010 Конкурс «Мой учитель»
Авторы: Семёнова Софья Петрова Елена 8 класс МОУ Бондарская СОШ 2010 Конкурс «Мой учитель» В гостях у сказки, устройство детской разновозрастной площадки
В гостях у сказки, устройство детской разновозрастной площадки Зелёная жаба
Зелёная жаба Правосознание и правовая культура
Правосознание и правовая культура НЕ и НИ. Слитное и раздельное написание
НЕ и НИ. Слитное и раздельное написание Отклоняющееся и противоправное поведение
Отклоняющееся и противоправное поведение Техника безопасности на уроках информатики
Техника безопасности на уроках информатики Нарушения слуха
Нарушения слуха Цилиндр
Цилиндр Фирма в условиях совершенной конкуренции
Фирма в условиях совершенной конкуренции Для умных женщин Одна супружеская пара поехала в выходные на озеро порыбачить.
Для умных женщин Одна супружеская пара поехала в выходные на озеро порыбачить. Пример схемы для ЕАСД. Схемы размещения моторовагонных депо
Пример схемы для ЕАСД. Схемы размещения моторовагонных депо Казахстанский опыт борьбы с коррупцией
Казахстанский опыт борьбы с коррупцией Совещание с представителями органов исполнительной власти субъектов Российской Федерации, осуществляющих управление
Совещание с представителями органов исполнительной власти субъектов Российской Федерации, осуществляющих управление Часть 2.
Часть 2. Тема урока:
Тема урока: Обеспечение успешной адаптации ребенка к обучению в школе
Обеспечение успешной адаптации ребенка к обучению в школе Презентация на тему Геометрические тела и плоские фигуры (6-9 класс)
Презентация на тему Геометрические тела и плоские фигуры (6-9 класс) День победы
День победы Африка
Африка Россия - мать, жена, сестра, невеста!
Россия - мать, жена, сестра, невеста! Наука. Технологии. Я
Наука. Технологии. Я Искусство
Искусство Стратегия формирования привлекательности товарного предложения
Стратегия формирования привлекательности товарного предложения Родительское собрание
Родительское собрание К ВОПРОСУ О ЗЕРНОВОМ СОСТАВЕ МЕЛКОГО ЗАПОЛНИТЕЛЯ ДЛЯ БЕТОНОВ Козлов А.В., канд. техн. наук, ОАО ЦНИИС
К ВОПРОСУ О ЗЕРНОВОМ СОСТАВЕ МЕЛКОГО ЗАПОЛНИТЕЛЯ ДЛЯ БЕТОНОВ Козлов А.В., канд. техн. наук, ОАО ЦНИИС Управление предприятием и его устойчивость. Лекция 2
Управление предприятием и его устойчивость. Лекция 2 Человек – личность
Человек – личность