Содержание
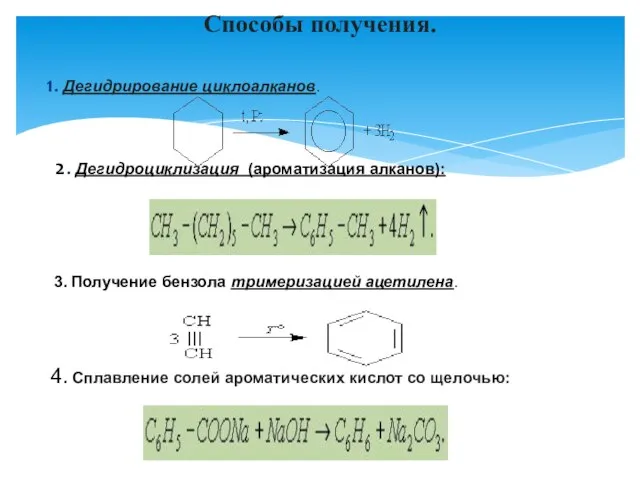
- 2. 1. Дегидрирование циклоалканов. 2. Дегидроциклизация (ароматизация алканов): 3. Получение бензола тримеризацией ацетилена. 4. Сплавление солей ароматических
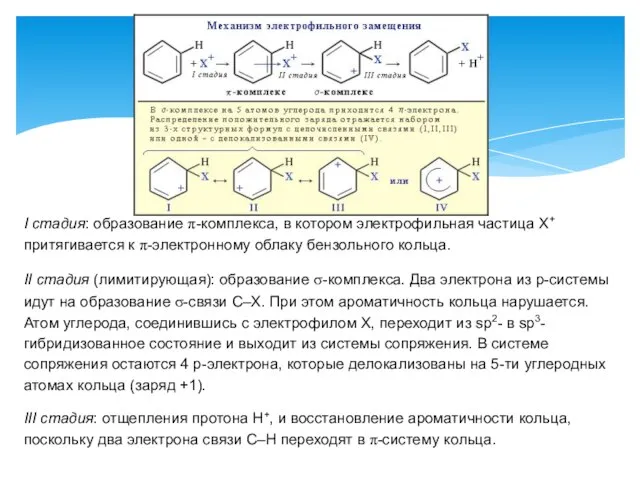
- 3. Обладая подвижной шестеркой p -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует
- 4. I стадия: образование π-комплекса, в котором электрофильная частица Х+ притягивается к π-электронному облаку бензольного кольца. II
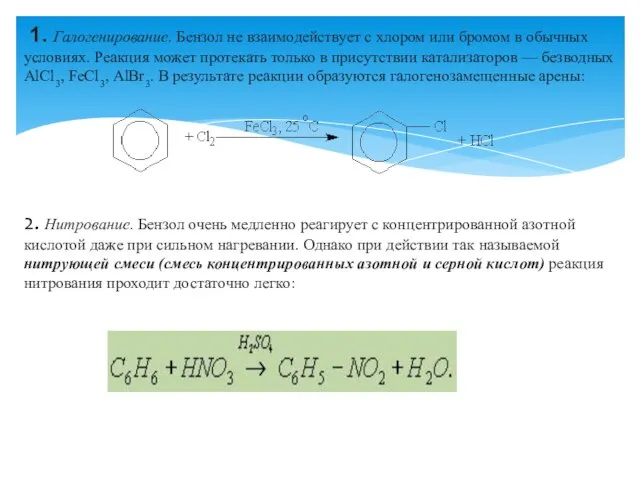
- 5. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только
- 6. 3. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением
- 7. 4.Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят
- 8. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от
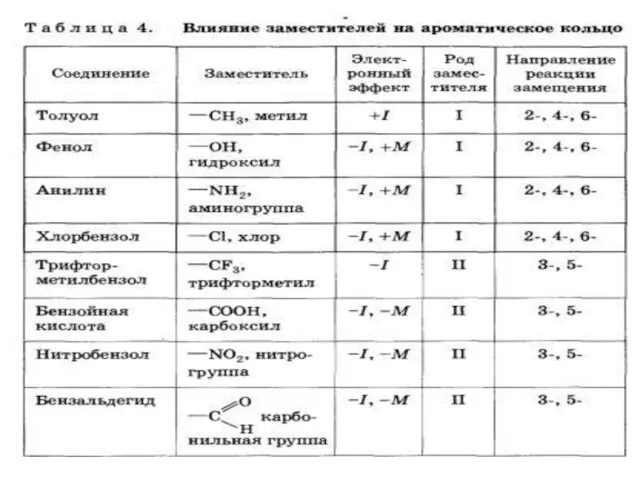
- 9. Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): 1.электронодонорные 2.электроноакцепторные.
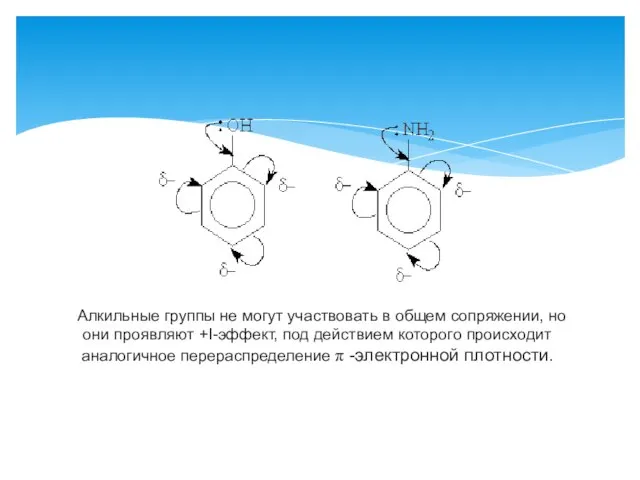
- 10. Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит
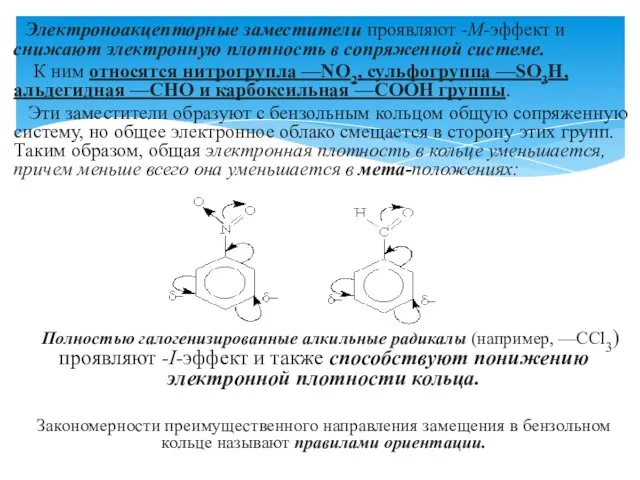
- 11. Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2,
- 12. Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называются
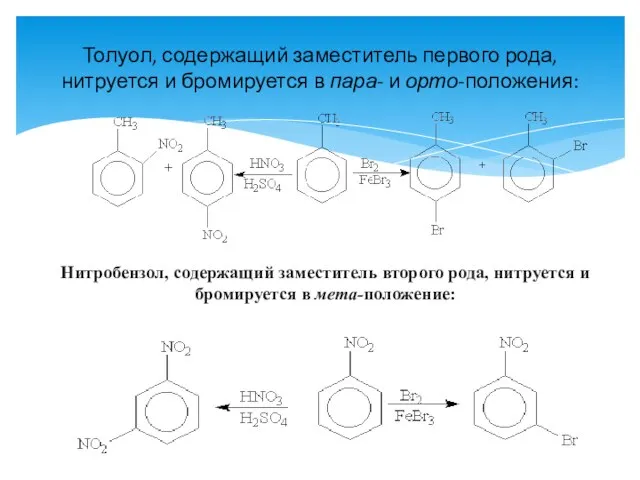
- 13. Толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения: Нитробензол, содержащий заместитель второго
- 15. 1. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических
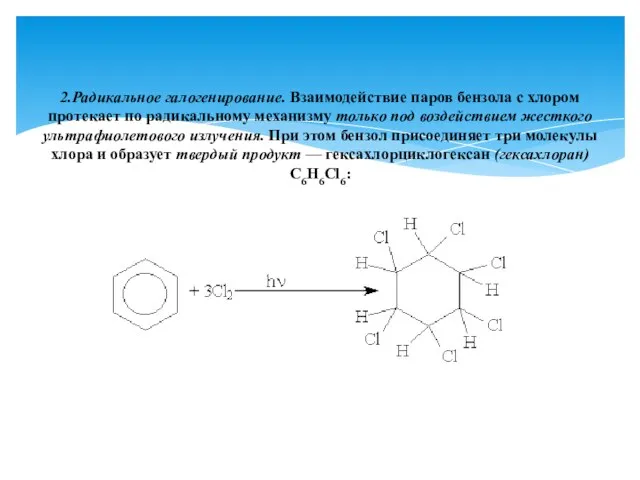
- 16. 2.Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового
- 17. Метильная группа проявляет положительный индуктивный эффект по отношению к бензольному кольцу. Соответственно бензольное кольцо обладает отрицательным
- 19. Скачать презентацию








 Всероссийская олимпиада по искусству
Всероссийская олимпиада по искусству Современный взгляд на брендинг
Современный взгляд на брендинг Презентация на тему Переместительное свойство сложения (1 класс)
Презентация на тему Переместительное свойство сложения (1 класс) Портретная студийная съёмка
Портретная студийная съёмка ПРОГРАММА ПРОФЕССИОНАЛЬНОЙ ПЕРЕПОДГОТОВКИ
ПРОГРАММА ПРОФЕССИОНАЛЬНОЙ ПЕРЕПОДГОТОВКИ Вот и закончились школьные годы.
Вот и закончились школьные годы. История развития олимпийского движения в России
История развития олимпийского движения в России Гипоталамус
Гипоталамус  Презентация на тему Лев Николаевич Толстой (4 класс)
Презентация на тему Лев Николаевич Толстой (4 класс) Художественная ковка. 2 класс
Художественная ковка. 2 класс Формы государства
Формы государства Наука в спорте Академическая гребля
Наука в спорте Академическая гребля Тема_22
Тема_22 Разработка идентификаторов бренда
Разработка идентификаторов бренда БольшаяОхта_ЛСР (1)
БольшаяОхта_ЛСР (1) История возникновения и развития игры в волейбол
История возникновения и развития игры в волейбол Тайны частей света
Тайны частей света ARDES с гордостью представляет свою новую бирку Feedlot
ARDES с гордостью представляет свою новую бирку Feedlot В.Д. Поленов «Заросший пруд»
В.Д. Поленов «Заросший пруд» Регенераторы цифровых сигналов
Регенераторы цифровых сигналов Типовой макет презентации инвестиционного проекта
Типовой макет презентации инвестиционного проекта Презентация на тему Новейшее время история продолжается сегодня (4 класс)
Презентация на тему Новейшее время история продолжается сегодня (4 класс) Интернет как интеллектуальная среда для поддержки исследований и обучения
Интернет как интеллектуальная среда для поддержки исследований и обучения Черняк Юлия Анатольевна аспирантка юридического факультета
Черняк Юлия Анатольевна аспирантка юридического факультета Almaty GTUG в развитии рынка мобильных приложений в Казахстане
Almaty GTUG в развитии рынка мобильных приложений в Казахстане На старте. Команда колледжа КИУ
На старте. Команда колледжа КИУ Альтернативная гражданская служба
Альтернативная гражданская служба Незнайка на планете Плотность
Незнайка на планете Плотность