Содержание
- 2. НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет
- 3. Первое закон термодинамики Первый закон термодинамика – это закон сохранения энергии, распространенный на тепловые явления. Он
- 4. Невозможность создания вечного двигателя Задолго до открытия закона сохранения энергии Французская Академия наук приняла в 1775г.
- 5. Применение I закона к изопроцессам 1) T=const – изотермический δT=0 Q=A’ δU=0 2) P=const – изобарный
- 6. Второй закон термодинамики Второй закон термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость
- 7. И Людвиг Больцман выдвинул спасительную теорию, что Вселенную необходимо рассматривать в целом, поскольку процессы, происходящие в
- 8. Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что означает от греческого «эволюция»
- 9. Третий закон термодинамики Открытие третьего начала термодинамики связано с нахождением химического средства - величины , характеризующих
- 11. Скачать презентацию
Слайд 2НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Нулевое начало термодинамики сформулированное всего около 50 лет
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Нулевое начало термодинамики сформулированное всего около 50 лет

Слайд 3 Первое закон термодинамики
Первый закон термодинамика – это закон сохранения
Первое закон термодинамики
Первый закон термодинамика – это закон сохранения

Часто вместо работы А внешних тел над системой рассматривают работу А` системы над внешними телами. Учитываю, что А`= -А, первый закон термодинамики в в форме δU = A+Q можно переписать так: Q=δU+A`
Суть первого закона в утверждении: изменение так определенной энергии не зависит от процесса и определяется только начальным и конечным состояниями системы. Это означает, что внутренняя энергия – однозначная функция состояние системы и в замкнутой системе сохраняется.
Слайд 4Невозможность создания вечного двигателя
Задолго до открытия закона сохранения энергии Французская Академия наук
Невозможность создания вечного двигателя
Задолго до открытия закона сохранения энергии Французская Академия наук

Под вечным двигателем первого рода понимают устройство, которое могло бы совершать неограниченное количество работы без затраты топлива или каких-либо других материалов.
Вечные двигатели обычно конструируют на основе использования следующих приёмов или их комбинаций:
1) Подъем воды с помощью архимедова винта;
2) Подъем воды с помощью капилляров;
3) Использование колеса с неуравновешивающимися грузами;
4) Природные магниты;
5) Электромагнетизм;
6) Пар или сжатый воздух.
Слайд 5Применение I закона к изопроцессам
1) T=const – изотермический
δT=0
Q=A’
δU=0
2)
Применение I закона к изопроцессам
1) T=const – изотермический
δT=0
Q=A’
δU=0
2)
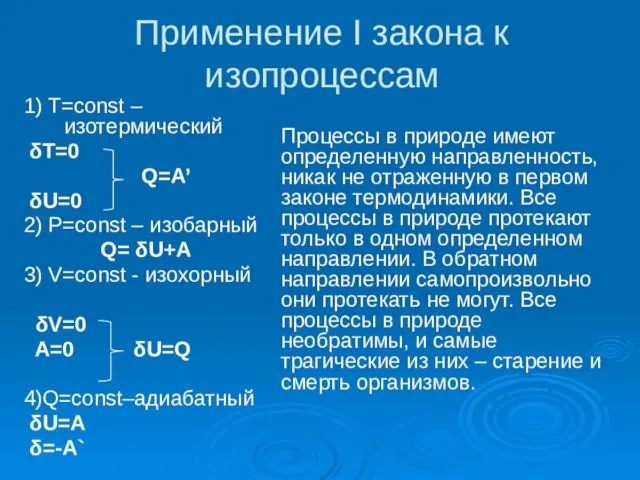
Q= δU+A
3) V=const - изохорный
δV=0
A=0 δU=Q
4)Q=const–адиабатный
δU=A
δ=-A`
Процессы в природе имеют определенную направленность, никак не отраженную в первом законе термодинамики. Все процессы в природе протекают только в одном определенном направлении. В обратном направлении самопроизвольно они протекать не могут. Все процессы в природе необратимы, и самые трагические из них – старение и смерть организмов.
Слайд 6Второй закон термодинамики
Второй закон термодинамики указывает направление возможных энергетических превращений и тем
Второй закон термодинамики
Второй закон термодинамики указывает направление возможных энергетических превращений и тем

Немецкий ученный Р. Клаузиус сформулировал этот закон так: невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Другая формулировка принадлежит английскому ученому У. Кельвину: невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Согласно 2 началу все процессы природы идут в оду сторону, к увеличению беспорядка, уменьшению энергии, а при “полном беспорядке” – напишет Клаузиус – наступит всеобщая смерть – всякое движение прекратится. Это грустный прогноз вызвал бурю возражений.
Слайд 7И Людвиг Больцман выдвинул спасительную теорию, что Вселенную необходимо рассматривать в целом,

Слайд 8Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что
Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что

1) Энтропия системы является экстенсивным свойством . Если система состоит из нескольких частей , то полная энтропия системы равна сумме энтропии каждой части .
Изменение энтропии S состоит из двух частей . Обозначим через δS поток энтропии, обусловленный взаимодействием с окружающей средой , а через δS - часть энтропии , обусловленную изменениями внутри системы , имеем δS = δS1 + δS2
Приращение энтропии δS обусловленное изменением внутри системы, никогда не имеет отрицательное значение . Величина δS = 0 , только тогда , когда система претерпевает обратимые изменения , но она всегда положительна , если в системе идут такие же необратимые процессы.
Таким образом:
δS = 0 ( обратимые процессы );
δS > 0( необратимые процессы );
Для изолированной системы поток энтропии равен нулю и выражения обратимого процесса и необратимого процесса сводятся к следующему виду : δS1 = δS > 0 ( изолированная система ).
Слайд 9Третий закон термодинамики
Открытие третьего начала термодинамики связано с нахождением химического средства -
Третий закон термодинамики
Открытие третьего начала термодинамики связано с нахождением химического средства -

 Франция во второй половине XIX века
Франция во второй половине XIX века Влияние ребрендинга на финансовые результаты компании
Влияние ребрендинга на финансовые результаты компании [Группа 152]
[Группа 152] Экология и автомобиль
Экология и автомобиль Центр молодежной политики ГАУГН. Паспорт студента. Руководство пользования
Центр молодежной политики ГАУГН. Паспорт студента. Руководство пользования Интерфероны
Интерфероны Сухопутные войска (пехота, артиллерия, ракетные части, танки)
Сухопутные войска (пехота, артиллерия, ракетные части, танки) Антуан Монкретьн де Ваттевіль
Антуан Монкретьн де Ваттевіль Народная мораль в характере главных героев Л.Н.Толстого «Старый дед и внучек»
Народная мораль в характере главных героев Л.Н.Толстого «Старый дед и внучек» ПЕРВАЯЛЮБОВЬсвежесть отношений
ПЕРВАЯЛЮБОВЬсвежесть отношений Воспитательные технологии: от КТД до тренингов. Резервные возможности использования дискуссионных, проблемных методов в современ
Воспитательные технологии: от КТД до тренингов. Резервные возможности использования дискуссионных, проблемных методов в современ Ионный двигатель с СВЧ ионизацией
Ионный двигатель с СВЧ ионизацией Химические раскопки по классам неорганических соединений
Химические раскопки по классам неорганических соединений Понятие конфликта. (Урок 3)
Понятие конфликта. (Урок 3) Внешняя политика Россиив начале XIX века
Внешняя политика Россиив начале XIX века Мой магазин Настольных игр
Мой магазин Настольных игр EA-OD19
EA-OD19 Презентация на тему Средневековый город и его обитатели 6 класс
Презентация на тему Средневековый город и его обитатели 6 класс  Имидж делового человека
Имидж делового человека Общепринятая структура научного текста
Общепринятая структура научного текста Loving Hut. Контент-план
Loving Hut. Контент-план ПРЕЗЕНТАЦИЯ Новосибирск 2009 г.
ПРЕЗЕНТАЦИЯ Новосибирск 2009 г. БИРЖЕВЫЕ НОВОСТИ –КАКИМИ ИМ БЫТЬ?На примере распространения информации Казахстанской фондовой биржей (KASE)
БИРЖЕВЫЕ НОВОСТИ –КАКИМИ ИМ БЫТЬ?На примере распространения информации Казахстанской фондовой биржей (KASE) Варианты покраски
Варианты покраски Три девицы под окном
Три девицы под окном Возможности продвижения тиражируемых продуктов
Возможности продвижения тиражируемых продуктов Этнокультурный компонент в технологическом образовании как средство познания мира
Этнокультурный компонент в технологическом образовании как средство познания мира СМС дети УЛЫБКА. Здоровая пробежка
СМС дети УЛЫБКА. Здоровая пробежка