Слайд 21. Введение
Гипотеза «1 ген – 1 фермент», обоснованная в 40-х годах,

допускала два возможных объяснения взаимосвязи между генами и признаками – гены либо сами являются специфичными белками-ферментами, либо, каким то образом, определяют строение ферментов. В те годы генетическая роль ДНК еще не была установлена и многие генетики склонялись к признанию белковой природы генов. Первый шаг к раскрытию сущности генетической информации был сделан в 1949 году, ещё до появления модели строения ДНК.
Слайд 31. Гены и белки
Взаимосвязь между генами и строением белков впервые

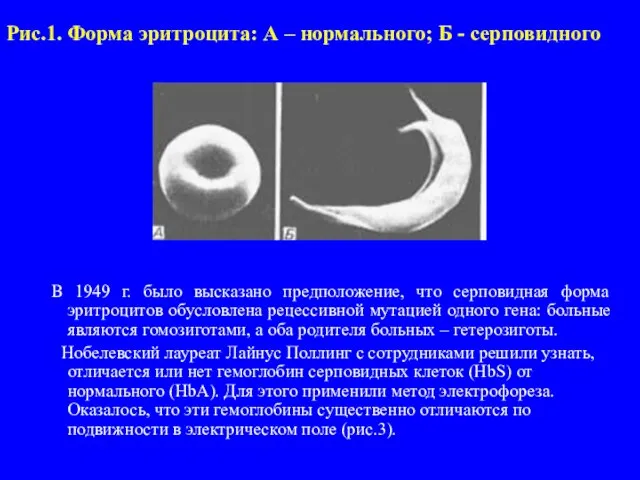
была показана при изучении одной из болезней человека – серповидно клеточной анемии. У больных при низкой концентрации кисло-рода в воздухе (например, в высокогорье) эритроциты принима-ют серповидную форму (рис.1). Это приводит к комплексу на-рушений (рис.2), главным из которых является недостаточное снабжение организма кислородом. В условиях пониженного парциального давления кислорода у родителей таких больных (гетерозигот) болезнь проявляется в легкой форме. Особенно часто серповидно клеточная анемия встречается во влажных экваториальных районах, где распространена тропическая маля-рия. Малярийный плазмодий не может развиваться в крови но-сителей серповидно клеточной анемии. Носители мутантного гена (гетерозиготы) имеют в этих районах селективное преиму-щество перед нормальными гомозиготами – они не страдают ни от малярии, ни от анемии.
Слайд 4Рис.1. Форма эритроцита: А – нормального; Б - серповидного
В
1949 г. было высказано предположение, что серповидная форма эритроцитов обусловлена рецессивной мутацией одного гена: больные являются гомозиготами, а оба родителя больных – гетерозиготы.
Нобелевский лауреат Лайнус Поллинг с сотрудниками решили узнать, отличается или нет гемоглобин серповидных клеток (HbS) от нормального (HbA). Для этого применили метод электрофореза. Оказалось, что эти гемоглобины существенно отличаются по подвижности в электрическом поле (рис.3).
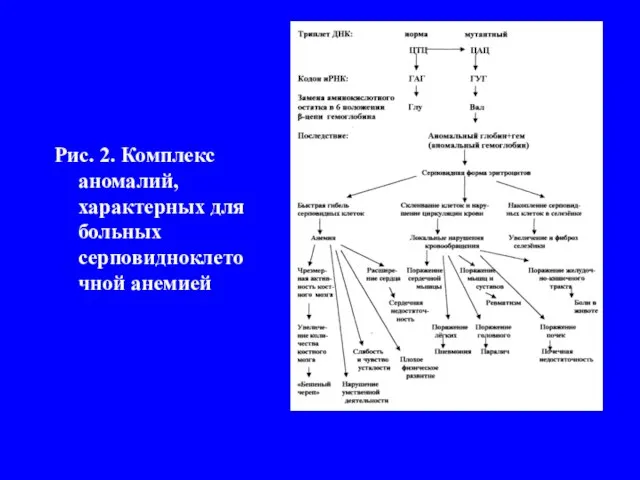
Слайд 5Рис. 2. Комплекс аномалий, характерных для больных серповидноклеточной анемией
Слайд 6Рис. 3. Электрофоретическая подвижность гемоглобина здорового человека (вверху) и больного (в середине).
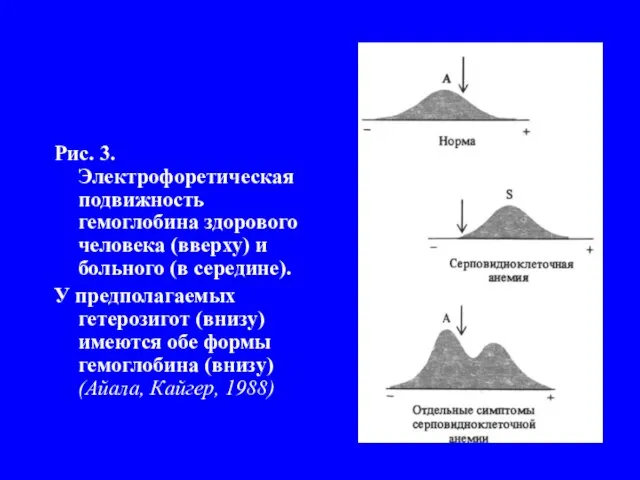
У предполагаемых гетерозигот (внизу) имеются обе формы гемоглобина (внизу) (Айала, Кайгер, 1988)
Слайд 7 Очевидно, мутация, вызывающая серповидно-клеточность, связана с изменениями белка – гемоглобина. У

гомозигот в эритроцитах имеются только изменённые молекулы гемоглобина (HbS), у гетерозигот есть как изменённые, так и нормальные молекулы (HbA). Логично было предположить, что в генах, определяющих структуру белковых цепей молекулы гемоглобина, закодирована информация об их аминокислотном составе.
Молекула гемоглобина состоит из четырёх полипептидных цепей – двух идентичных α–цепей (по 141 аминокислотному остатку в каждой) и двух идентичных β-цепей (по 146 аминокислотных остатков).
Слайд 8 В 1957 году предположение Л. Поллинга было экспериментально доказано Верноном Ингрэмом.

Он определил, что в шестом положении β-цепи нормально-го гемоглобина находится остаток глутаминовой кислоты, а в серповидноклеточном гемоглобине он заменён на валин:
β-цепь HbA : Вал – Гис – Лей – Тре – Про – Глу – Глу - …
Номер аминокис-
лоты в β-цепи: 1 2 3 4 5 6 7
β-цепь HbS : Вал – Гис – Лей – Тре – Про – Вал – Глу - …
Слайд 9Таким образом, стало очевидно, что генетическая информация – это информация о последовательности

аминокислотных остатков в полипептидных цепях, т.е. в белках.
Слайд 10 Многие белки состоят из двух и более различающихся полипептидных цепей, каждая

из которых кодируется своим геном. Поэтому формулировка «один ген – один фермент» была уточнена – «один ген – одна полипептидная цепь».
Как мутации генов могут повлиять на активность закодированных в них ферментов?
Активность молекулы фермента сильно зависит от её пространственной (третичной) структуры, которая, в свою очередь, определяется первичной структурой полипептидной цепи. Одни мутации (нонсенс-мутации) могут блокировать синтез всей полипептидной цепи или некоторой её части. Ясно, что у таких мутантов данный фермент будет отсутствовать. Другие мутации связаны с отдельными аминокислотными заменами в полипептидной цепи. Эти замены могут затрагивать функционально важные аминокислотные остатки, а также вызывать искажения пространственной структуры молекулы. В зависимости от того, насколько сильно эти искажения сказываются на структуре функционально важных участков, может наблюдаться снижение и даже полное исчезновение ферментативной или иной функциональной активности белка.
Слайд 112. Внутригенная комплементация
Многие белки состоят из двух или нескольких идентичных

полипептид-ных цепей, образующих функционально активную четвертичную белковую структуры. В простейшем случае это - димер (α2), состоящий из двух одинако-вых субъединиц (α). Например, пусть некие мутантные аллели m1 и m2 одного и того же гена в условиях гомозиготности (m1m1 и m2m2) приводят к некото-рому мутантному фенотипу (к отсутствию определенной ферментативной активности). На основании сформулированных представлений следовало бы полагать, что поскольку обе мутации затрагивают один и тот же ген, то и ге-терозиготы m1m2 также должны иметь мутантный фенотип. В большинстве случаев для генов, кодирующих олигомерные белки, это действительно так. Но известны примеры отклонений от этого правила - две «дефектные» поли-пептидные цепи, кодируемые содержащимися в двойной гетерозиготе генами с различными мутациями, могут объединиться с образованием олигомерного белка, обеспечивающего более или менее нормальный фенотип. Это явление называют внутригенной комплементацией (рис.4). Некоторые гетероаллели данного гена могут проявлять способность к комплементации такого рода, а некоторые - нет. Это зависит от локализации конкретных мутаций, которые в одном случае могут затрагивать участки полипептидной цепи, ответственные за взаимодействие между субъединицами, а в другом - области, не участвующие непосредственно в процессе олигомеризации, но существенные для проявления функциональной активности данного белка.
Слайд 12Рис. 4. Схема, иллюстрирующая внутригенную комплементацию на примере двух мутантных полипептидов, взаимодействующих
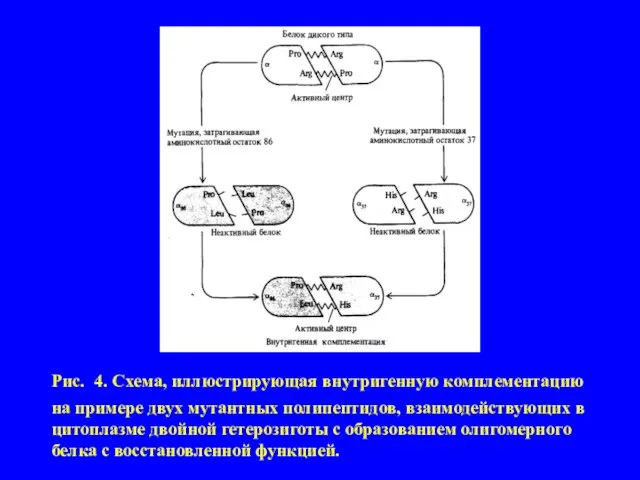
в цитоплазме двойной гетерозиготы с образованием олигомерного белка с восстановленной функцией.











 Анализ качества питьевой воды
Анализ качества питьевой воды ПРАВИЛА ДОРОЖНОГО ДВИЖЕНИЯИ СТАТИСТИКА ДОРОЖНО-ТРАНСПОРТНЫХ ПРОИСШЕСТВИЙ
ПРАВИЛА ДОРОЖНОГО ДВИЖЕНИЯИ СТАТИСТИКА ДОРОЖНО-ТРАНСПОРТНЫХ ПРОИСШЕСТВИЙ My bank Cossack
My bank Cossack Презентация на тему КВН по информатике и математике
Презентация на тему КВН по информатике и математике ПОРТОВАЯ ОСОБАЯ ЭКОНОМИЧЕСКАЯ ЗОНА НА ТЕРРИТОРИИ МУНИЦИПАЛЬНОГО ОБРАЗОВАНИЯ «ЧЕРДАКЛИНСКИЙ РАЙОН» УЛЬЯНОВСКОЙ ОБЛАСТИ
ПОРТОВАЯ ОСОБАЯ ЭКОНОМИЧЕСКАЯ ЗОНА НА ТЕРРИТОРИИ МУНИЦИПАЛЬНОГО ОБРАЗОВАНИЯ «ЧЕРДАКЛИНСКИЙ РАЙОН» УЛЬЯНОВСКОЙ ОБЛАСТИ Самоактуализирующаяся личность: ресурс креативности и особенности реагирования на стресс
Самоактуализирующаяся личность: ресурс креативности и особенности реагирования на стресс Композиция в фотографии
Композиция в фотографии Презентация на тему Изменение глаголов по лицам и числам (4 класс)
Презентация на тему Изменение глаголов по лицам и числам (4 класс) 4
4 Межнациональные конфликты Выход республик из СССР
Межнациональные конфликты Выход республик из СССР Эстафетный бег
Эстафетный бег Имя – знак судьбы
Имя – знак судьбы Den_litseya
Den_litseya Презентация на тему Повторение орфографических правил
Презентация на тему Повторение орфографических правил По законам словотворчесва
По законам словотворчесва Противопучинные мероприятия ОСПТ Reline фундамент
Противопучинные мероприятия ОСПТ Reline фундамент Презентация на тему Влияние вредных привычек на Сердечно – сосудистую систему
Презентация на тему Влияние вредных привычек на Сердечно – сосудистую систему  Пельмени Левадики
Пельмени Левадики Спортсмены Самарской области
Спортсмены Самарской области Управление визуального мерчендайзинга. Форма для фотоочета
Управление визуального мерчендайзинга. Форма для фотоочета Афинская демократия
Афинская демократия Проект на тему
Проект на тему Презентация на тему Роспись жостовских подносов
Презентация на тему Роспись жостовских подносов Австралия (2 класс)
Австралия (2 класс) Мой любимый писатель В.Г. Короленко
Мой любимый писатель В.Г. Короленко Чынгыз Айтматов
Чынгыз Айтматов Методологические аспекты психологии личности. Тема 1
Методологические аспекты психологии личности. Тема 1 С днем поселка Таёжный
С днем поселка Таёжный