Содержание
- 2. Формы нахождения в природе ЩМ и ЩЗМ – соли: ЩМ – Г-, NO3-, SO42-, CO32- (реже)
- 3. Обогащение руд (отделение пустой породы) Разделение по: плотности магнитным свойствам смачиваемости растворимости ... Очистка, разделение смесей
- 4. Цианидное выделение золота порода с Au + NaCN, O2 Na[Au(CN)2] р-р Zn Au↓ + Na2[Zn(CN)4] р-р
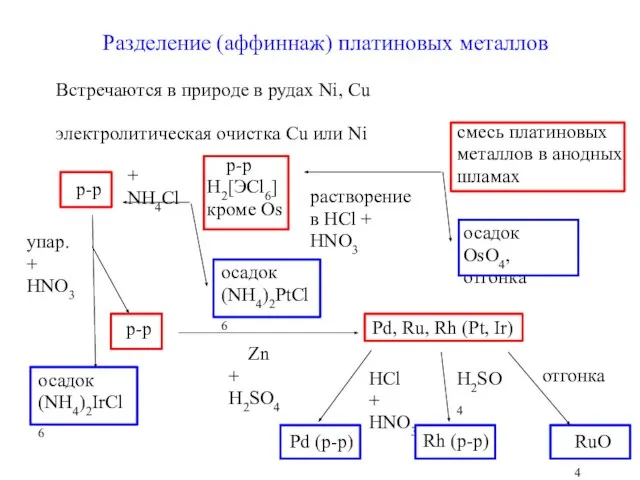
- 5. Разделение (аффиннаж) платиновых металлов Встречаются в природе в рудах Ni, Cu электролитическая очистка Cu или Ni
- 6. Методы получения простых веществ Перевод оксидов или солей в летучие галогениды: M2Ox + xC + xГ2
- 7. Получение железа Доменный процесс 2C + O2 => 2CO 3C + Fe2O3 => 2Fe + 3CO
- 8. Получение алюминия анод: угольные стержни электролит: р-р Al2O3 в расплаве Na3AlF6 катод: жидкий Al на дне
- 9. Получение меди первичные Cu минералы – сульфиды (CuFeS2, CuS, Cu2S) вторичные минералы: куприт Cu2O тенорит CuO
- 11. Скачать презентацию


![Цианидное выделение золота порода с Au + NaCN, O2 Na[Au(CN)2] р-р Zn](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/403936/slide-3.jpg)




 ОБЛАКА (6 класс)
ОБЛАКА (6 класс) Язык программирования Pascal. Процедуры и функции
Язык программирования Pascal. Процедуры и функции Поговорим об этикете
Поговорим об этикете Всемирный Банк и МолодежьThe Young Professionals Program
Всемирный Банк и МолодежьThe Young Professionals Program Руководство Ernst&Young по составления бизнес-планов
Руководство Ernst&Young по составления бизнес-планов Формированиеруководящих органов Платформы и план работ на I квартал 2011 (представление проектарешения заседания)
Формированиеруководящих органов Платформы и план работ на I квартал 2011 (представление проектарешения заседания) Бакланова Людмила Николаевна, учитель географии высшей квалификационной категории МОУ Чайковская средняя общеобразовательная ш
Бакланова Людмила Николаевна, учитель географии высшей квалификационной категории МОУ Чайковская средняя общеобразовательная ш Русская культура. Предметы русского быта
Русская культура. Предметы русского быта Welcome to 2011:что ждет рекламодателей
Welcome to 2011:что ждет рекламодателей Наука как деятельность. Спорт как объект научного исследования
Наука как деятельность. Спорт как объект научного исследования Космос, земля, человек.
Космос, земля, человек. Плетение
Плетение Презентация на тему Русская культура
Презентация на тему Русская культура Антибактериальный гель для рук
Антибактериальный гель для рук Испанском художнике Диего Веласкесе
Испанском художнике Диего Веласкесе Использование информационных средств обучения на уроках истории и обществознания
Использование информационных средств обучения на уроках истории и обществознания DIU - Активные виды деятельности
DIU - Активные виды деятельности Неустойка. Формы неустойки
Неустойка. Формы неустойки Презентация на тему Нью-Йорк
Презентация на тему Нью-Йорк Презентация
Презентация Использование опорных схем на уроках русского языка- один из способов формирования информационных и коммуникативных компетентно
Использование опорных схем на уроках русского языка- один из способов формирования информационных и коммуникативных компетентно mdk_02
mdk_02 Идеальная бровь
Идеальная бровь Избирательная система РФ
Избирательная система РФ 2022.10.28_Презентация на Думу
2022.10.28_Презентация на Думу ЦУКУРОВ Олег Анатольевич Заместитель Генерального директора ОАО «Институт сварки России», член Технического комитета по станда
ЦУКУРОВ Олег Анатольевич Заместитель Генерального директора ОАО «Институт сварки России», член Технического комитета по станда Контрперенос и принципы работы бессознательного
Контрперенос и принципы работы бессознательного Рунические формулы на все случаи жизни
Рунические формулы на все случаи жизни