Содержание
- 2. Классификация минеральных удобрений - по агрохимическому назначению: прямые – содержат питательные элементы; косвенные – для улучшения
- 3. – по агрегатному состоянию: 1. твердые; 2. жидкие (NH3 · H2O, суспензии, водные растворы). – по
- 4. Азотные удобрения нитратные – KNO3; амидные – СО(NH2)2; аммонийные – (NH4)2SO4, NH3·H2O, NH4NO3 – 35% N.
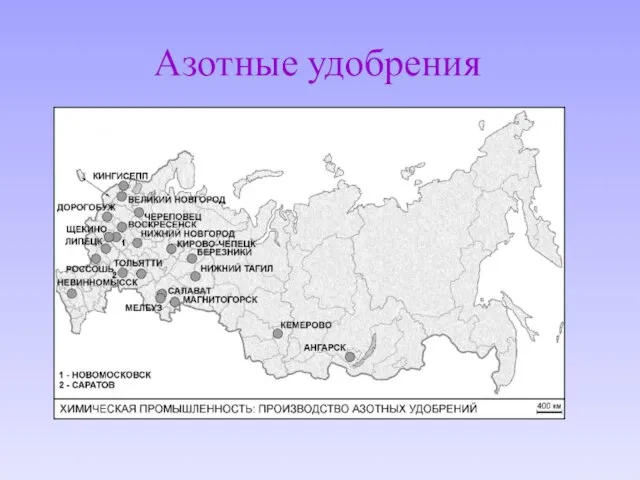
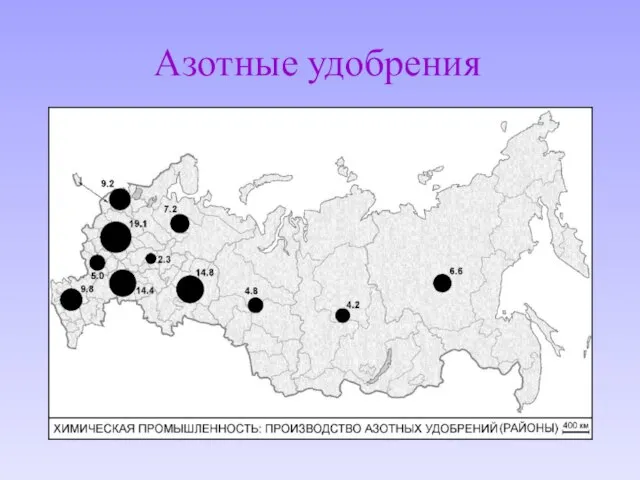
- 5. Азотные удобрения
- 6. Азотные удобрения
- 7. Производство NH4NO3 Достоинства: высокое содержание азота – 35%; растворимость в воде Недостаток: гигроскопичность, слёживаемость, поэтому –
- 8. Производство NH4NO3 NH3 + HNO3 → NH4NO3 ΔH = -144,9 кДж/моль Лимитирующая стадия – диффузия аммиака
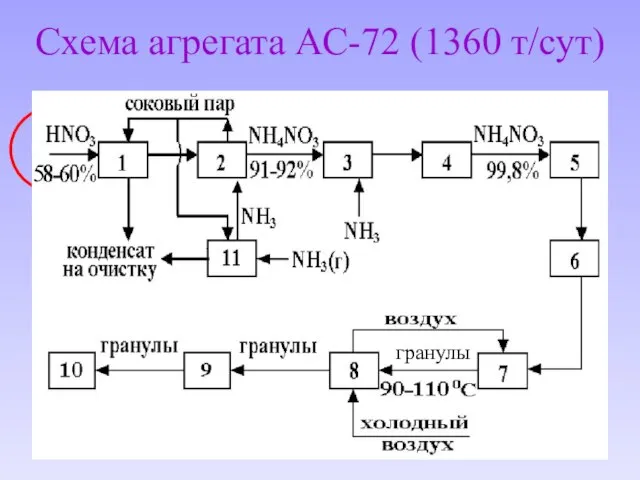
- 9. Схема агрегата АС-72 (1360 т/сут) 5 гранулы
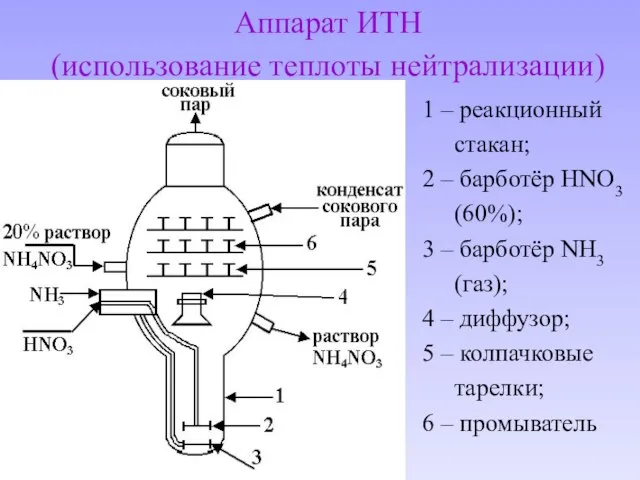
- 10. Аппарат ИТН (использование теплоты нейтрализации) 1 – реакционный стакан; 2 – барботёр HNO3 (60%); 3 –
- 11. 1 – подогреватель HNO3 до 70 – 800 С соковым паром из 2; 2 – два
- 12. Производство карбамида (мочевины) - CO(NH2)2
- 13. Мочевина открыта в 1773 г в моче И.Руэлем, идентифицирована У.Праутом в 1818 г, синтезирована Ф.Вёлером (1828)
- 14. Использование мочевины (106 млн.т/год – 1984; 15,9 - 1995 г. все азотные) удобрение; кормовые добавки; синтез
- 15. Достоинства карбамида: высокое содержание азота - 46,6%, негигроскопичность, небольшие потери за счёт вымывания из почвы Получение
- 16. Условия : 1 стадия: Р>15-20 МПа (реакция идёт с уменьшением объёма), t = 150-190о С (для
- 17. Условия : Итак: t = 180-230oC, P = 12-25 МПа, но превращение не полное, смесь содержит
- 18. Открытая схема: отделение карбамида, а не прореагировавшие NH3 и CO2 – на синтез NH4NO3. Для этого
- 19. Рецикл жидкой фазы - стриппинг -процесс (отдувка) - разложение карбамата при высоком давлении вследствие продувки сжатым
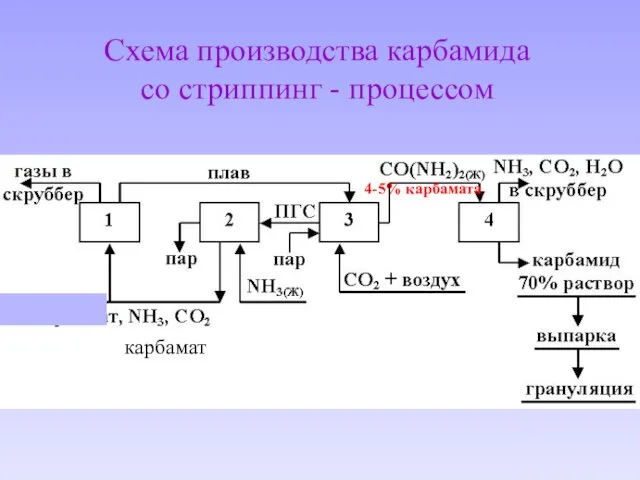
- 20. Схема производства карбамида со стриппинг - процессом
- 21. 1 – колонна синтеза карбамида (2-я стадия), 170 – 190 0С, 13 – 15 МПа, NH3
- 22. Очистка сточных вод Биологическая очистка после разбавления сточных вод до концентрации карбамид аммиак
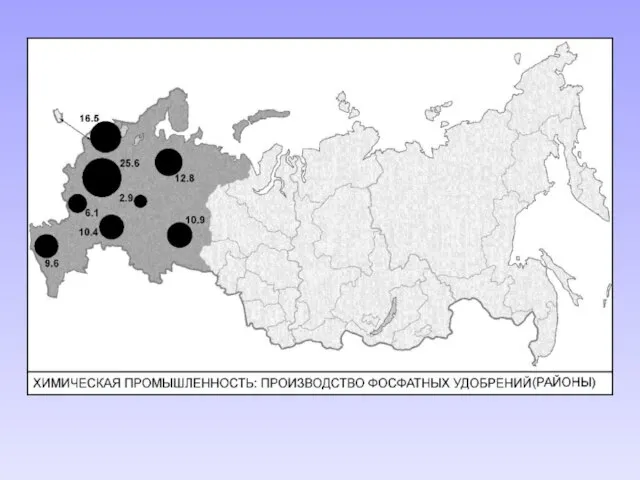
- 23. ПРОИЗВОДСТВО ФОСФОРНЫХ УДОБРЕНИЙ
- 24. Сырьё для производства – природные фосфаты () Название апатиты происходит от греч. «апатао» – обманываю, поскольку
- 25. Цвет апатитов: бледно–зелёный, голубой, желто–зелёный, розовый
- 26. Месторождения: Хибинское (1925 г.) на Кольском полуострове – крупнейшее в мире (несколько километров, глубина 100–200 метров):
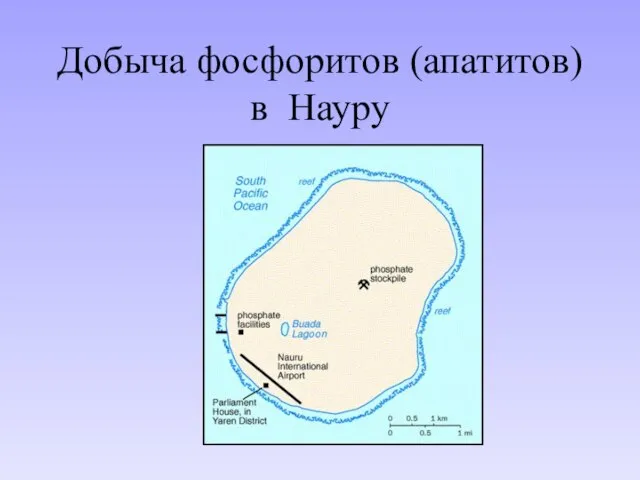
- 27. Науру – территория 21 кв. км, население - 10,7 тыс. чел. (1998 г.)
- 28. Добыча фосфоритов (апатитов) в Науру
- 31. Методы переработки апатитов (1990 г. – 3,85 млн.т; 1995 г.– 2,17 млн.т) механические (фосфоритная мука); термические;
- 32. Методы переработки апатитов Химические: при обработке минеральными кислотами получают простой суперфосфат и ортофосфорную кислоту, из которых
- 33. Производство простого суперфосфата Суммарная реакция: 2Ca5F(PO4)3 + 7H2SO4 + 6,5H2O → → 3[Ca(H2PO4)2 · H2O] +
- 34. Производство простого суперфосфата II стадия (медленно, 5 – 20 суток на складе): после расходования H2SO4 апатит
- 35. Условия: избыток H2SO4 (1,07 ÷ 1,14), концентрация H2SO4 68,5 – 69,5 % – оптимальная для кристаллизации
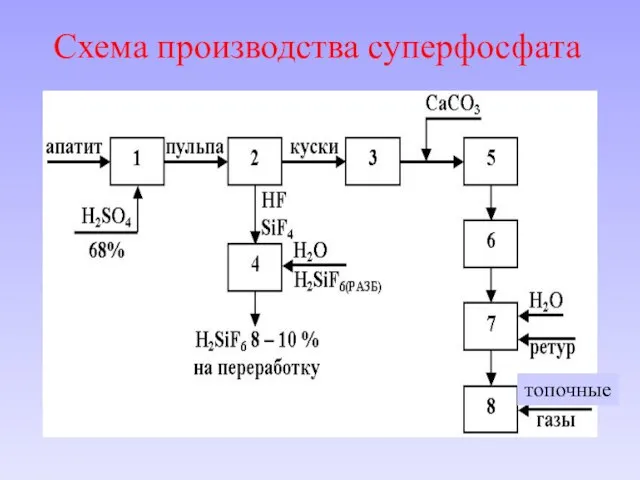
- 36. Схема производства суперфосфата
- 37. 1 – смеситель (t =110 – 115 0C); 2 – суперфосфатная камера; 3 – склад (дозревание)
- 38. Простой суперфосфат Недостатки: низкое содержание фосфора - 19 – 21% P2O5; высокая доля балласта - CaSO4
- 39. Двойной суперфосфат Достоинства: высокое содержание фосфора - 42 – 50 % P2O5; высокая доля водорастворимого фосфора
- 40. Методы получения H3PO4
- 41. термический – получение белого фосфора и его дальнейшее окисление: электротермическое восстановление апатитов Ca5F(PO4)3 + 6SiO2 +
- 42. конденсация паров фосфора – (t≥500 C), под водой окисление фосфора P4 + 5О2 → 2Р2О5 Р2О5
- 43. гидролиз фосфора – перспективный метод P4 + 10Н2О → 2Р2О5 + 10Н2 t = 600 -
- 44. Применение H3PO4 производство удобрений; неорганических солей (фосфаты); органический синтез; получение активированного угля; антикоррозийные покрытия; в производстве
- 45. Методы получения двойного суперфосфата камерный (малоэффективный); поточный (непрерывный). Ca5F(PO4)3 + 7H3РO4 + 5H2O → 5[Ca(H2PO4)2 ·
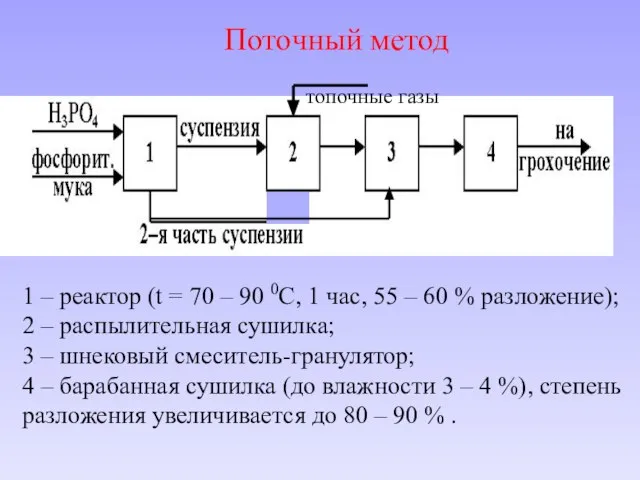
- 46. Поточный метод 1 – реактор (t = 70 – 90 0C, 1 час, 55 – 60
- 48. Скачать презентацию



































 Реформа языка Карамзина
Реформа языка Карамзина Варианты расчета бонуса за два месяца
Варианты расчета бонуса за два месяца Эксплуатация автомобильного транспорта
Эксплуатация автомобильного транспорта Государство в политической системе
Государство в политической системе ИСТОРИЯ СПИЧЕК
ИСТОРИЯ СПИЧЕК Презентация на тему Растения-индикаторы
Презентация на тему Растения-индикаторы Мышление как психический процесс. Виды и формы мышления. 4 формата мышления
Мышление как психический процесс. Виды и формы мышления. 4 формата мышления Субъекты правовых отношений. Правовое положение лиц
Субъекты правовых отношений. Правовое положение лиц скульптура «Под одними звездами» ("Unter den gleichen Sternen")
скульптура «Под одними звездами» ("Unter den gleichen Sternen") Виды гимнастики
Виды гимнастики Hilton Hotels & Resorts
Hilton Hotels & Resorts Шар. Елка. Снеговик
Шар. Елка. Снеговик Обзор православной литературы Доброе слово для малых ребят
Обзор православной литературы Доброе слово для малых ребят Водные маршруты
Водные маршруты Презентация на тему Василий Тёркин
Презентация на тему Василий Тёркин  Технология приготовления пиццы
Технология приготовления пиццы Мир в свечах Выполнила: Плаксунова Людмила МОУ СОШ №4 Руководитель: Чуприна Т.В.
Мир в свечах Выполнила: Плаксунова Людмила МОУ СОШ №4 Руководитель: Чуприна Т.В. "Поле - чудес" по произведениям К.И. Чуковского
"Поле - чудес" по произведениям К.И. Чуковского PURE_THERAPY_Bezuprechnaya_idealno_ochischennaya_kozha
PURE_THERAPY_Bezuprechnaya_idealno_ochischennaya_kozha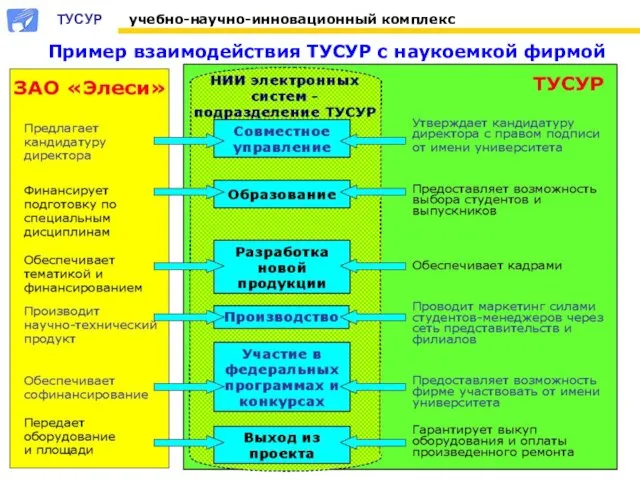 Пример взаимодействия ТУСУР с наукоемкой фирмой
Пример взаимодействия ТУСУР с наукоемкой фирмой Введение в менеджмент
Введение в менеджмент Австралия
Австралия Who should be the first ?
Who should be the first ? Велосипедный туризм
Велосипедный туризм Музей восстания машин
Музей восстания машин Презентация "Художники пореформенной России" - скачать презентации по МХК
Презентация "Художники пореформенной России" - скачать презентации по МХК Хочу отдыхать
Хочу отдыхать Сенситивные периоды человека (методика Марии Монтессори)
Сенситивные периоды человека (методика Марии Монтессори)