Содержание
- 2. Большинство аналитических реакций протекает в растворах, поэтому основным фундаментом аналитической химии является теория растворов. Растворами называют
- 3. Ионизация - превращение нейтральных атомов или молекул в ионы под влиянием химических процессов, под действием ионизирующих
- 4. Закон действующих масс открыли в 1864 году норвежские учёные. Данный закон устанавливает связь между скоростью и
- 5. Скорость этой реакции прямо пропорциональна произведению концентраций реагирующих веществ. где k1 – коэффициент пропорциональности, равный скорости
- 6. При достижении определённых концентраций веществ A,B, C и D, скорости прямой и обратной реакций уравниваются –
- 7. При составлении уравнений для констант равновесия учитывают только вещества (атомы, ионы, молекулы, радикалы), которые находятся в
- 8. Знание константы равновесия химической реакции позволяет: - предсказать направление ее протекания при существующих условиях, сделать вывод
- 10. Скачать презентацию







 Отряд Мозоленогие. Верблюды
Отряд Мозоленогие. Верблюды Практический семинар«Проектирование мультимедийного урока»
Практический семинар«Проектирование мультимедийного урока» Учителя МОКУ СОШ №2 г. Лузы Кировской области
Учителя МОКУ СОШ №2 г. Лузы Кировской области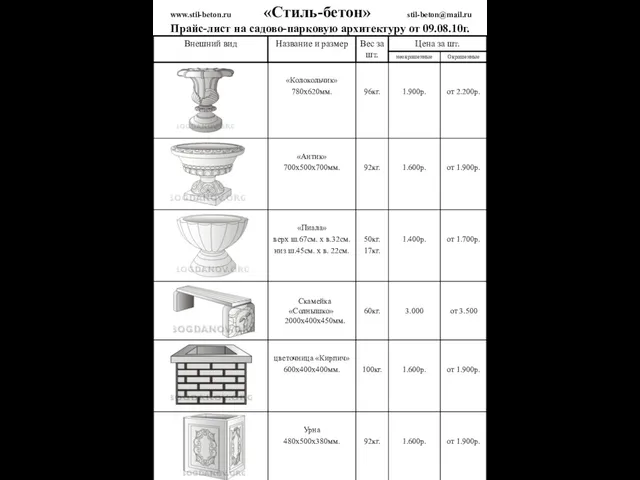 www.stil-beton.ru «Стиль-бетон»
www.stil-beton.ru «Стиль-бетон»  Гармония звуков, образов, красок в пейзажной лирике русских поэтов(А.А.Фета, Ф.И.Тютчева,Я.П.Полонского).
Гармония звуков, образов, красок в пейзажной лирике русских поэтов(А.А.Фета, Ф.И.Тютчева,Я.П.Полонского). Подготовка к ЕГЭ по русскому языку. Работа с микротекстом
Подготовка к ЕГЭ по русскому языку. Работа с микротекстом Коммуникационные технологии
Коммуникационные технологии Допрос, очная ставка: понятие, особенности, порядок осуществления. Подготовила: Калужина Ю.К.
Допрос, очная ставка: понятие, особенности, порядок осуществления. Подготовила: Калужина Ю.К. Современные информационные технологии в деятельности педагогов
Современные информационные технологии в деятельности педагогов Пятно как средство выражения. (Ритм пятен)
Пятно как средство выражения. (Ритм пятен) Тема презентации. Шаблон
Тема презентации. Шаблон Виды невербальных средств коммуникации
Виды невербальных средств коммуникации ЗЕМЛЯ ВОКРУГ ШЕРЕМЕТЬЕВО
ЗЕМЛЯ ВОКРУГ ШЕРЕМЕТЬЕВО Сертификат на предоставление дисконта к процентной ставке
Сертификат на предоставление дисконта к процентной ставке Talking About Writing
Talking About Writing Как излагать тему на Альфе
Как излагать тему на Альфе  Клубы микрорайона
Клубы микрорайона Техник-технолог хлебопекарного производства
Техник-технолог хлебопекарного производства Чешки для вашего ребенка
Чешки для вашего ребенка Упражнения для тренировки дома
Упражнения для тренировки дома Архитектурное законодательство и нормирование
Архитектурное законодательство и нормирование Great British Sporting Events!
Great British Sporting Events! Презентация на тему Нарушения темпа речи
Презентация на тему Нарушения темпа речи  Правовая группа. Интеллектуальная собственность
Правовая группа. Интеллектуальная собственность Сарсенбаев Ерсултан
Сарсенбаев Ерсултан Конституция – основной закон страны
Конституция – основной закон страны Средневековая Европа и Византия: 2 пути исторического развития
Средневековая Европа и Византия: 2 пути исторического развития Установление фактов, имеющих юридическое значение
Установление фактов, имеющих юридическое значение