Содержание
- 2. знать и уметь называть соли азотной кислоты, определять какие свойства окислительные или и восстановительные характерны для
- 3. Игра «КРЕСТИКИ- НОЛИКИ Раствор азотной кислоты реагирует с каждым из веществ.
- 4. К каким классам неорганических веществ принадлежат эти вещества? 1.Назовите соли - продукты этих реакций 2. Составьте
- 5. Закончите уравнения реакций и объясните, какие классы соединений при взаимодействии могут давать нитраты. ВаО + НNO3→
- 6. Даны пары веществ, составьте возможные уравнения реакций а) гидроксид натрия и азотная кислота, б) гидроксид калия
- 7. Перечислите соли полученные в результате возможных реакций. Нитраты калия, натрия, кальция и аммония называют селитрами KNO3
- 8. Нитраты – твердые кристаллические вещества, тугоплавки, определите по таблице растворимости, к каким электролитам они относятся -
- 9. Физические свойства нитратов Какие вещества называют солями? Нужно построить логическую цепочку: вид химической связи – тип
- 10. Химические свойства нитратов Взаимодействие нитратов с металлами, кислотами, щелочами, солями Cu(NO3)2 + Zn … , AgNO3
- 11. Занимательная история Любознательный химик изучил типы химических реакций и заметил, что нерастворимые карбонаты (CaCO3) , сульфиты
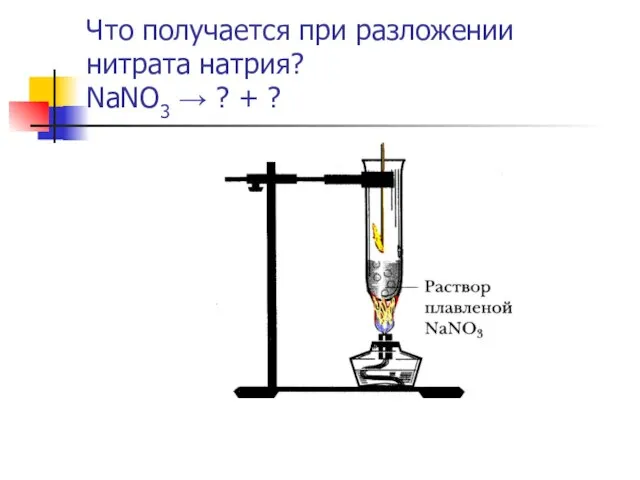
- 12. Что получается при разложении нитрата натрия? NaNO3 → ? + ?
- 13. После первого опыта юный химик решил проверить, как будут разлагаться другие соли, например, нитрат меди(II) ,
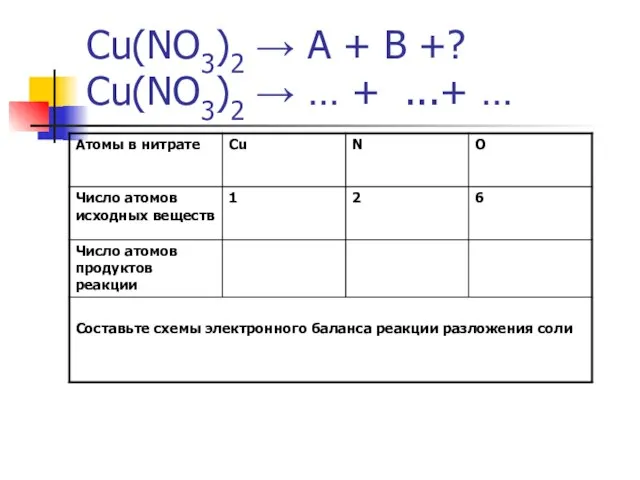
- 14. Cu(NO3)2 → А + В +? Cu(NO3)2 → … + ...+ …
- 15. Разложение нитрата меди (II)
- 17. Скачать презентацию












 «Настольная кукла»
«Настольная кукла» Форматы графических файлов
Форматы графических файлов Pets and presidents
Pets and presidents Елена Александровна Благинина
Елена Александровна Благинина Легкая атлетика. Определение лёгкой атлетики
Легкая атлетика. Определение лёгкой атлетики Основные требования к кандидатской диссертацииКак написать хорошую диссертацию
Основные требования к кандидатской диссертацииКак написать хорошую диссертацию Презентация на тему Наполеон и Кутузов по Толстому
Презентация на тему Наполеон и Кутузов по Толстому Начертательная геометрия
Начертательная геометрия Межличностные отношения
Межличностные отношения Затратный подход. Метод оценки стоимости объекта с учётом износа
Затратный подход. Метод оценки стоимости объекта с учётом износа Имя числительное (3 класс)
Имя числительное (3 класс) «1С-Отчетность»удобный способэлектронной отчетности
«1С-Отчетность»удобный способэлектронной отчетности Электронная коммерция в туризме
Электронная коммерция в туризме Тундра 3 класс
Тундра 3 класс Многие песни А. Пахмутовой незаметно вошли в нашу жизнь, они активно воздействуют на людей- воспитывают их мысли и чувства, помогаю
Многие песни А. Пахмутовой незаметно вошли в нашу жизнь, они активно воздействуют на людей- воспитывают их мысли и чувства, помогаю Моя республикаТатарстан
Моя республикаТатарстан Понятие, предмет, объект, субъект, история развития муниципального права
Понятие, предмет, объект, субъект, история развития муниципального права Государственная программа "Образование и развитие инновационной экономики: внедрение современной модели образования в 2009 - 2012 г
Государственная программа "Образование и развитие инновационной экономики: внедрение современной модели образования в 2009 - 2012 г Мой любимый детский сад Журавушка
Мой любимый детский сад Журавушка Олимпийский центр «Вентспилс»
Олимпийский центр «Вентспилс» Использование результатов ОГЭ и ЕГЭ в повышении качества образования по иностранному языку
Использование результатов ОГЭ и ЕГЭ в повышении качества образования по иностранному языку Молодіжні субкультури
Молодіжні субкультури УЧИТЕЛЯ
УЧИТЕЛЯ Презентация на тему Продажа имения старой графини» математическая игра для10-11 классов
Презентация на тему Продажа имения старой графини» математическая игра для10-11 классов  Что в имени тебе моем...?
Что в имени тебе моем...? dr
dr Мастер-класс по изготовлению куклы-дергунчика
Мастер-класс по изготовлению куклы-дергунчика Водоросли
Водоросли