Содержание
- 2. Сера Сера – халькоген, довольно активный неметалл. Сущетсвует три аллотропных модификации серы: ромбическая S8 пластическая моноклинная
- 3. Характеристика серы Сера в ПСХЭ: положение (период, группа) строение атома свойства элемента по периоду / в
- 4. Получение При сливании растворов сероводородной и сернистой кислот: H2SO3 + 2H2S = 3S + 3H2O При
- 5. Химические свойства Не смачивается и не реагирует с водой. Как окислитель реагирует с: металлами (кроме золота)
- 6. Химические свойства Как восстановитель реагирует с: кислородом хлором фтором
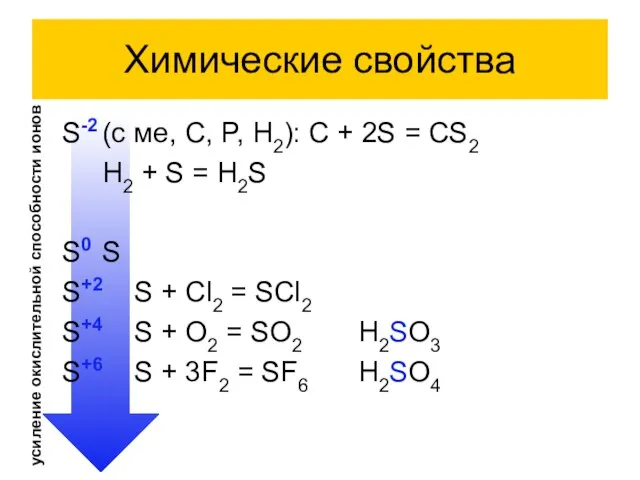
- 7. Химические свойства S-2 (с ме, C, P, H2): C + 2S = CS2 H2 + S
- 8. Сероводород H2S – сероводород. Его раствор в воде называется сероводородной кислотой. Кислота слабая двухосновная, поэтому диссоциирует
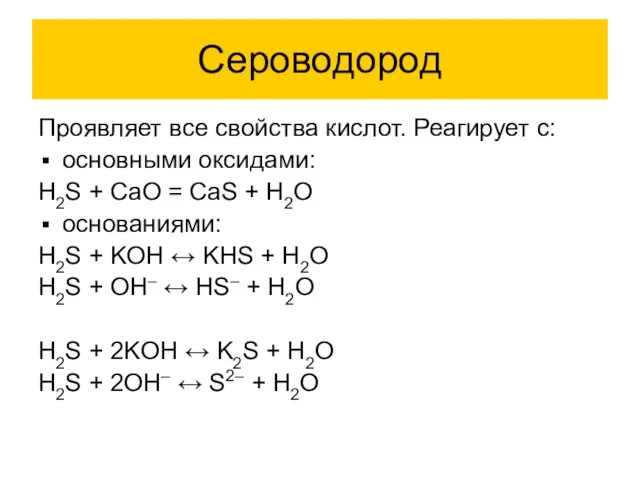
- 9. Сероводород Проявляет все свойства кислот. Реагирует с: основными оксидами: H2S + CaO = CaS + H2O
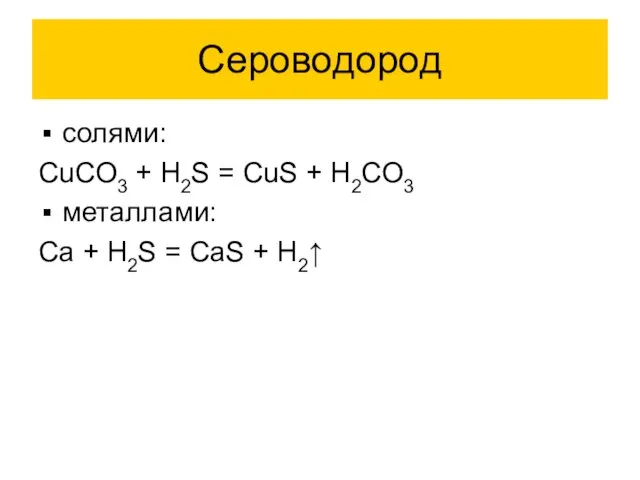
- 10. Сероводород солями: CuCO3 + H2S = CuS + H2CO3 металлами: Ca + H2S = CaS +
- 11. Свойства солей Кислые соли сероводородной кислоты – гидросульфиды (KHS, NaHS) хорошо растворимы в воде. Растворимыми также
- 12. Окисление сероводорода Сероводород легко окисляется кислородом (как при избытке O2 и недостатке?). Бромной водой Br2: H2S
- 13. Оксид серы (IV) SO2 – сернситый газ. Реагирует с водой с образование H2SO3. Типичный кислотный оксид.
- 14. Оксид серы (IV) Получают: горением серы обжигом пирита действием кислот на сульфиты взаимодействием конц. серной кислоты
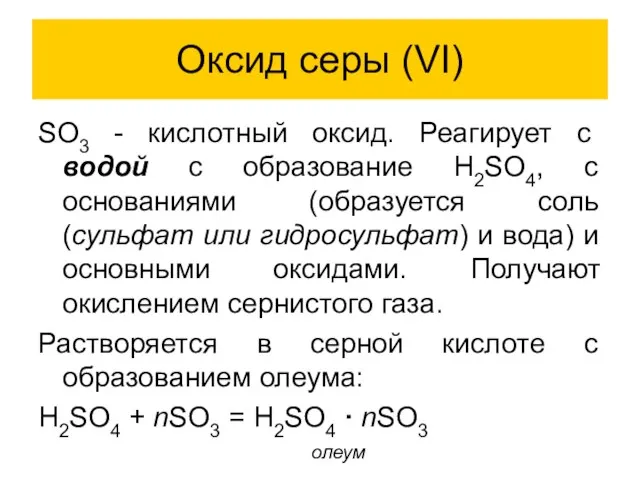
- 15. Оксид серы (VI) SO3 - кислотный оксид. Реагирует с водой с образование H2SO4, с основаниями (образуется
- 16. Серная кислота Серная кислота H2SO4 – тяжёлая маслянистая жидкость без запаха и цвета. При концентрации >
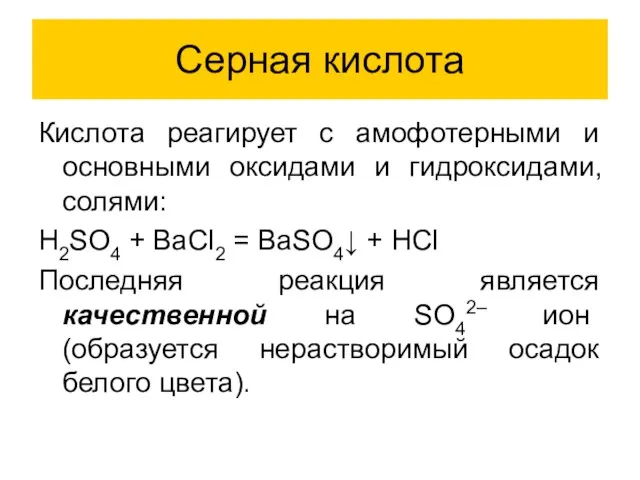
- 17. Серная кислота Кислота реагирует с амофотерными и основными оксидами и гидроксидами, солями: H2SO4 + BaCl2 =
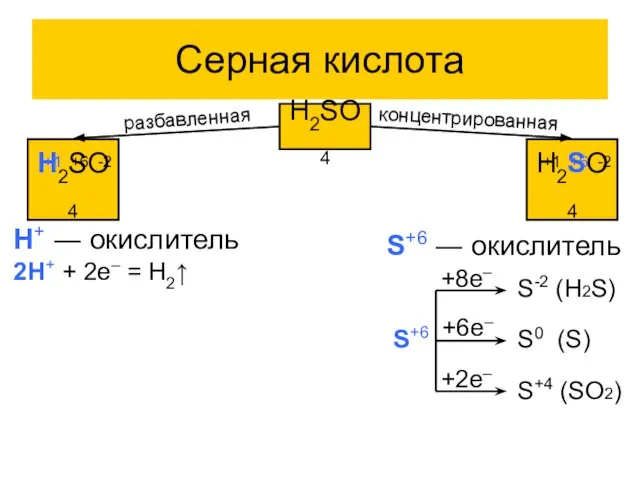
- 18. Серная кислота H2SO4 H2SO4 +1 +6 -2 H2SO4 +1 +6 -2 разбавленная концентрированная H+ ― окислитель
- 19. Серная кислота C разбавленной серной кислотой реагируют все металлы, стоящие в ряду активности до водорода. При
- 20. Концентрированная серная кислота Металлы, стоящие в ряду активности после водорода, взаимодействуют с концентрированной серной кислотой по
- 21. Концентрированная серная кислота Более активными ме серная кислота при определённых условиях может восстанавливаться до серы в
- 22. Получение серной кислоты получение SO2 (обычно обжигом пирита) окисление SO2 в SO3 в присутсвии катализатора –
- 23. Сульфаты Соли серной кислоты имеют все свойства солей. Особенным является их отношение к нагреванию: сульфаты активных
- 24. Вопросы в каких реакциях сера играет роль окислителя? восстановителя? какие степени она при этом проявляет? чем
- 26. Скачать презентацию

















 Активизация деятельности учащихся с помощью интерактивных технологий
Активизация деятельности учащихся с помощью интерактивных технологий ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ
ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ Грибы. Общая характеристика грибов. Шляпочные грибы
Грибы. Общая характеристика грибов. Шляпочные грибы Правила устройства и безопасной эксплуатации сосудов, работающих под давлением
Правила устройства и безопасной эксплуатации сосудов, работающих под давлением Санкт-Петербургский государственный университетинформационных технологий, механики и оптики
Санкт-Петербургский государственный университетинформационных технологий, механики и оптики Геометрия корпуса судна
Геометрия корпуса судна Ознакомление с технологией изготовления витража
Ознакомление с технологией изготовления витража Достопримечательности Зарубежной Азии - Япония
Достопримечательности Зарубежной Азии - Япония Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека
Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека УСТРОЙСТВА ПЛАВНОГО ПУСКА
УСТРОЙСТВА ПЛАВНОГО ПУСКА Презентация на тему Теллур
Презентация на тему Теллур  Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны
Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны Художник в театре
Художник в театре VoevodinskaiaIndustrijaMesa
VoevodinskaiaIndustrijaMesa Творческое объединение лего-мастерская Шелезяка. Робототехника
Творческое объединение лего-мастерская Шелезяка. Робототехника Александр Иванович Куприн
Александр Иванович Куприн Рассказ на свободную тему
Рассказ на свободную тему Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Дворцово-парковые ансамбли
Дворцово-парковые ансамбли Статистические методы в параметрическом анализе
Статистические методы в параметрическом анализе Параллельное и последовательное соединения проводников
Параллельное и последовательное соединения проводников Зерновые культуры (7 класс)
Зерновые культуры (7 класс) Ой, да Краснодарский край!
Ой, да Краснодарский край! Россия в условиях Первой мировой войны и общенационального кризиса
Россия в условиях Первой мировой войны и общенационального кризиса Кроссворд по сказкамГанса Христиана Андерсена
Кроссворд по сказкамГанса Христиана Андерсена Проект Free Way Кучер Максим Краснодар
Проект Free Way Кучер Максим Краснодар Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот
Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот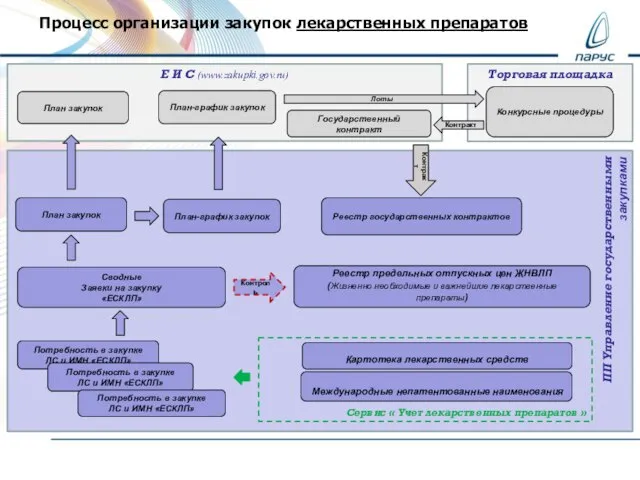 ПФХД_Закуупки_Бухгалтерия
ПФХД_Закуупки_Бухгалтерия