Содержание
- 2. Щелочные металлы – элементы IA группы Перечислите известные вам щелочные металлы. Сколько электронов на внешнем энергетическом
- 3. Из истории открытия элементов 19 ноября 1907 года в Лондоне на заседании Королевского химического общества сэр
- 5. 3 января 1959 года В небе появилась комета. Необычная комета – искусственная: из летящей к Луне
- 6. Физические свойства Какое строение характерно для кристаллов щелочных металлов? Как изменяются температуры кипения и плавления? Какой
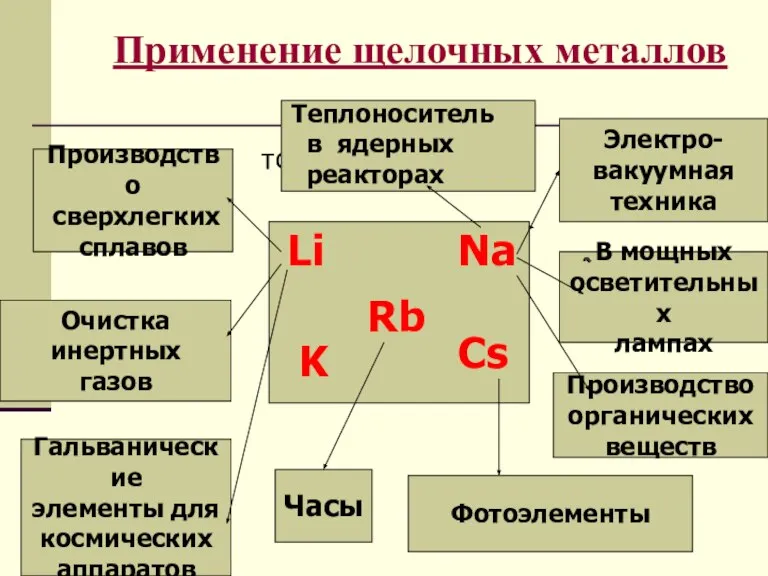
- 7. Применение щелочных металлов тото Электро- вакуумная техника В мощных осветительных лампах Производство органических веществ Производство сверхлегких
- 8. Соединения щелочных металлов В ветхом завете упоминается некое вещество «нетер». Это вещество употребляли как моющее средство.
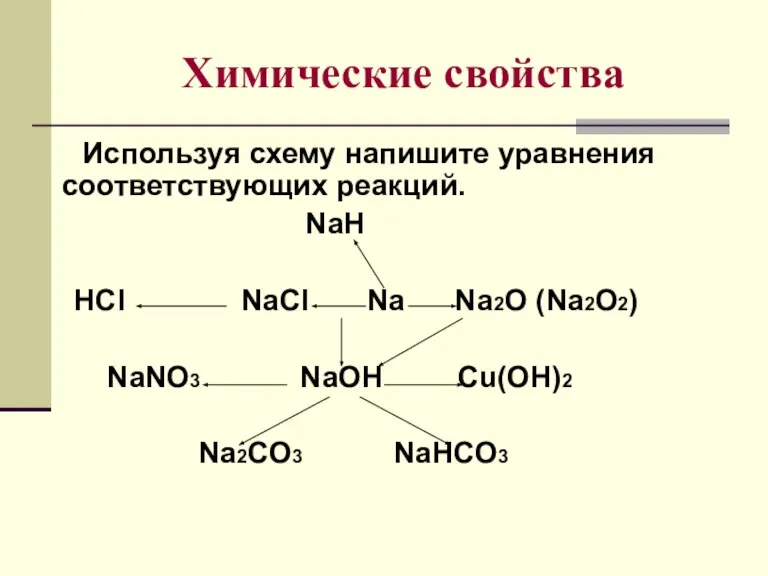
- 9. Химические свойства Используя схему напишите уравнения соответствующих реакций. NaH HCl NaCl Na Na2O (Na2O2) NaNO3 NaOH
- 10. Щелочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция
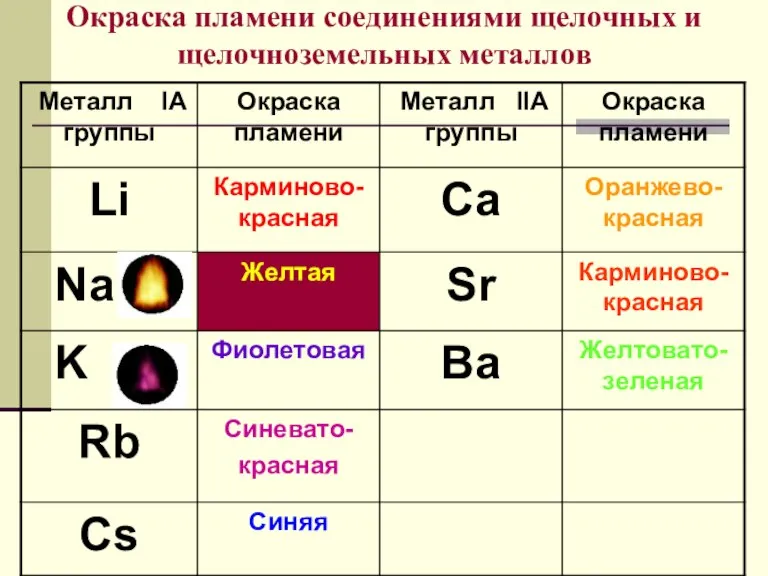
- 11. Окраска пламени соединениями щелочных и щелочноземельных металлов
- 12. Кальций –типичный представитель щелочноземельных металлов Дайте названия соединениям кальция: CaO Ca(OH)2 CaCO3 CaHCO3 Вспомните тривиальные названия
- 13. Жесткость воды
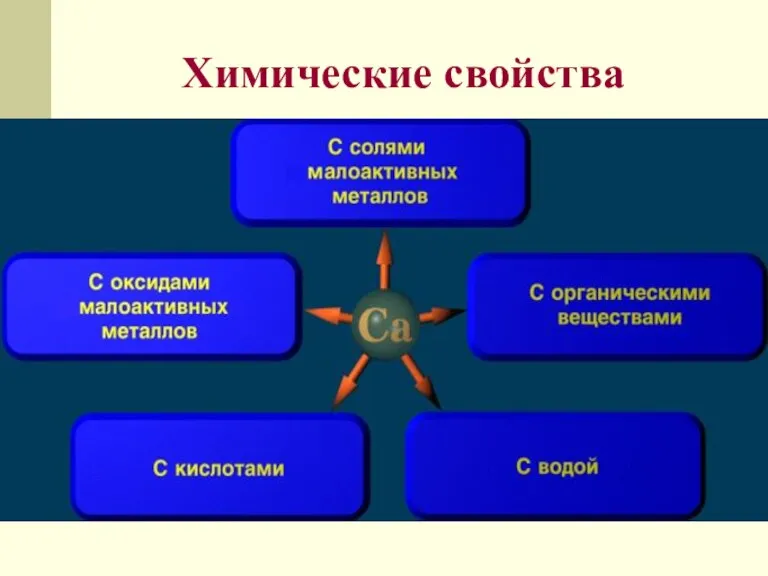
- 14. Химические свойства
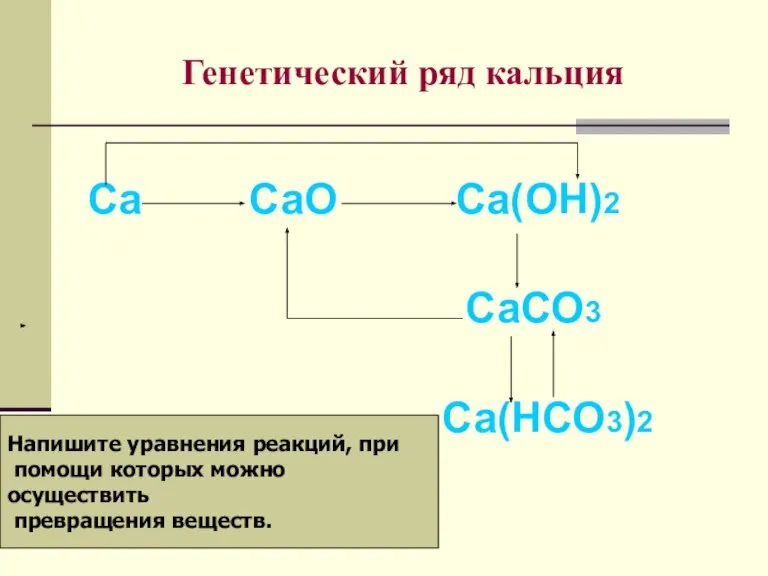
- 15. Генетический ряд кальция Са СаО Са(ОН)2 СаСО3 Са(НСО3)2 Напишите уравнения реакций, при помощи которых можно осуществить
- 16. Кальций в природе Кальциевые горные породы – известняк, мрамор, мел. Вспомните формулу этих горных пород. В
- 17. Мел, известняк, мрамор не растворяются в чистой воде, но растворимы в кислых растворах, даже таких слабых,
- 18. Как называются отложения, свисающие в виде гигантских сосулек со свода пещеры? А растущие навстречу им со
- 19. При воздействии кислотных дождей строения разрушаются. Какие реакции при этом происходят? Известняк и мрамор используют в
- 20. ? ? ? Каково значение щелочных и щелочно-земельных металлов в жизни человека? Как изменяются свойства оксидов
- 22. Скачать презентацию














 Здоровый образ жизни
Здоровый образ жизни Заглавная буква в словах
Заглавная буква в словах Упражнения
Упражнения Презентация на тему Спасатели МЧС России
Презентация на тему Спасатели МЧС России С Днём народного единства!
С Днём народного единства! "Долетим мы до самого солнца…"
"Долетим мы до самого солнца…" Духовная культура общества
Духовная культура общества Государственное управление в сфере обеспечения продовольственной безопасности в Российской Федерации
Государственное управление в сфере обеспечения продовольственной безопасности в Российской Федерации ВКР Электроснабжение СПК Жерелево Калужской области с применением на подстанции устройств телемеханики
ВКР Электроснабжение СПК Жерелево Калужской области с применением на подстанции устройств телемеханики ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ В ЛЕЧЕНИИ ОСТРОГО КОРОНАРНОГО СИНДРОМА БЕЗ ПОДЪЕМА СЕГМЕНТА ST
ОРАЛЬНЫЕ АНТИКОАГУЛЯНТЫ В ЛЕЧЕНИИ ОСТРОГО КОРОНАРНОГО СИНДРОМА БЕЗ ПОДЪЕМА СЕГМЕНТА ST Социальная организация
Социальная организация Выполнение стрелковых упражнений
Выполнение стрелковых упражнений Тема урока: «ПОРТРЕТЫ ВОДЫ»
Тема урока: «ПОРТРЕТЫ ВОДЫ» Роль семьи в формировании личности ребенка
Роль семьи в формировании личности ребенка Значение физической культуры и спорта в жизни человека
Значение физической культуры и спорта в жизни человека “Роботизированный автодром”
“Роботизированный автодром” Дружба юноша + девушка
Дружба юноша + девушка Зимующие птицы нашего посёлка
Зимующие птицы нашего посёлка МОУ Атемарская средняя общеобразовательная школа - обладатель Гранта Президента Российской Федерации
МОУ Атемарская средняя общеобразовательная школа - обладатель Гранта Президента Российской Федерации 20161217_naselenie_afriki_-_kopiya
20161217_naselenie_afriki_-_kopiya Нормативное регулирование и представление бухгалтерской отчётности
Нормативное регулирование и представление бухгалтерской отчётности Формы и методы работы с семьей и подростками «группы риска»
Формы и методы работы с семьей и подростками «группы риска» Литературное движение последекабристского времени
Литературное движение последекабристского времени Газопрессовая сварка
Газопрессовая сварка Станковая композиция. Семейные буди. Финальный этап
Станковая композиция. Семейные буди. Финальный этап Презентация на тему метод математической индукции
Презентация на тему метод математической индукции  Основные виды военной техники(танки и авиация), принимавшие участие в Курской битве ВОВ
Основные виды военной техники(танки и авиация), принимавшие участие в Курской битве ВОВ Силуэт как вид графического искусства
Силуэт как вид графического искусства