Содержание
- 2. Учебная литература Основная литература 1. Васильев В.П. Аналитическая химия: в 2 ч. /В.П. Васильев. М.: Высшая
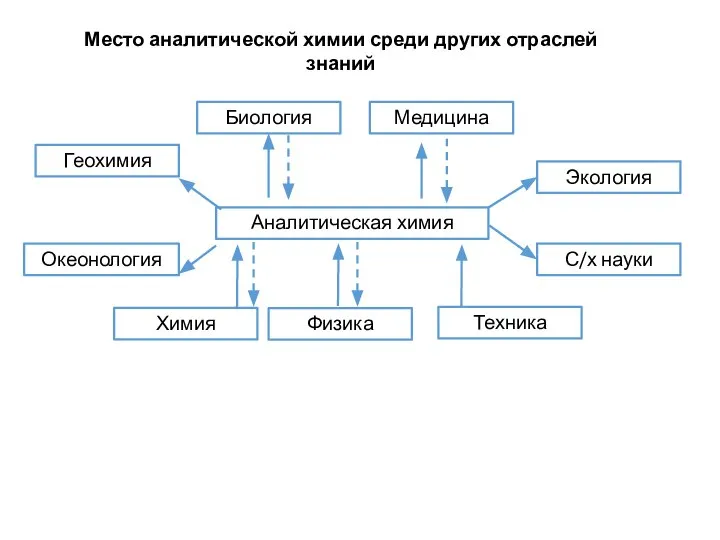
- 3. Аналитическая химия – это наука о методах определения химического состава вещества и его структуры. Предметом аналитической
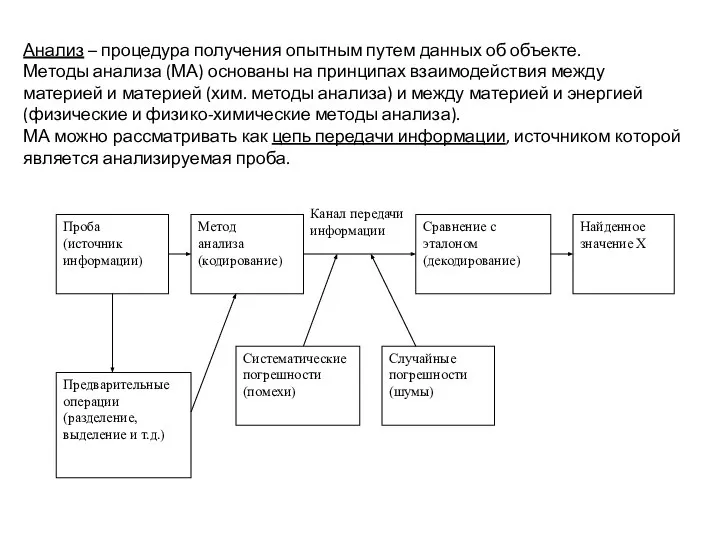
- 4. Анализ – процедура получения опытным путем данных об объекте. Методы анализа (МА) основаны на принципах взаимодействия
- 5. К МА предъявляются следующие требования: 1. Необходимая информация должна быть получена в возможно более короткий срок
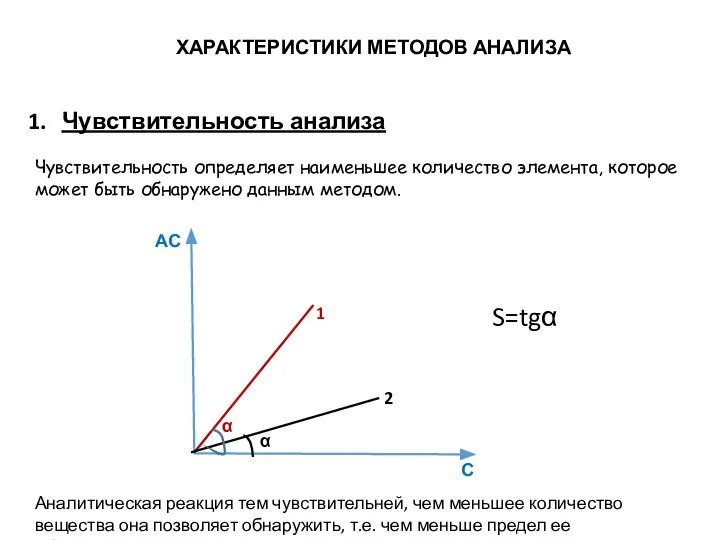
- 7. ХАРАКТЕРИСТИКИ МЕТОДОВ АНАЛИЗА Чувствительность анализа Чувствительность определяет наименьшее количество элемента, которое может быть обнаружено данным методом.
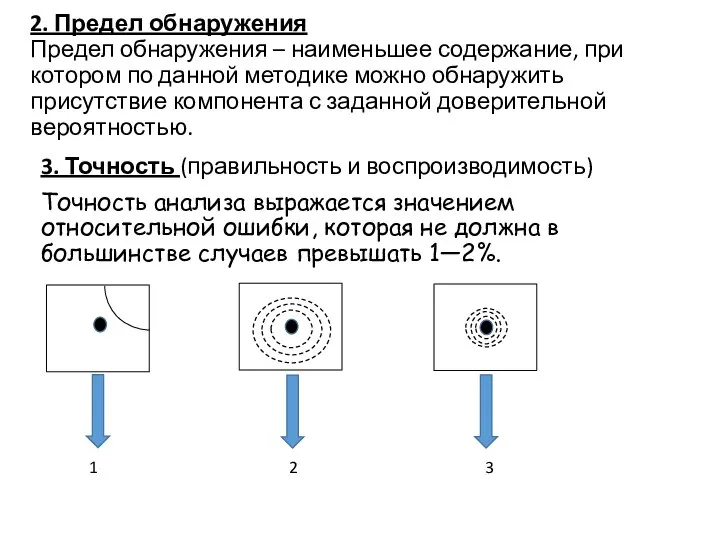
- 8. 2. Предел обнаружения Предел обнаружения – наименьшее содержание, при котором по данной методике можно обнаружить присутствие
- 9. 4. Избирательность (селективность) Специфичность характеризует возможность обнаружения искомого элемента в присутствии других элементов . Специфической реакцией
- 10. 5. Простота анализа 6. Возможность автоматизации 7. Стоимость Для повышения селективности применяют методы удаления мешающих ионов
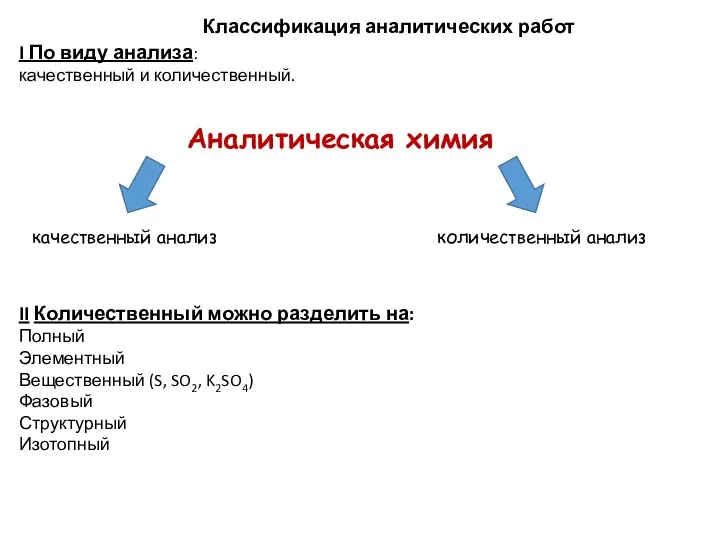
- 11. Классификация аналитических работ I По виду анализа: качественный и количественный. II Количественный можно разделить на: Полный
- 12. III По существу решаемой задачи: Валовый-локальный Деструктивный-недеструктивный Дискретный-непрерывный Контактный-дистанционный IV По цели направления различают Производственный контроль
- 13. Группы методов анализа химические методы анализа физико-химические методы анализа физические методы анализа, Биологические методы анализа Гибридные
- 14. ЭТАПЫ АНАЛИЗА 1. Отбор представительной средней пробы. 2. Подготовка пробы, перевод ее в форму удобную для
- 15. Подготовка пробы, перевод её в анализируемую форму MnO2+4HCl=MnCl2+Cl2+2Н2О Zn+2HCl=ZnCl2+H2 2Al+6HCl=2AlCl3+3H2 3Cu+8HNO3=2NO↑+3Cu(NO3)2+4Н2О 2Sb+6HCl+3Br2=2SbCl3+6HBr Au+НNO3+4HCl=HAuCl4+NO↑+2Н2О Al2O3+2NaOH=2NaAlO2+H2O
- 16. Отделение или маскирование мешающих компонентов осаждение комплексообразование экстракция ионообменная хроматография электрохимическое разделение. Наиболее приемлемый метод устанавливается
- 17. ВЫЧИСЛЕНИЕ И ОБРАБОТКА РЕЗУЛЬТАТОВ АНАЛИЗА − систематические, наличие и величина которых характеризует правильность метода анализа, а
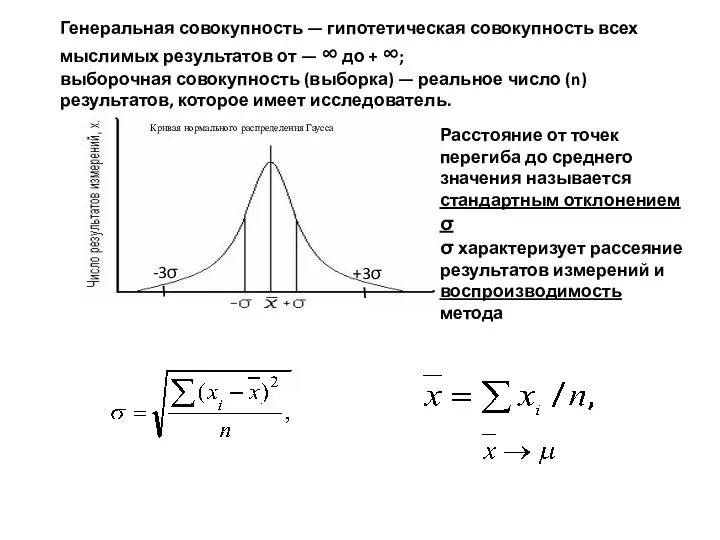
- 18. -3σ +3σ Генеральная совокупность — гипотетическая совокупность всех мыслимых результатов от — ∞ до + ∞;
- 19. Воспроизводимость определяет вероятность того, что результаты последующих измерений окажутся в некотором заданном интервале, в центре которого
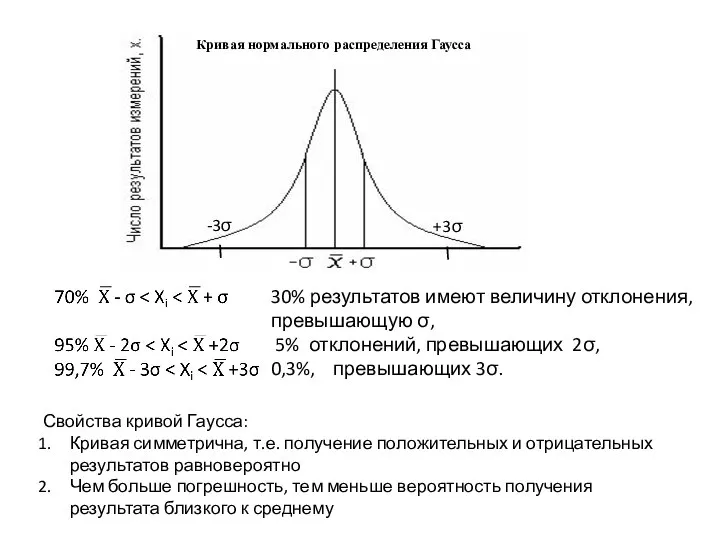
- 20. 30% результатов имеют величину отклонения, превышающую σ, 5% отклонений, превышающих 2σ, 0,3%, превышающих 3σ. Свойства кривой
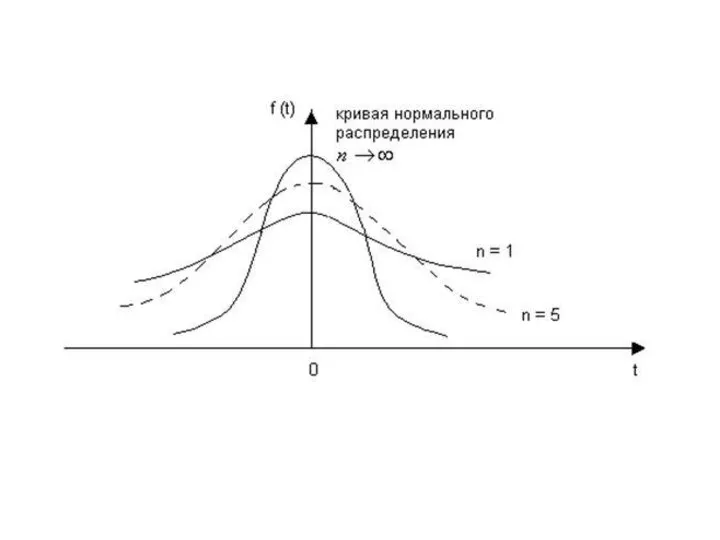
- 21. Закон нормального распределения для обработки результатов химического анализа применяют только в том случае, если имеется большое
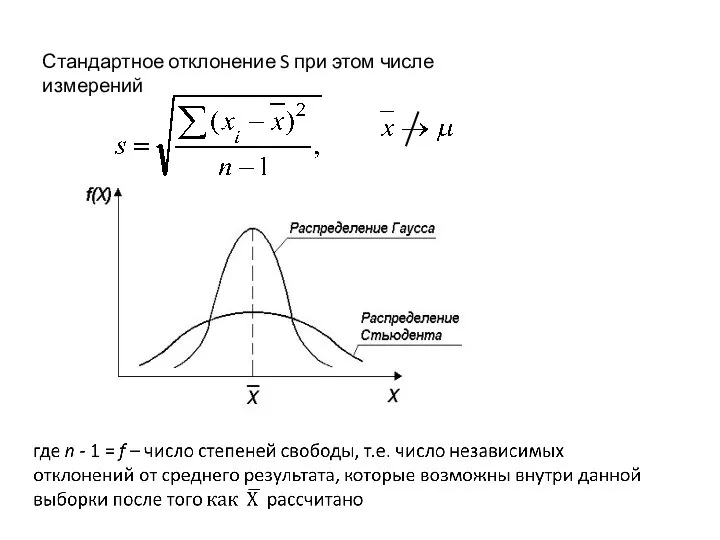
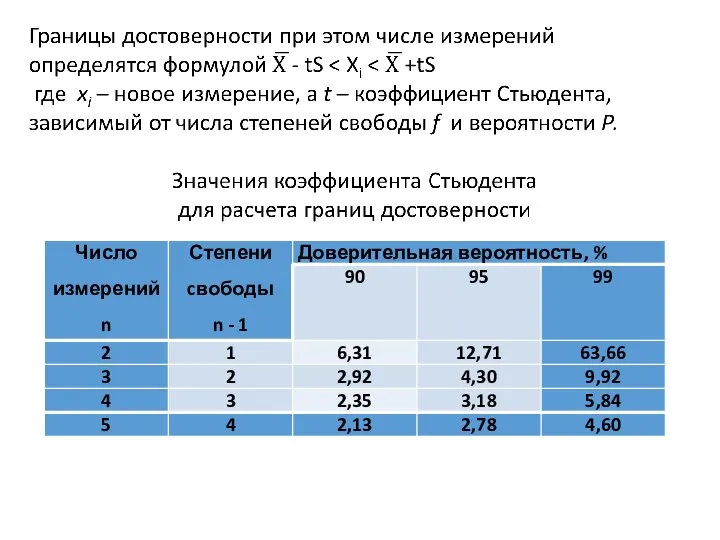
- 22. Стандартное отклонение S при этом числе измерений
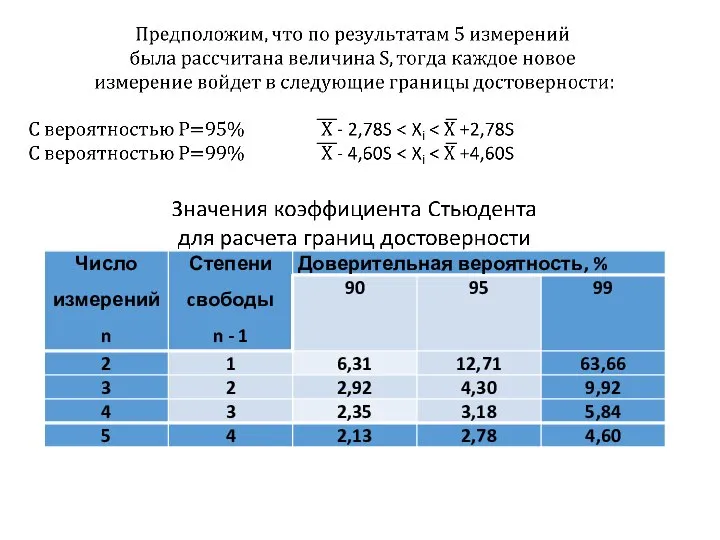
- 26. Оценка правильности Фишера (1925г) – Ноймана (1945) Стандартное отклонение средней величины Доверительный интервал - это интервал
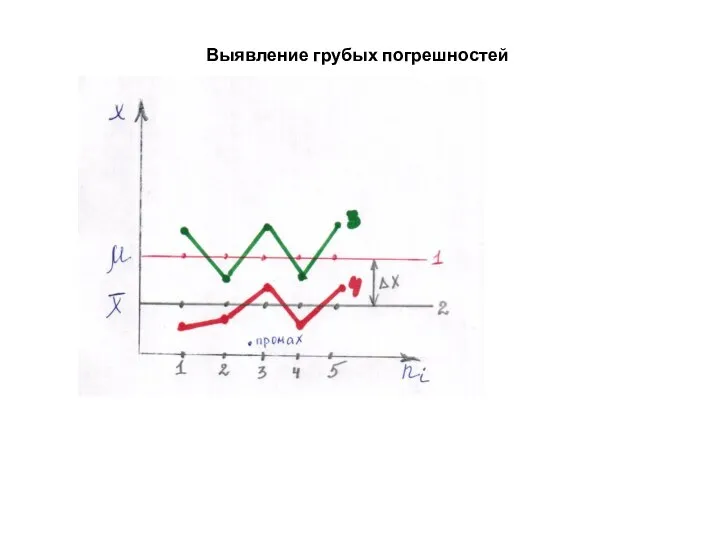
- 27. Выявление грубых погрешностей
- 28. Значения Q-критерия для выявления грубых погрешностей анализа Пример. Четыре параллельных анализа образца железной руды дали следующие
- 29. Сравнение экспериментально найденного среднего с истинным значением (нуль-гипотеза) Пример. Для проверки титриметрического метода определения Са в
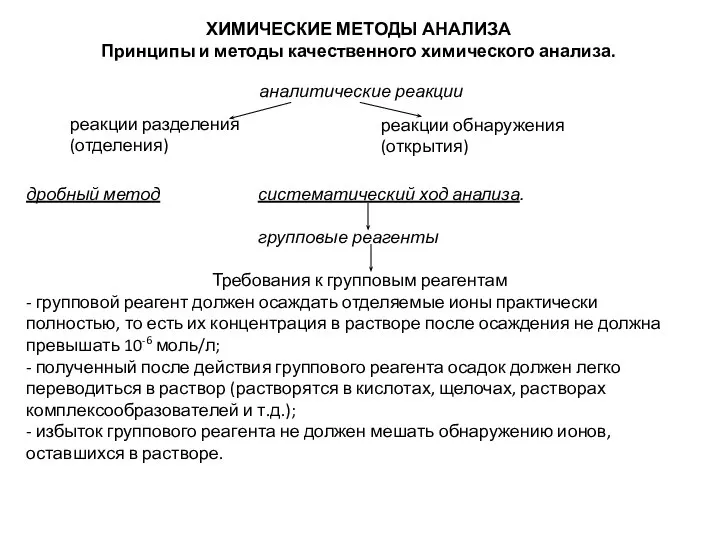
- 30. дробный метод систематический ход анализа. групповые реагенты Требования к групповым реагентам - групповой реагент должен осаждать
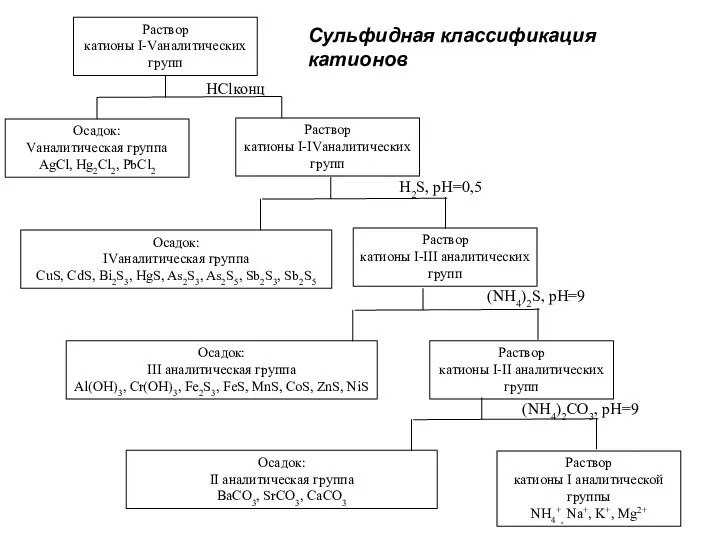
- 31. Сульфидная классификация катионов
- 32. Основные принципы количественных определений в химических методах анализа. X + R = P, X – определяемый
- 33. СА – общая аналитическая концентрация компонента А, общее содержание компонента. [А] - равновесная концентрация, т.е. концентрация
- 34. [А] = αА СА αА – молярная доля, которая характеризует глубину протекания конкурирующих реакций, 0 Если
- 35. материальный баланс при ступенчатом копмлексообразовании, например, Fe3+ и избыток NaF CFe = [Fe3+] + [FeF2+] +
- 36. Активность aА=f[А] (f – коэффициент активности) В идеальной системе aА = [А] = СА. Энергия взаимодействия
- 37. Химическое равновесие в гомогенных системах. аА + вВ ↔ сС + dD. Закон действующих масс в
- 38. КT = f (Т, Р, растворитель) При К>1 реакция протекает в прямом направлении При К Значение
- 39. f(Т, Р, j) f(Т, Р, j, α) lg Ky =lg Kc - ∑νi lg αi =
- 41. Пример. Вычислить константу равновесия для реакции Ca(OH)2(тв) = Сa2+ + 2OH- при 25 ºС. ∆Gº =
- 43. Пример. Определить влияние ионной силы на две константы диссоциации двухосновной кислоты Н2А. Н2А ↔ Н+ +
- 44. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
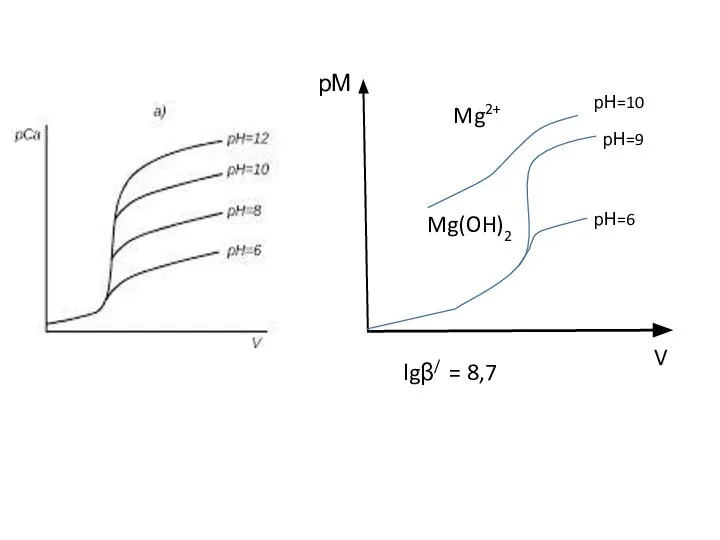
- 45. Пример. При смешении раствора BaCl2 c концентрацией [Ва2+] = 10-5 моль/л и раствора H2SO4 c концентрацией
- 46. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ И РАСТВОРИМОСТЬ
- 47. ВаСО3↓+ Na2SO4 ↔ ВаSO4↓+ Na2СО3 ? К = [СО32-] / [SO42-]. К = [Ba2+][CO32-] / [Ba2+][SO42-]
- 48. КОМПЛЕКСООБРАЗОВАНИЕ И РАСТВОРИМОСТЬ AgCl↓+ 2NH3 = [Ag(NH3)2]+ + Cl- ПР(AgCł) = 1,78∙10-10 , константа нестойкости комплексного
- 50. Гравиметрический анализ (ГМА) 2 FeCl3 2 Fe (OH)3 Fe2O3 Где m – масса пробы в г.
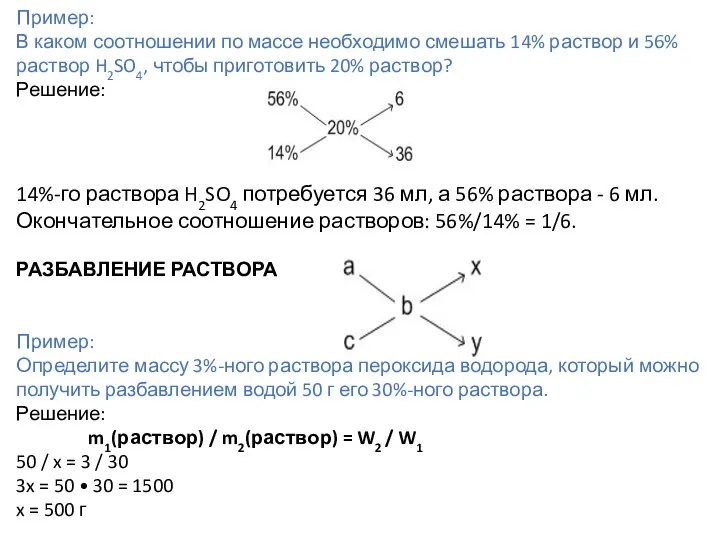
- 53. СМЕШИВАНИЕ РАСТВОРОВ С РАЗНЫМИ КОНЦЕНТРАЦИЯМИ Пример: Определите концентрацию раствора, полученного при сливании 150 г 30%-го и
- 54. Пример: В каком соотношении по массе необходимо смешать 14% раствор и 56% раствор H2SO4, чтобы приготовить
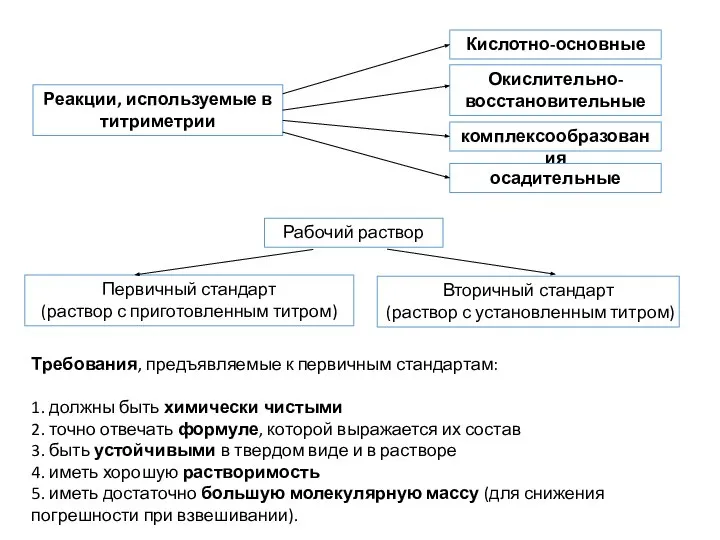
- 55. Титриметрический анализ (объемный) (ТМА) Титрование – процесс медленного приливания реагента в титруемый раствор. Момент окончания титрования
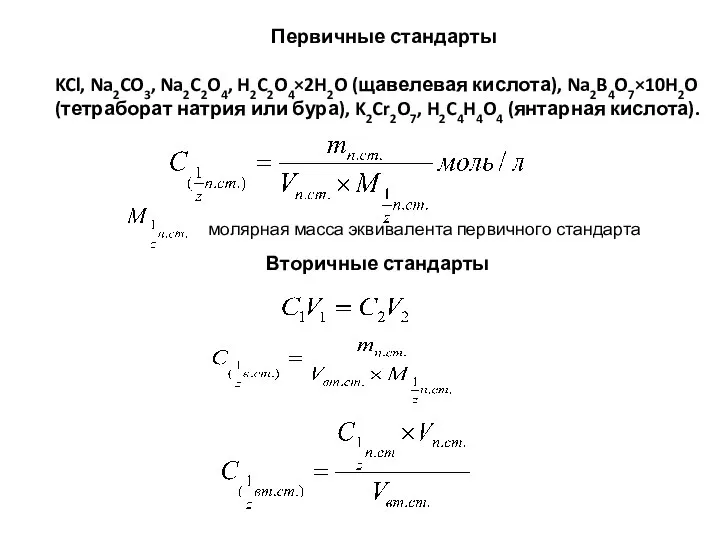
- 56. Требования, предъявляемые к первичным стандартам: 1. должны быть химически чистыми 2. точно отвечать формуле, которой выражается
- 57. Первичные стандарты KCl, Na2CO3, Na2C2O4, H2C2O4×2H2O (щавелевая кислота), Na2B4O7×10H2O (тетраборат натрия или бура), K2Cr2O7, H2C4H4O4 (янтарная
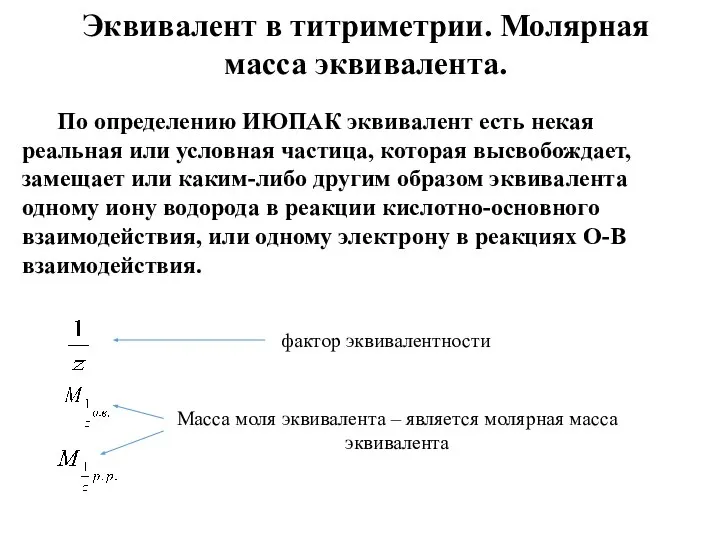
- 58. Эквивалент в титриметрии. Молярная масса эквивалента. По определению ИЮПАК эквивалент есть некая реальная или условная частица,
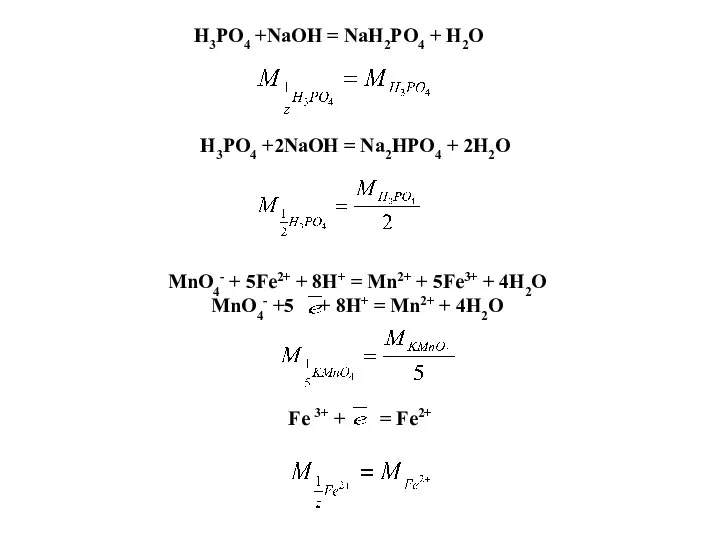
- 59. H3PO4 +NaOH = NaH2PO4 + H2O H3PO4 +2NaOH = Na2HPO4 + 2H2O
- 60. Способы титрования и вычисления результатов титриметрических определений. Прямое титрование. В этом случае анализируемый раствор непосредственно титруется
- 61. Вычисления концентрации Прямое титрование Обратное титрование титр Титр рабочего раствора по определяемому веществу
- 62. Задача 1. Навеску Na2CО3 массой 1,1г, содержащую примесь NaCl растворили и оттитровали раствором H2S04 концентрации 0,5н.
- 63. Задача 3. 3 л городского воздуха пропустили через 50 мл 0,01166н раствора гидроксида бария (Ba(OH)2). Остаток
- 64. При количественном анализе, чтобы получить приемлемые результаты, равновесие реакции должно быть максимально сдвинуто в правую сторону,
- 65. Кислотно-основное титрование Применяется для определения кислот, оснований и их солей, подвергающихся гидролизу с образованием Н+ или
- 66. КИСЛОТНО-ОСНОВНОЕ РАВНОВЕСИЕ Теория Аррениуса (1887 г.) Кислоты - нейтральные вещества, которые в водном растворе диссоциируют с
- 67. Теория Льюиса (1923 г.) - на основе электронных представлений было расширено понятие кислоты и основания. Кислота
- 68. Протолитическая теория Бренстеда-Лоури (1923). Кислоты − соединения или ионы, способные отдавать протоны. Основания – соединения или
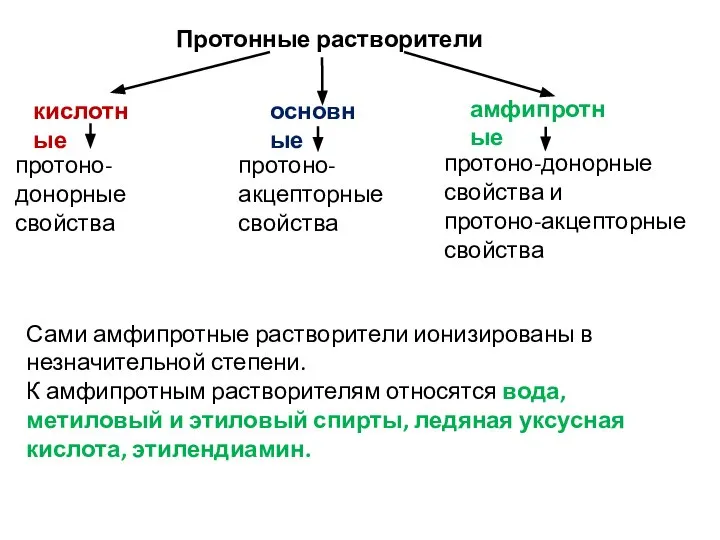
- 69. Классификация растворителей по донорно-акцепторным свойствам по отношению к протону. По протоно-донорно-акцепторным свойствам выделяют протонные и апротонные
- 70. Протонные растворители Сами амфипротные растворители ионизированы в незначительной степени. К амфипротным растворителям относятся вода, метиловый и
- 71. Степень ионизации растворителя характеризуют константой автопротолиза для воды при 250C КW = [H+][OH-] = 10−14. КW
- 72. , B + H2O → HB++OH−
- 78. Пример. В каком соотношении следует смешать НАс и NaAc, чтобы получить буферный раствор с рН =
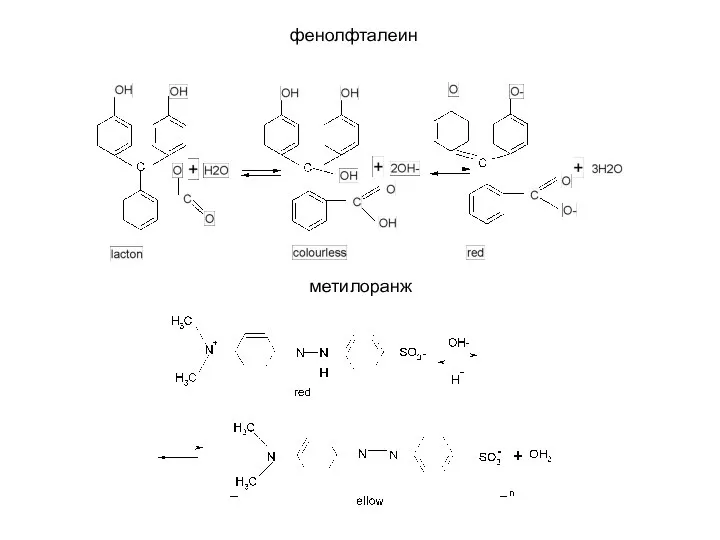
- 82. Индикаторы в кислотно-основном титровании В качестве индикаторов в кислотно-основном титровании используются слабые органические кислоты и основания,
- 83. фенолфталеин метилоранж
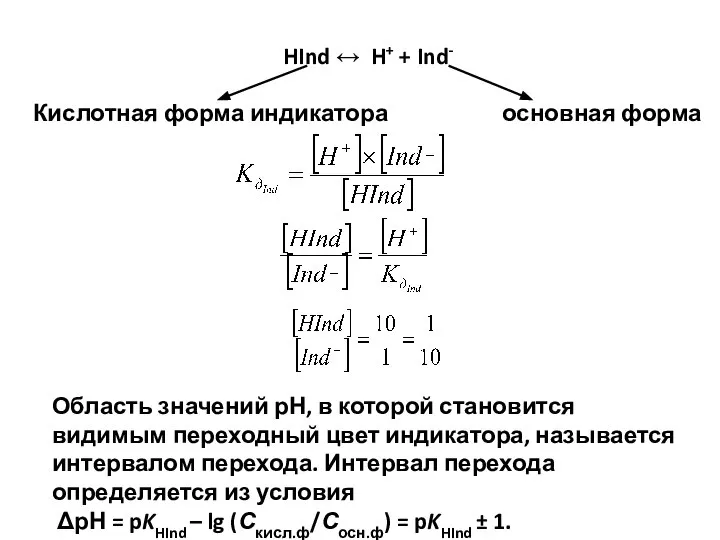
- 84. HInd ↔ H+ + Ind- Кислотная форма индикатора основная форма Область значений рН, в которой становится
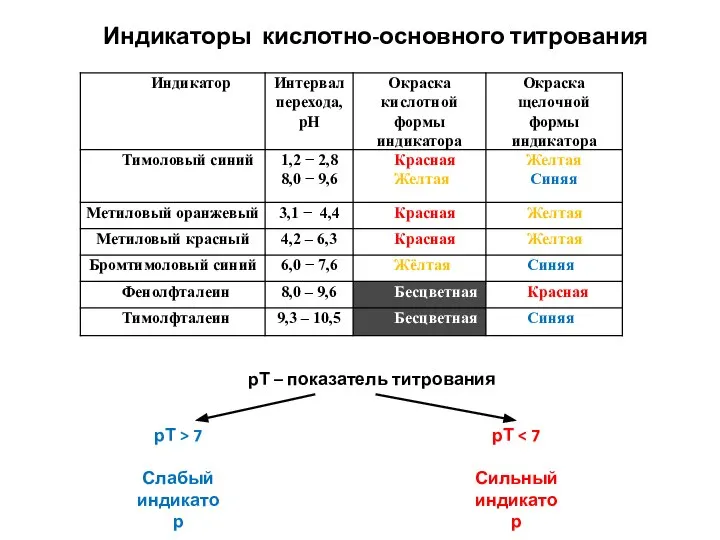
- 85. Индикаторы кислотно-основного титрования рТ – показатель титрования рТ > 7 Слабый индикатор рТ Сильный индикатор
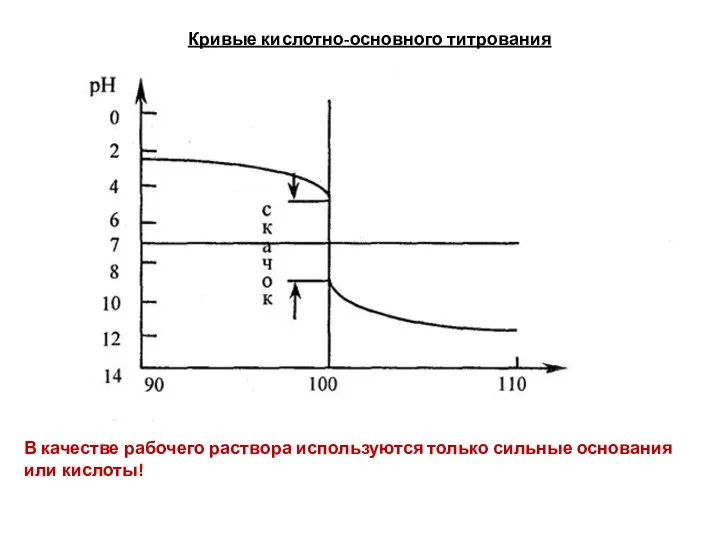
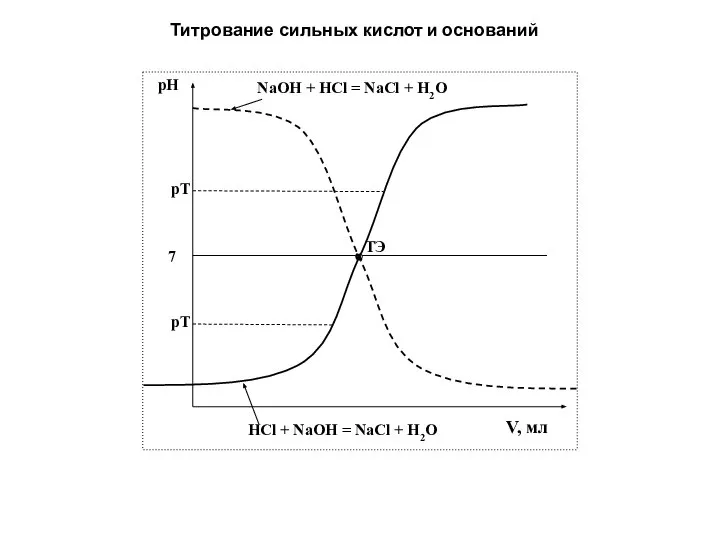
- 86. Кривые кислотно-основного титрования В качестве рабочего раствора используются только сильные основания или кислоты!
- 87. Титрование сильных кислот и оснований
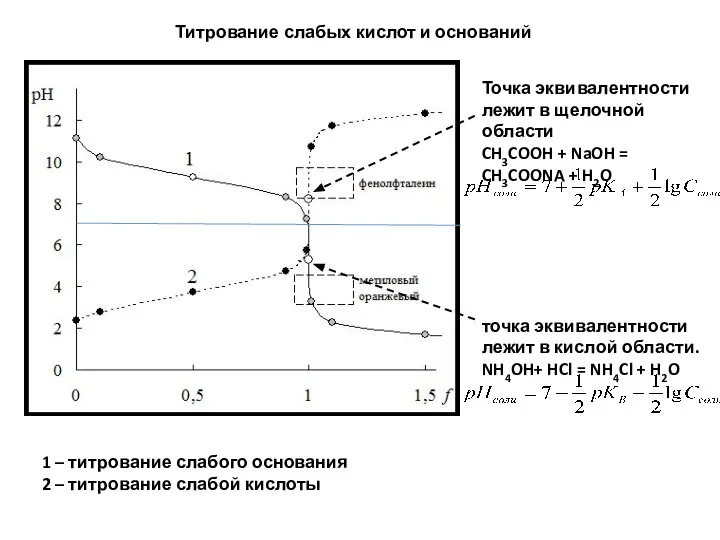
- 88. Титрование слабых кислот и оснований 1 – титрование слабого основания 2 – титрование слабой кислоты Точка
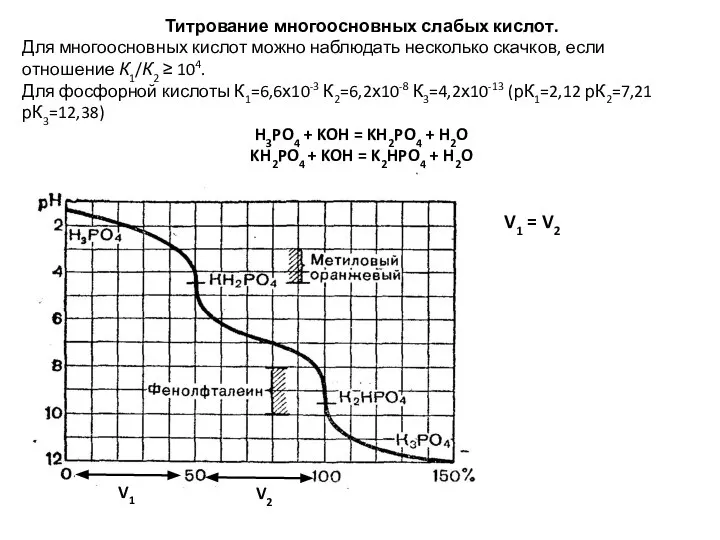
- 89. Титрование многоосновных слабых кислот. Для многоосновных кислот можно наблюдать несколько скачков, если отношение К1/К2 ≥ 104.
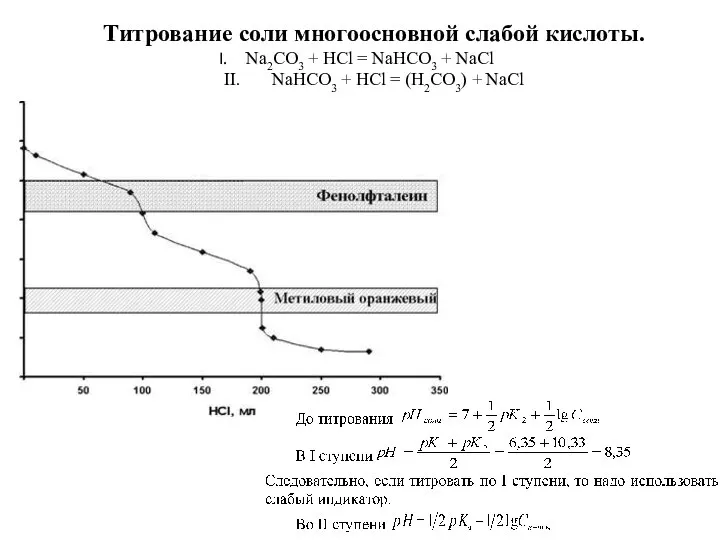
- 91. Титрование соли многоосновной слабой кислоты. Na2CO3 + HCl = NaHCO3 + NaCl II. NaHCO3 + HCl
- 92. Смесь сильной и слабой кислот. Если отношение констант ионизации кислот составляет 104 и более, то возможно
- 93. Условия выбора индикатора близость значений показателя титрования индикатора и рН точки эквивалентности интервал перехода индикатора должен
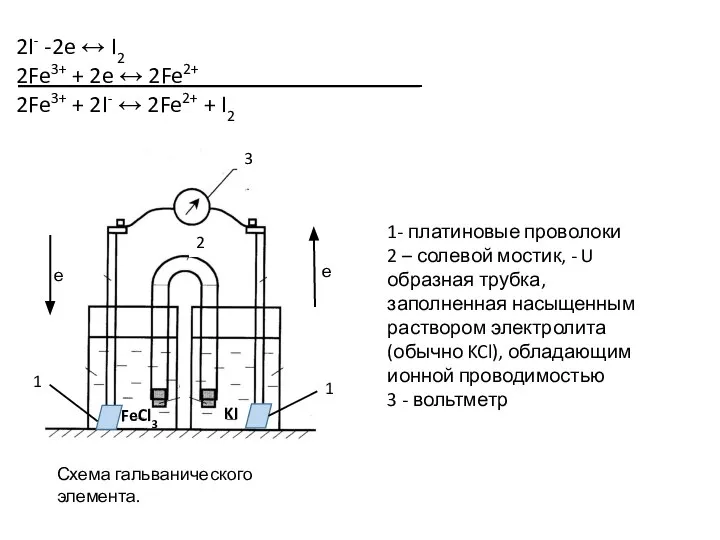
- 95. 2I- -2e ↔ I2 2Fe3+ + 2e ↔ 2Fe2+ 2Fe3+ + 2I- ↔ 2Fe2+ + I2
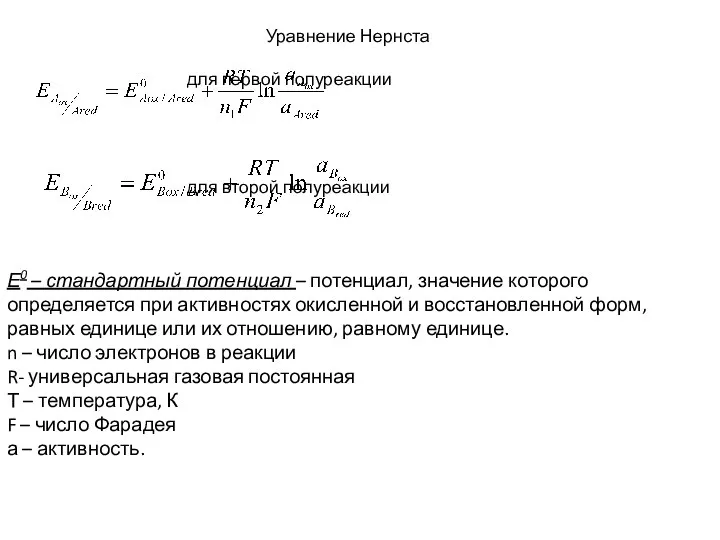
- 97. Уравнение Нернста для первой полуреакции для второй полуреакции Е0 – стандартный потенциал – потенциал, значение которого
- 98. При н.у., т.е. Т=250С и Р=1 атм уравнение Нернста имеет вид: Аналогично для второй полуреакции: В
- 101. КОНСТАНТА РАВНОВЕСИЯ РЕДОКС-РЕАКЦИИ И ЕЕ ОПРЕДЕЛЕНИЕ Окислительно-восстановительный (электродный) потенциал сопряженной редокс-пары определяет ее возможность проявлять свои
- 102. В практике аналитической химии используются реакции, которые, как правило, идут не менее, чем на 99,9% константа
- 104. E(Ag+,Ag) = 0,799+ 0,059lg a(Ag+)
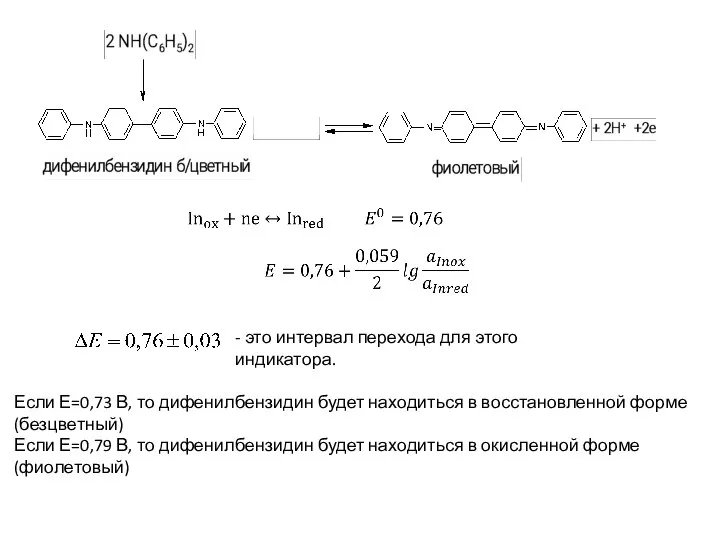
- 109. - это интервал перехода для этого индикатора. Если Е=0,73 В, то дифенилбензидин будет находиться в восстановленной
- 110. КРИВЫЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ. Титрование железа церием Fe2+ + Ce4+ ↔ Fe3+ + Ce3+ Fe3+ +e ↔
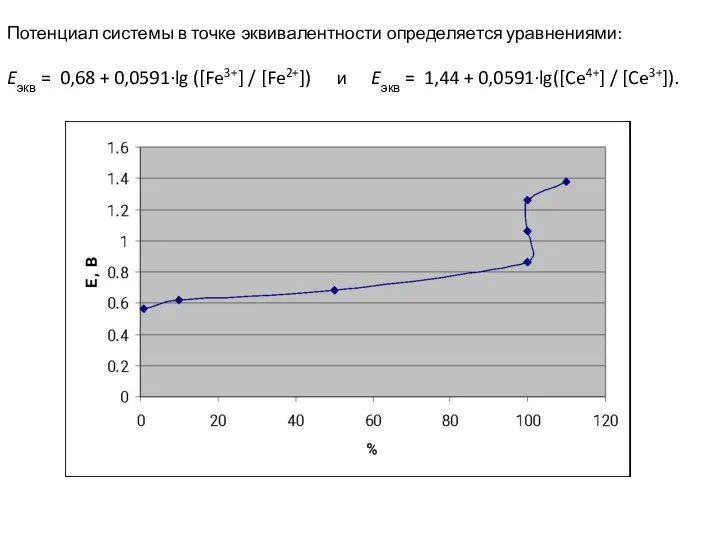
- 111. Потенциал системы в точке эквивалентности определяется уравнениями: Eэкв = 0,68 + 0,059∙lg ([Fe3+] / [Fe2+]) Eэкв
- 112. Потенциал системы в точке эквивалентности определяется уравнениями: Eэкв = 0,68 + 0,0591∙lg ([Fe3+] / [Fe2+]) и
- 113. В случае более сложной реакции титрования, например 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+
- 114. E0=1,51 В
- 115. Стандартизация: применяются оксалат натрия и другие восстановители: 2МnО4-+ 5С2042- + 16Н+ ↔ 2Мn2+ + 10С02 +
- 116. Дихроматометрия Титрант: K2Cr2O7 – первичный стандартный раствор (готовится по точной навеске); Реакция метода: Cr2O72- +6е +
- 117. Стандартные потенциалы многих восстановителей меньше E0J-/J2, а многих окислителей — выше, поэтому система служит для определения
- 120. БРОМАТОМЕТРИЯ Титрант: KBrO3 – первичный стандартный раствор, устойчив во времени Стандартизация: йодометрическая KBrO3 + 6KI +
- 121. Комплексометрия (КМТ) Mz+ + :L = MLz+ Лиганды: галогенид-ион, гидроксил-ион, азотистые основания (аммиак, пиридин), органические соединения,
- 122. Меркуриметрия Для определения анионов Метод основан на образовании комплексов ионов ртути с Cl-, Br-, CNS- и
- 123. ТЕРМОДИНАМИЧЕСКАЯ УСТОЙЧИВОСТЬ M + L = ML Ступенчатые Суммарные ML + L = ML2 M +
- 124. , где
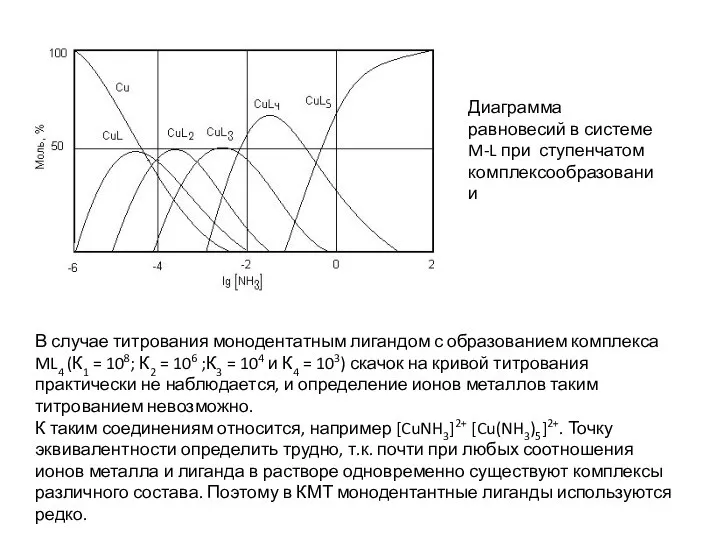
- 125. В случае титрования монодентатным лигандом с образованием комплекса ML4 (К1 = 108; К2 = 106 ;К3
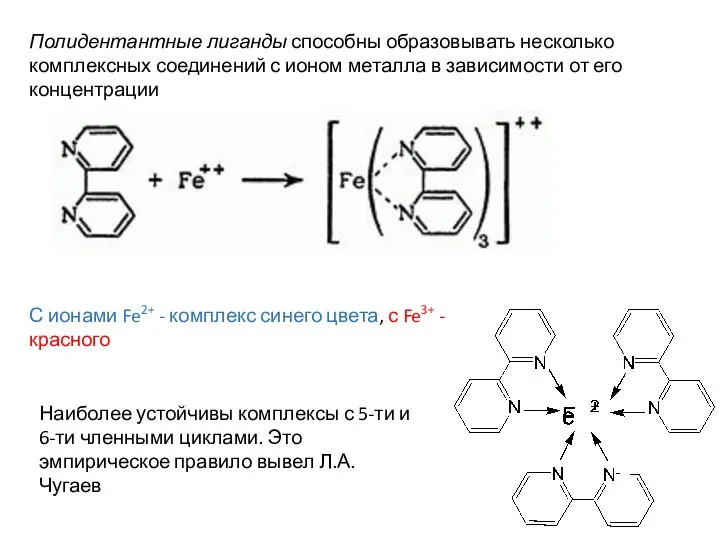
- 126. С ионами Fe2+ - комплекс синего цвета, с Fe3+ - красного Наиболее устойчивы комплексы с 5-ти
- 127. Комплексонометрия Комплексоны (полидентатные органические реагенты). Г. Шварценбах с сотр. (1945). Комплексоны по Г. Шварценбаху группа полиаминополиуксусных
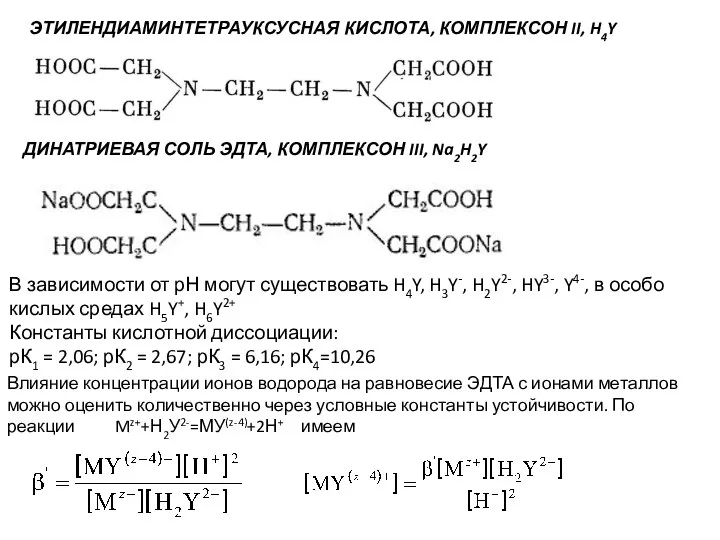
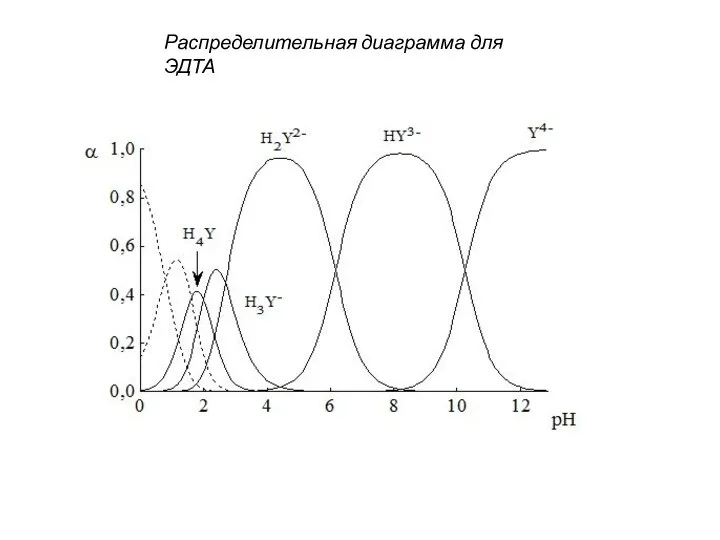
- 128. ЭТИЛЕНДИАМИНТЕТРАУКСУСНАЯ КИСЛОТА, КОМПЛЕКСОН II, H4Y ДИНАТРИЕВАЯ СОЛЬ ЭДТА, КОМПЛЕКСОН III, Na2H2Y В зависимости от рН могут
- 129. Cэдта=[Y4-] + [HY3-] + [H2Y2-] + [H3Y-] + [H4Y] НУ3- ↔ Н+ + У4-, K4 =
- 130. Или
- 131. Распределительная диаграмма для ЭДТА
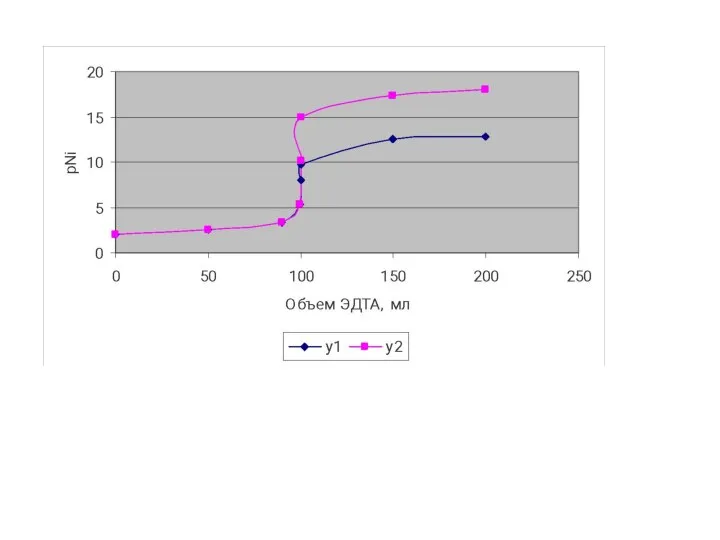
- 133. КРИВЫЕ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
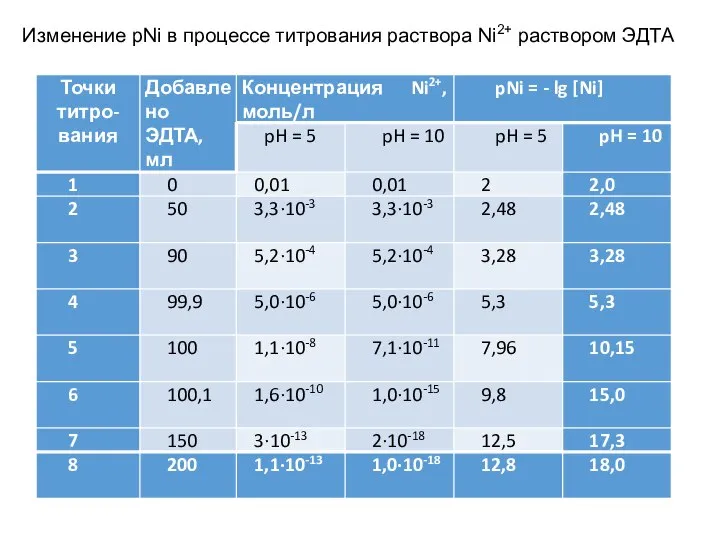
- 134. Изменение pNi в процессе титрования раствора Ni2+ раствором ЭДТА
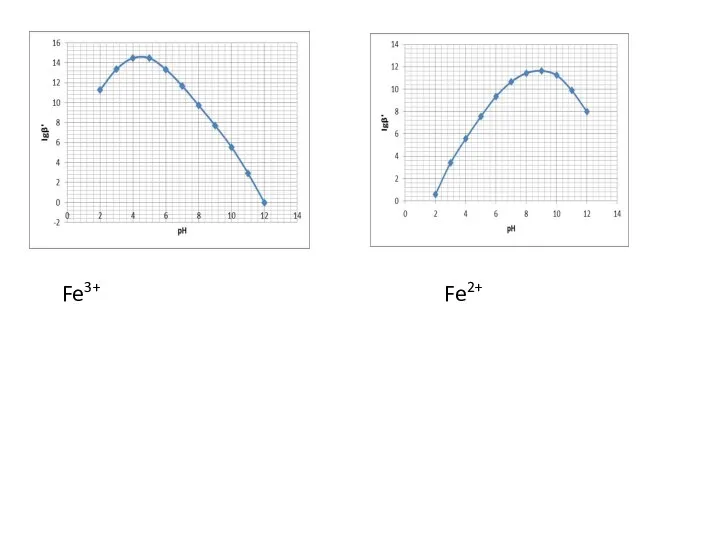
- 136. Fe3+ Fe2+
- 138. ИНДИКАТОРЫ КОМПЛЕКСОНОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- 139. СПОСОБЫ ПОВЫШЕНИЯ СЕЛЕКТИВНОСТИ Регулирование кислотности среды Использование маскирующих веществ: CN- (Mg, Cu), S2O32- (Zn, Cu), F-
- 140. Методы осадительного титрования Осадительное титрование основано на реакциях образования осадков малорастворимых соединений. Для этого пригодны только
- 142. Метод Мора. Сущность его состоит в прямом титровании галогенид-ионов раствором нитрата серебра с индикатором хроматом калия
- 143. Практические аспекты титриметрических методов анализа 1) метод пипетирования – навеску определяемого или стандартного вещества растворяют в
- 145. Скачать презентацию

















![СА – общая аналитическая концентрация компонента А, общее содержание компонента. [А] -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-32.jpg)
![[А] = αА СА αА – молярная доля, которая характеризует глубину протекания](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-33.jpg)

![Активность aА=f[А] (f – коэффициент активности) В идеальной системе aА = [А]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-35.jpg)








![Пример. При смешении раствора BaCl2 c концентрацией [Ва2+] = 10-5 моль/л и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-44.jpg)

![ВаСО3↓+ Na2SO4 ↔ ВаSO4↓+ Na2СО3 ? К = [СО32-] / [SO42-]. К](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-46.jpg)
![КОМПЛЕКСООБРАЗОВАНИЕ И РАСТВОРИМОСТЬ AgCl↓+ 2NH3 = [Ag(NH3)2]+ + Cl- ПР(AgCł) = 1,78∙10-10](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-47.jpg)



























































![Cэдта=[Y4-] + [HY3-] + [H2Y2-] + [H3Y-] + [H4Y] НУ3- ↔ Н+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1176005/slide-128.jpg)
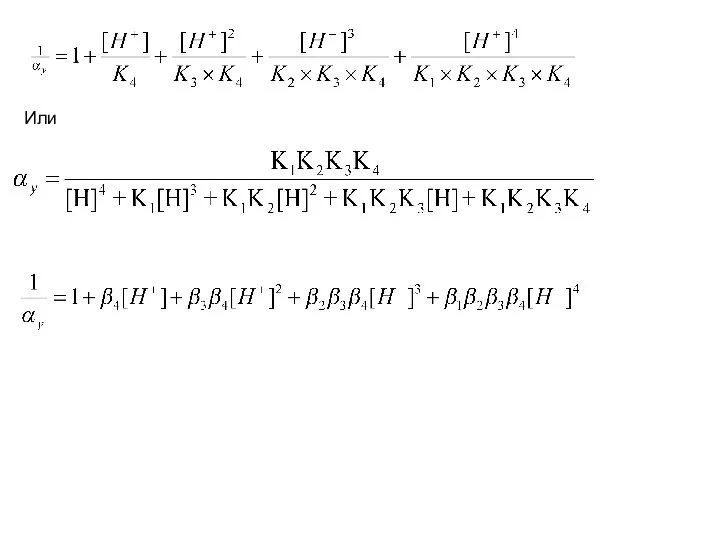








 совместно с Театром праздника «Солнечный зайчик»
совместно с Театром праздника «Солнечный зайчик» ЧАС ЗАНИМАТЕЛЬНОЙ БИОЛОГИИ 7 класс
ЧАС ЗАНИМАТЕЛЬНОЙ БИОЛОГИИ 7 класс Презентация на тему Врожденные и приобретенные программы поведения
Презентация на тему Врожденные и приобретенные программы поведения Презентация
Презентация ПРОЕКТНАЯ РАБОТА
ПРОЕКТНАЯ РАБОТА к.э.н. директор Бизнес- инкубатора, заместитель проректора по инновационной деятельности УрФУ Пиличев Валерий Валерьевич
к.э.н. директор Бизнес- инкубатора, заместитель проректора по инновационной деятельности УрФУ Пиличев Валерий Валерьевич Культура Руси в 10 – 13 веках
Культура Руси в 10 – 13 веках Болгария в 20-30-е годы
Болгария в 20-30-е годы Доказательная медицина и доказательная педагогика. Взгляд врача и исследователя
Доказательная медицина и доказательная педагогика. Взгляд врача и исследователя Приготовление завтрака
Приготовление завтрака «Инвестиционная политика муниципального образования на современном этапе»02.02.2012
«Инвестиционная политика муниципального образования на современном этапе»02.02.2012 Работа академии по направлению научно-технического творчества молодежи
Работа академии по направлению научно-технического творчества молодежи «Трудные» дети и их проблемы.
«Трудные» дети и их проблемы. Приемы расположения к себе. Самопрезентация
Приемы расположения к себе. Самопрезентация Автохимия. Завод автохимии
Автохимия. Завод автохимии Об итогах выполнения задач в ЗПО 2017 учебного года и постановка задач на ЛПО 2017 учебного года
Об итогах выполнения задач в ЗПО 2017 учебного года и постановка задач на ЛПО 2017 учебного года Евангелие от Матфея
Евангелие от Матфея Нарушения требований Федерального закона от 20.07.2012 № 125-ФЗ О донорстве крови и ее компонентов
Нарушения требований Федерального закона от 20.07.2012 № 125-ФЗ О донорстве крови и ее компонентов Аварийная аптечка для первой медицинской помощи
Аварийная аптечка для первой медицинской помощи Власть. Сила. Лекция 2
Власть. Сила. Лекция 2 Вітражі та шпроси
Вітражі та шпроси Моя будущая профессия - бухгалтер
Моя будущая профессия - бухгалтер Олимпиада үрләренә - баскычлап
Олимпиада үрләренә - баскычлап Общероссийские антидопинговые правила
Общероссийские антидопинговые правила Проектирование транспортно-грузовых комплексов
Проектирование транспортно-грузовых комплексов Определение размеров молекул октана
Определение размеров молекул октана Такси Лось
Такси Лось Обжалование результатов налоговой проверки
Обжалование результатов налоговой проверки