Содержание
- 2. Электрический пробой плоских фосфолипидных мембран (БЛМ)
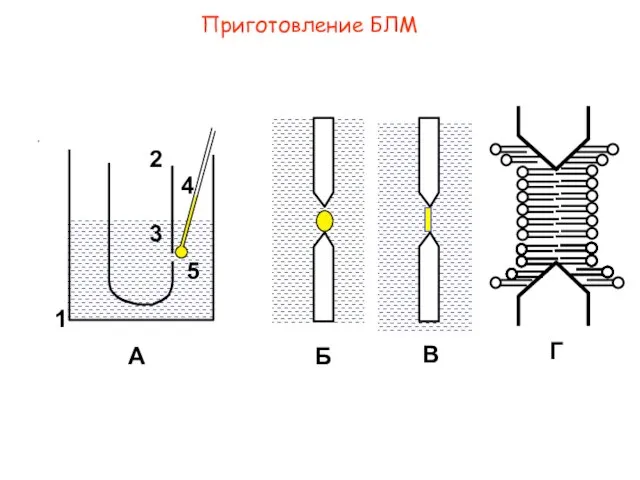
- 3. Приготовление БЛМ А В Г 1 5 4 3 2 Б
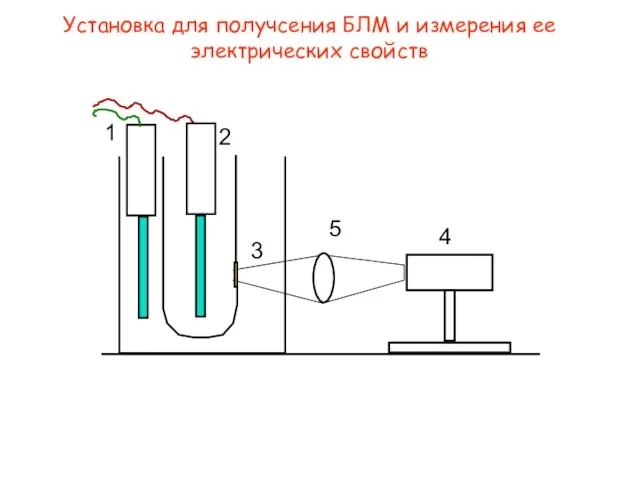
- 4. Установка для получсения БЛМ и измерения ее электрических свойств
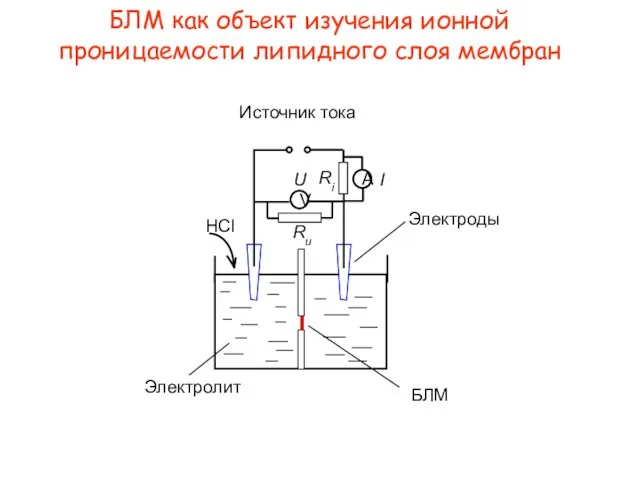
- 5. БЛМ как объект изучения ионной проницаемости липидного слоя мембран
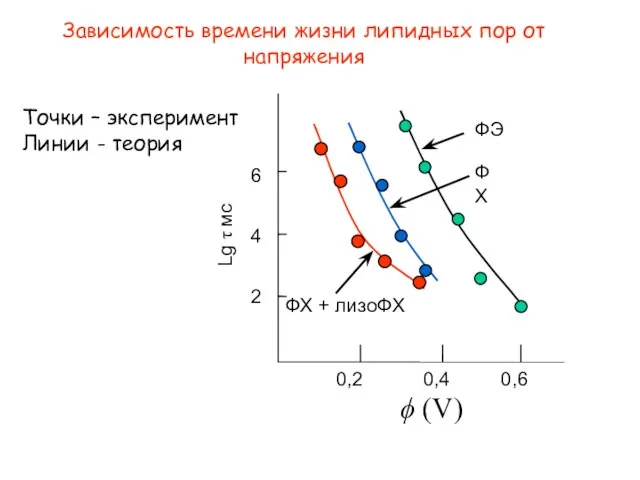
- 6. Зависимость времени жизни липидных пор от напряжения ϕ (V) 6 4 2 0,2 0,4 0,6 ФХ
- 7. Пробой БЛМ при действии постоянного электрического поля
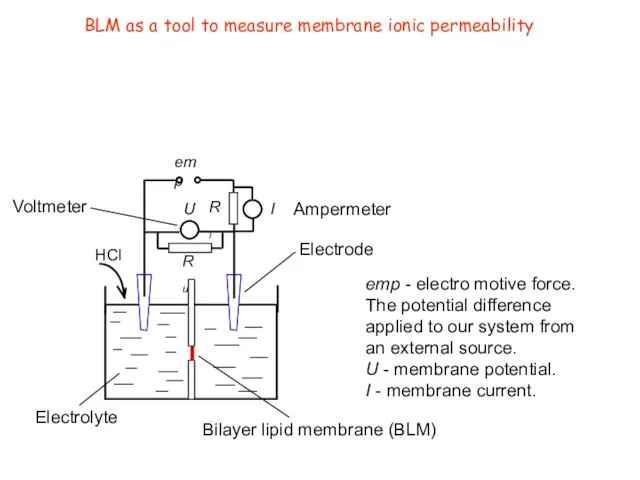
- 8. BLM as a tool to measure membrane ionic permeability HCl U I emp Ri Ru emp
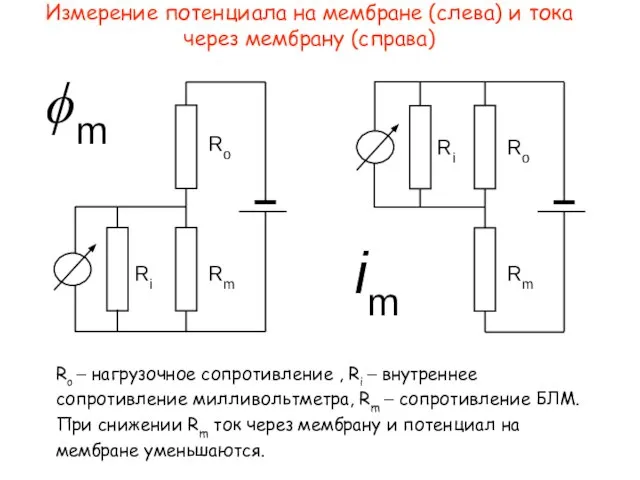
- 9. Измерение потенциала на мембране (слева) и тока через мембрану (справа) Ro – нагрузочное сопротивление , Ri
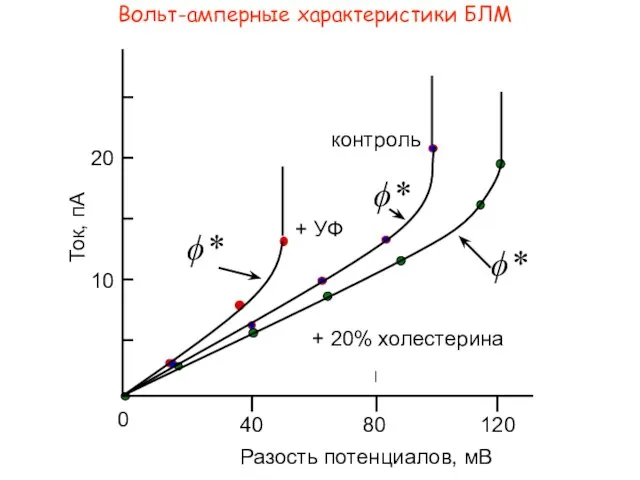
- 10. Вольт-амперные характеристики БЛМ
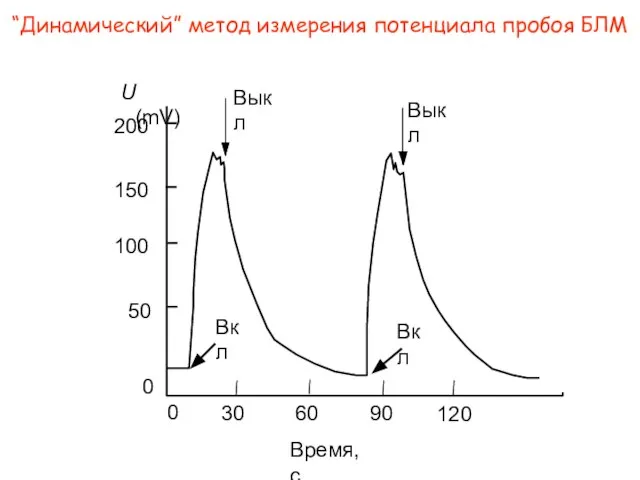
- 11. “Динамический” метод измерения потенциала пробоя БЛМ Время, с 0 30 60 90 120 200 150 100
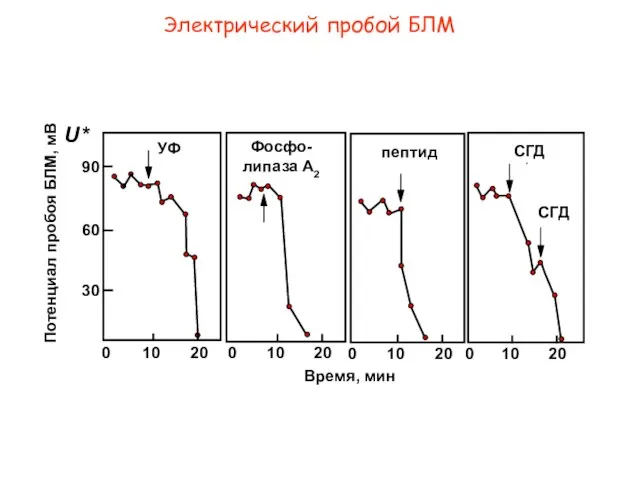
- 12. Электрический пробой БЛМ P УФ Фосфо-липаза A2 пептид СГД 0 20 10 0 20 10 0
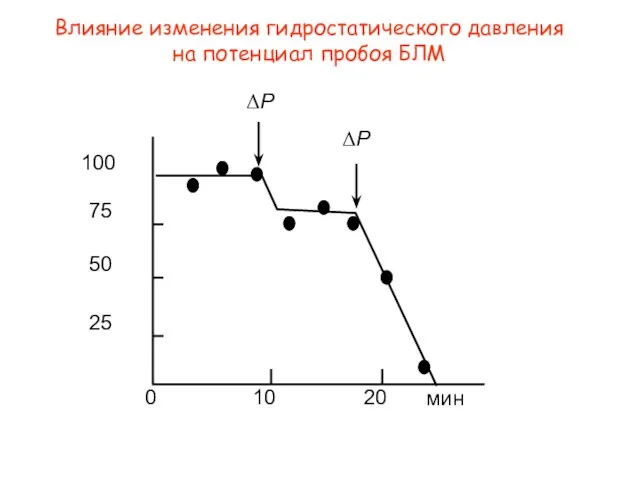
- 13. Влияние изменения гидростатического давления на потенциал пробоя БЛМ
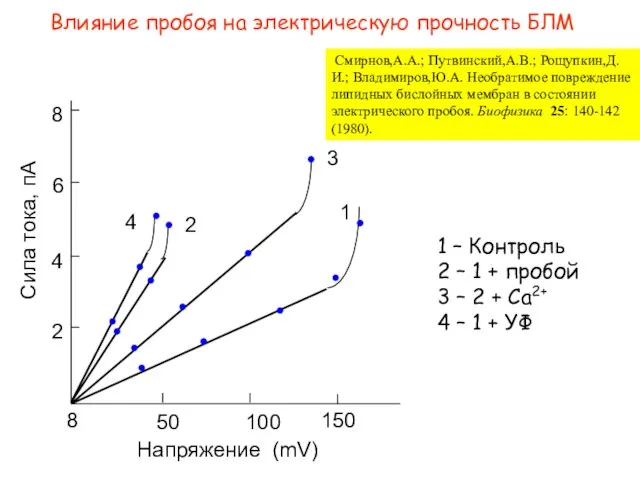
- 14. Влияние пробоя на электрическую прочность БЛМ Смирнов,А.А.; Путвинский,А.В.; Рощупкин,Д.И.; Владимиров,Ю.А. Необратимое повреждение липидных бислойных мембран в
- 15. Пробой мембран собственным (ионным диффузионным) потенциалом
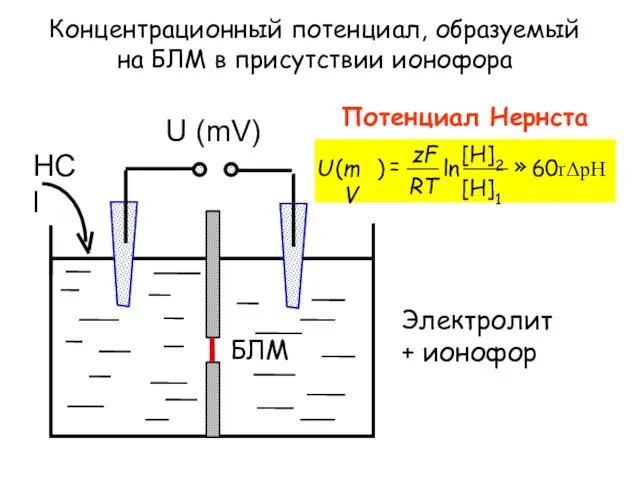
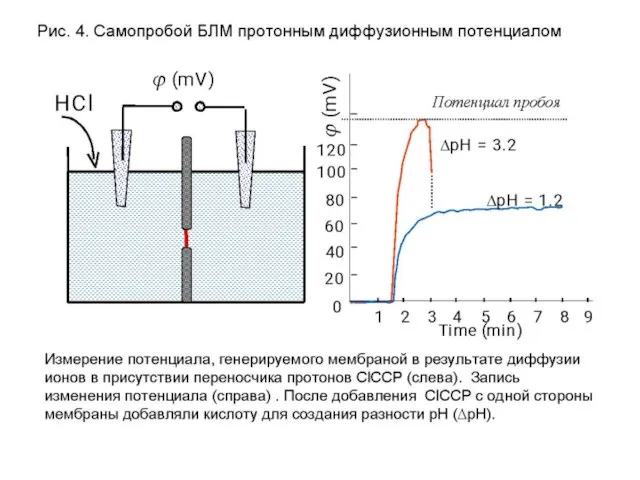
- 16. Концентрационный потенциал, образуемый на БЛМ в присутствии ионофора Потенциал Нернста Электролит + ионофор БЛМ
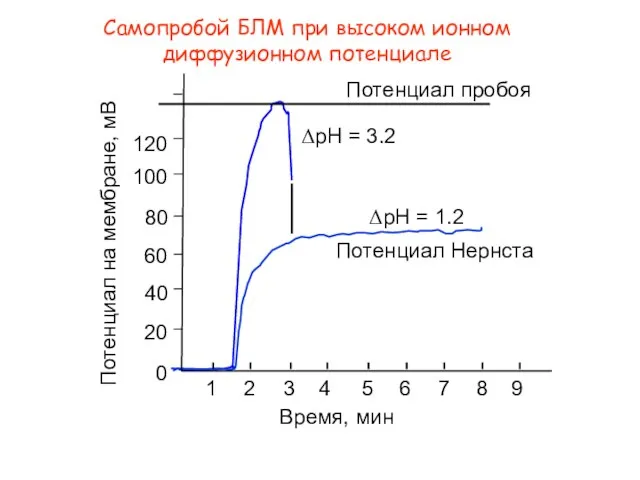
- 17. Самопробой БЛМ при высоком ионном диффузионном потенциале
- 18. Самопробойц БЛМ
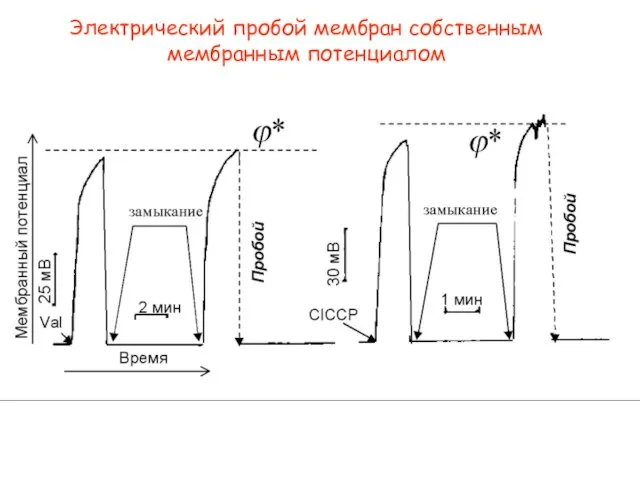
- 19. Электрический пробой мембран собственным мембранным потенциалом
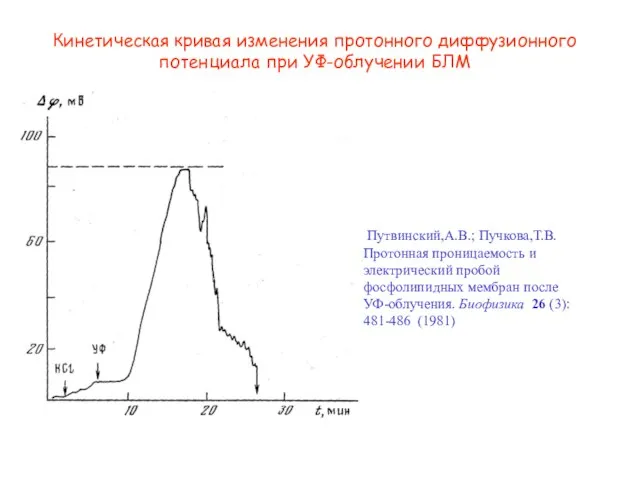
- 20. Кинетическая кривая изменения протонного диффузионного потенциала при УФ-облучении БЛМ Путвинский,А.В.; Пучкова,Т.В. Протонная проницаемость и электрический пробой
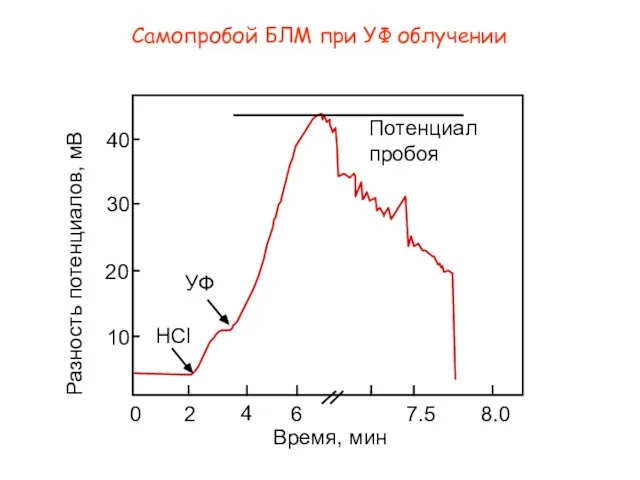
- 21. HCl УФ 40 2 10 20 30 0 6 4 7.5 8.0 Потенциал пробоя Время, мин
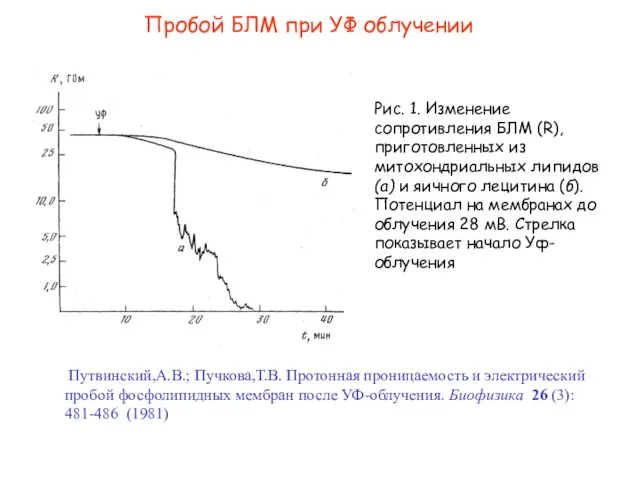
- 22. Пробой БЛМ при УФ облучении Путвинский,А.В.; Пучкова,Т.В. Протонная проницаемость и электрический пробой фосфолипидных мембран после УФ-облучения.
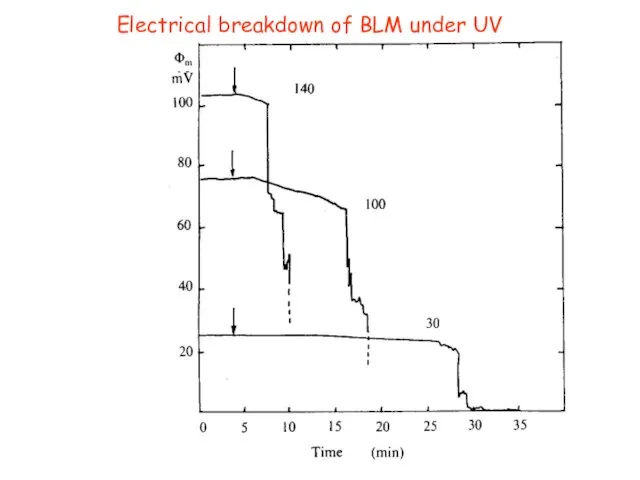
- 23. Electrical breakdown of BLM under UV
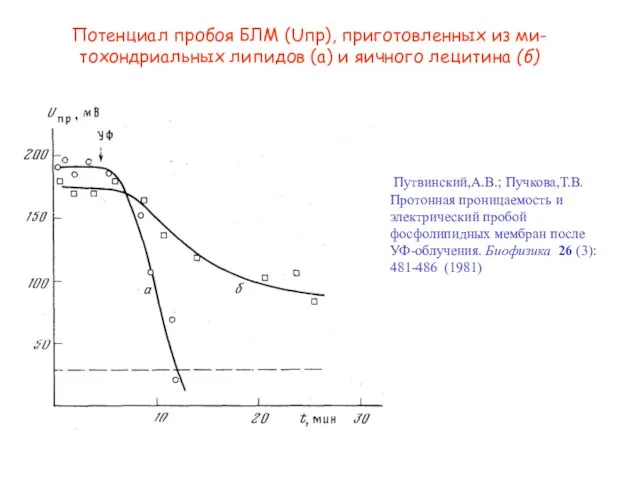
- 24. Потенциал пробоя БЛМ (Uпр), приготовленных из ми-тохондриальных липидов (а) и яичного лецитина (б) Путвинский,А.В.; Пучкова,Т.В. Протонная
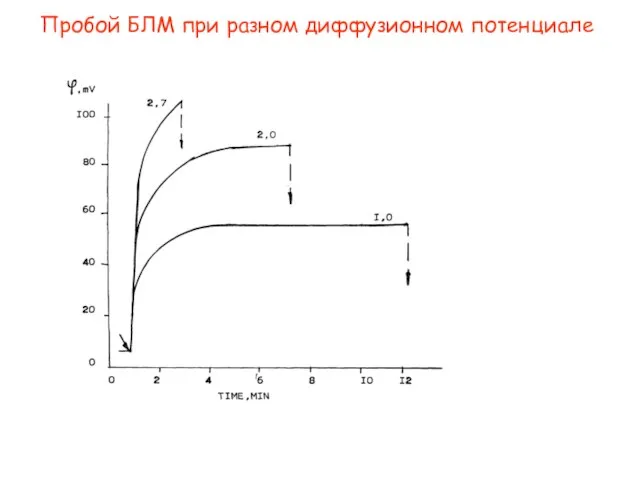
- 25. Пробой БЛМ при разном диффузионном потенциале
- 26. Электрический пробой фосфолипидных везикул (липосом)
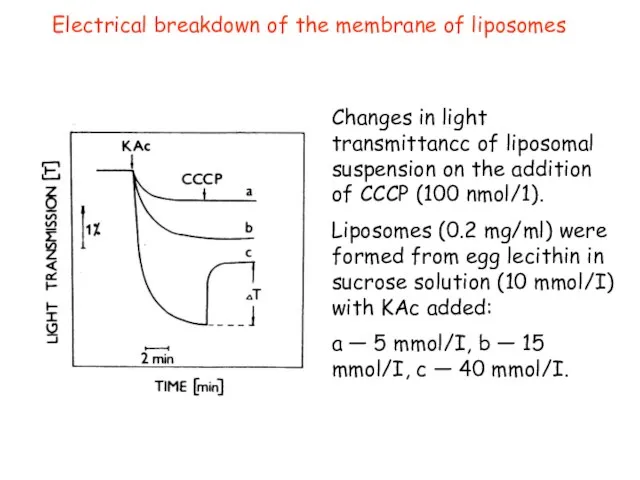
- 27. Electrical breakdown of the membrane of liposomes Changes in light transmittancc of liposomal suspension on the
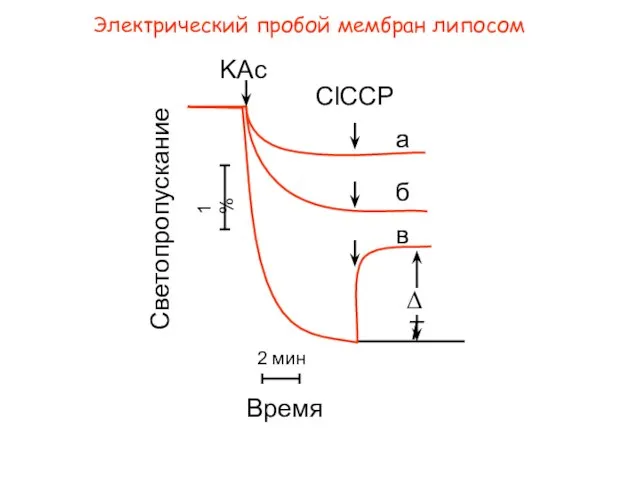
- 28. Электрический пробой мембран липосом
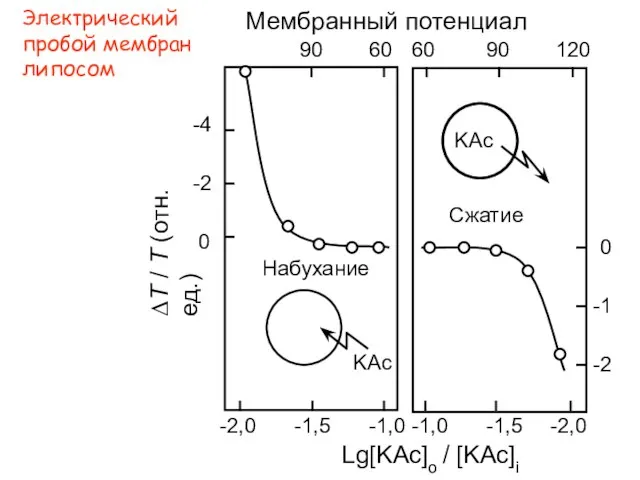
- 29. Электрический пробой мембран липосом
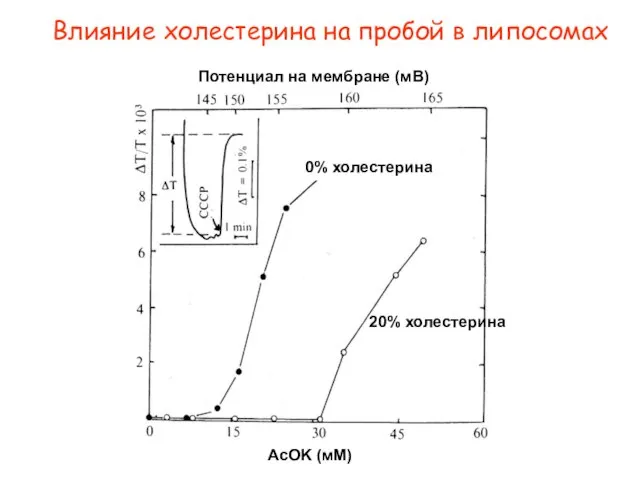
- 30. 20% холестерина 0% холестерина AcOK (мМ) Потенциал на мембране (мВ) Влияние холестерина на пробой в липосомах
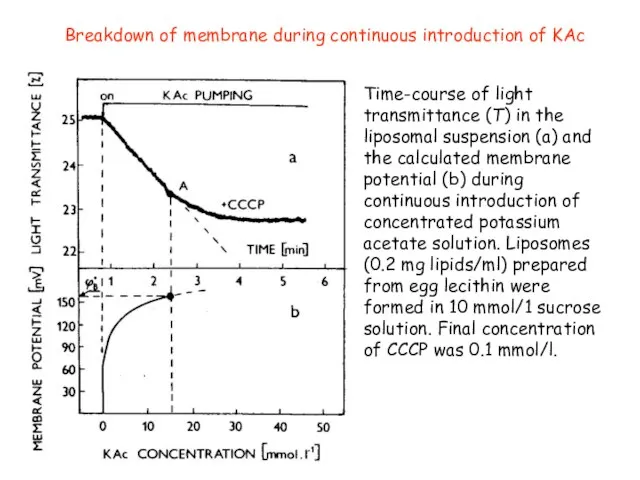
- 31. Breakdown of membrane during continuous introduction of KAc Time-course of light transmittance (T) in the liposomal
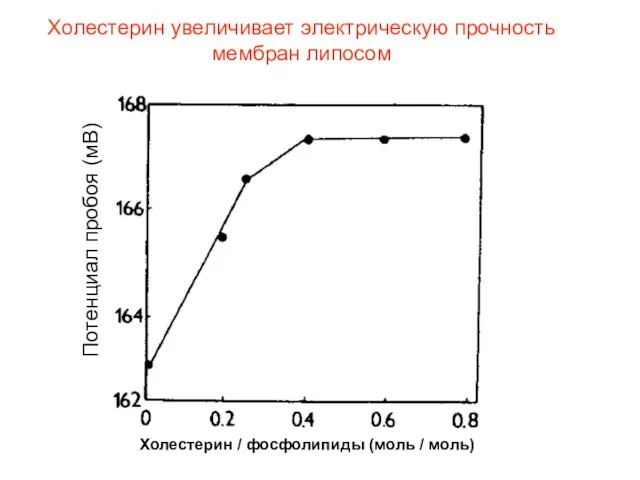
- 32. Холестерин увеличивает электрическую прочность мембран липосом Потенциал пробоя (мВ) Холестерин / фосфолипиды (моль / моль)
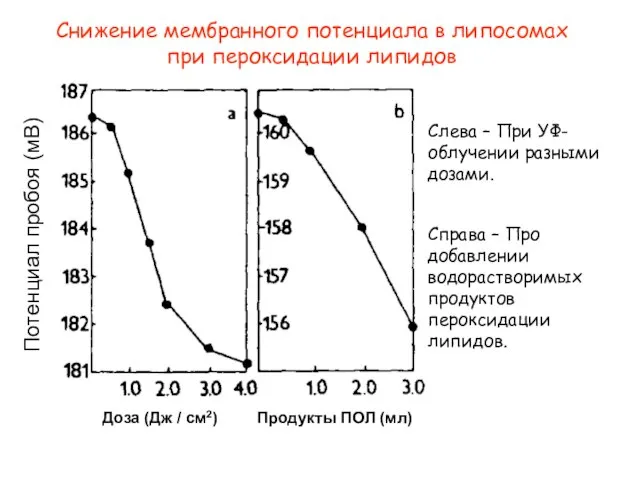
- 33. Снижение мембранного потенциала в липосомах при пероксидации липидов Доза (Дж / см2) Потенциал пробоя (мВ) Продукты
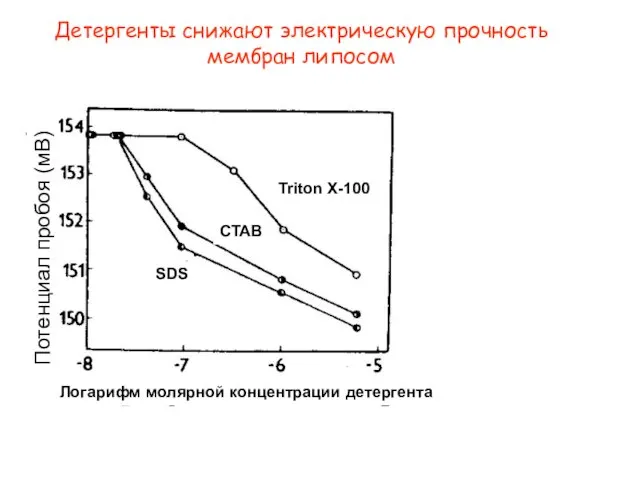
- 34. Детергенты снижают электрическую прочность мембран липосом SDS CTAB Triton X-100 Логарифм молярной концентрации детергента Потенциал пробоя
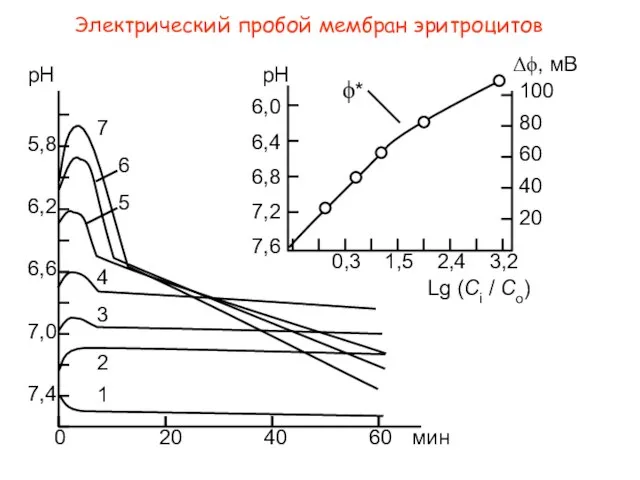
- 35. Электрический пробой мембран эритроцитов
- 36. Электрический пробой мембран эритроцитов
- 37. [Cl]i and [C1]o, Cl- -concentrations in the cells and in the surrounding isotonic medium, respectively; фm
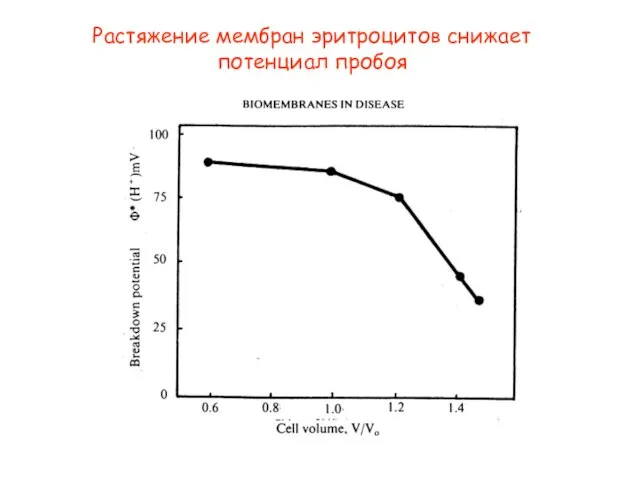
- 38. Растяжение мембран эритроцитов снижает потенциал пробоя
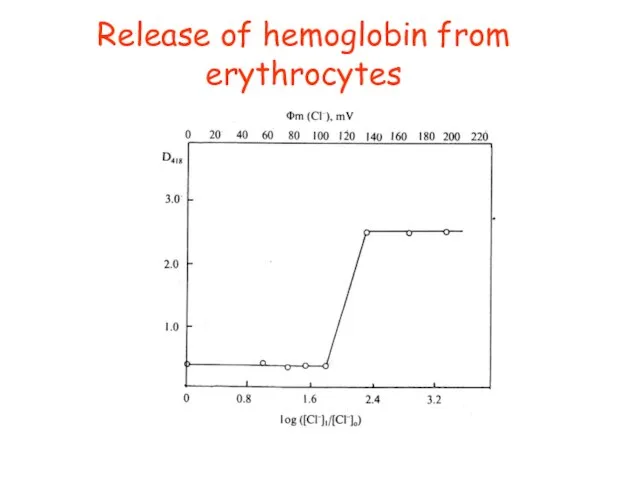
- 39. Release of hemoglobin from erythrocytes
- 40. Электрический пробой мембран митохондрий
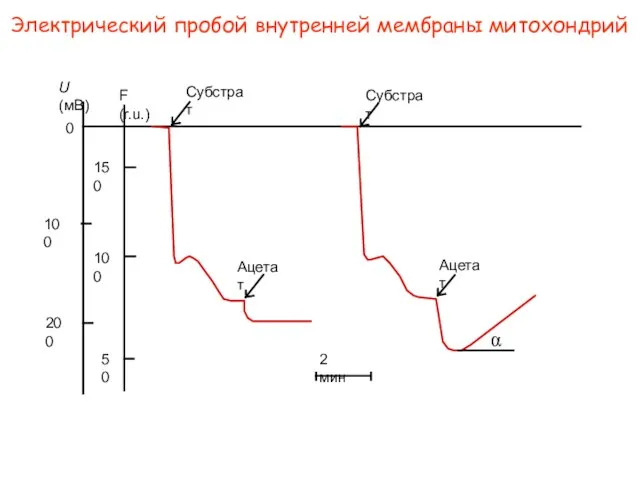
- 41. Электрический пробой внутренней мембраны митохондрий
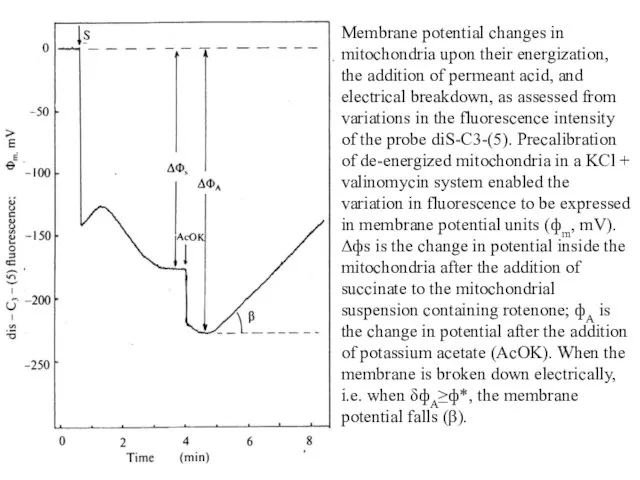
- 42. Membrane potential changes in mitochondria upon their energization, the addition of permeant acid, and electrical breakdown,
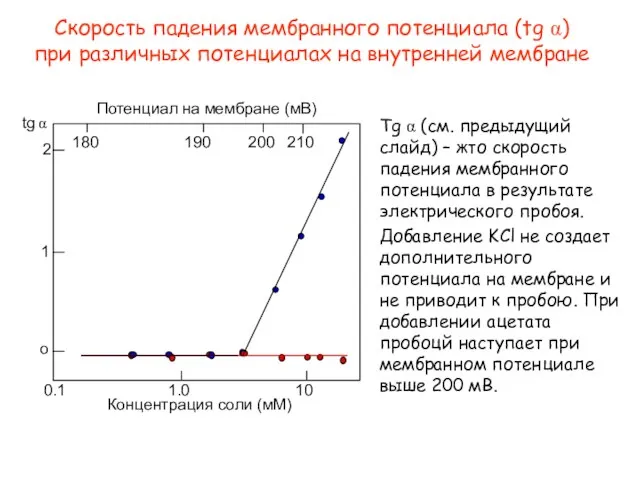
- 43. o 1 2 tg α 180 190 200 210 Потенциал на мембране (мВ) 1.0 0.1 10
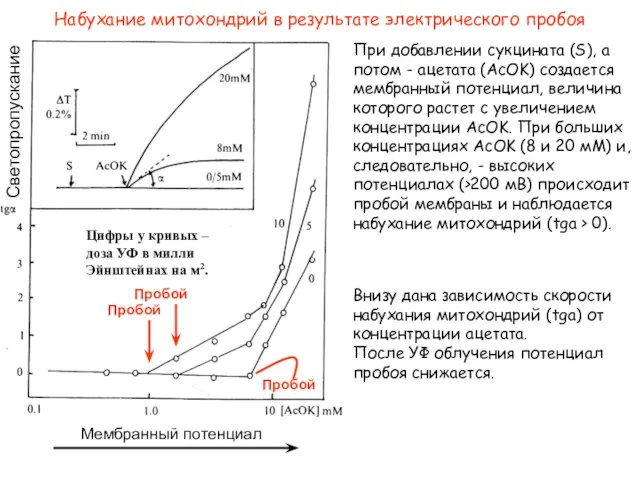
- 44. При добавлении сукцината (S), а потом - ацетата (AcOK) создается мембранный потенциал, величина которого растет с
- 46. Скачать презентацию





![[Cl]i and [C1]o, Cl- -concentrations in the cells and in the surrounding](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/384549/slide-36.jpg)

 Украшение и фантазия
Украшение и фантазия День рождения Березки (Светлый праздник Троицы)
День рождения Березки (Светлый праздник Троицы) Презентация на тему Люди, которые нас окружают
Презентация на тему Люди, которые нас окружают Говорящие фамилии в пьесе А.С.Грибоедова «Горе от ума»
Говорящие фамилии в пьесе А.С.Грибоедова «Горе от ума» Презентация на тему Вычитание натуральных чисел
Презентация на тему Вычитание натуральных чисел Строительные материалы будущего
Строительные материалы будущего Jet Set Matrix
Jet Set Matrix Презентация на тему Технология приготовления блюд из каш
Презентация на тему Технология приготовления блюд из каш Общие сведения о сечениях и разрезах (9 класс)
Общие сведения о сечениях и разрезах (9 класс) ООО «Инстар Технолоджи»
ООО «Инстар Технолоджи» Российско-словенские стипендии для студентов и аспирантов 2021-2022
Российско-словенские стипендии для студентов и аспирантов 2021-2022 Энергетический обмен Вариант 1
Энергетический обмен Вариант 1 Межшкольный учебный комбинатСоветского района г.Казани
Межшкольный учебный комбинатСоветского района г.Казани Презентация на тему "What’s Your Idea of an Ideal Subculture"
Презентация на тему "What’s Your Idea of an Ideal Subculture" Презентация на тему Острые респираторные заболевания и их профилактика
Презентация на тему Острые респираторные заболевания и их профилактика 1. О компании Banquet Hall 2.Направления деятельности: - ресторанное выездное обслуживание - корпоративное питание 3. Специальные услуги 4.
1. О компании Banquet Hall 2.Направления деятельности: - ресторанное выездное обслуживание - корпоративное питание 3. Специальные услуги 4.  Скажи мне, как тебя зовут...
Скажи мне, как тебя зовут... В гостях Тимур и его команда
В гостях Тимур и его команда Дидактическая игра Поселим слова в домики
Дидактическая игра Поселим слова в домики Организация проектной деятельности на уроках информатики как способ формирования ключевых компетенций школьников
Организация проектной деятельности на уроках информатики как способ формирования ключевых компетенций школьников Проект SLIMELAB
Проект SLIMELAB Поправки в конституцию
Поправки в конституцию Презентация на тему "Портфель заместителя директора по информатизации ОУ" - скачать презентации по Педагогике
Презентация на тему "Портфель заместителя директора по информатизации ОУ" - скачать презентации по Педагогике Композиционное построение вазы «Сапожок»
Композиционное построение вазы «Сапожок» 20161223_yaponiya1
20161223_yaponiya1 «Оттепель» в духовной жизни
«Оттепель» в духовной жизни Презентация на тему Императорские пингвины
Презентация на тему Императорские пингвины Презентація урок 2
Презентація урок 2