Содержание
- 2. С О Е Д И Н Е Н И Я С Е Р Ы
- 3. степень окисления серы -2 Сероводород - Н2S Сульфиды неметаллов – CS2, P2S3 Сульфиды металлов – Al2S3,
- 4. Н2S СЕРОВОДОРОД Это - ядовитый газ со специфическим запахом, тяжелее воздуха и кислорода, растворимый в воде.
- 5. Получение: водород + сера H2 + S ----H2S сульфид металла + сильная кислота ZnS + 2HCL---ZnCl2
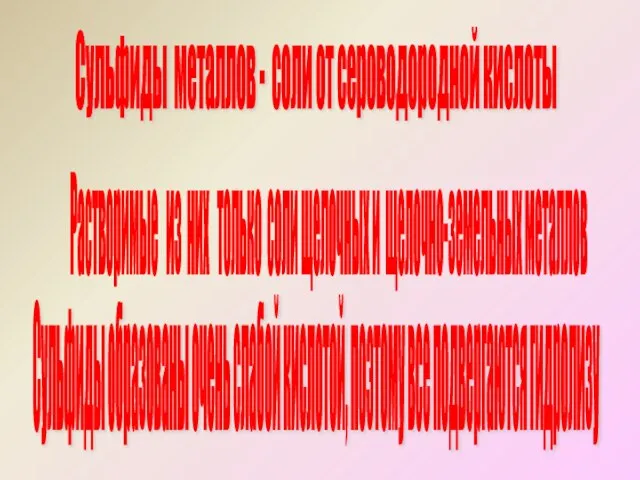
- 6. Сульфиды металлов - соли от сероводородной кислоты Сульфиды образованы очень слабой кислотой, поэтому все подвергаются гидролизу
- 7. степень окисления серы + 4 Сернистый газ –SO2 Сернистая кислота –H2SO3 Сульфиты – K2SO3, BaSO3
- 8. СЕРНИСТЫЙ ГАЗ SO2 Оксид серы(lV) – сернистый газ, являющийся одним из главных загрязнителей атмосферного воздуха, кислотный
- 9. Получение: разложение сернистой кислоты H2SO3 -----SO2 + H2O сгорание серы S + O2 ---SO2 обжиг сульфидов
- 10. Химические свойства: с водой SO2 + H2O---H2SO3 с основными оксидами SO2 + BaO---BaSO3 с щелочами SO2
- 11. Составьте уравнения реакций оксида серы (Vl) с водой, оксидом натрия, гидроксидом кальция, оксидом алюминия. Назовите продукты
- 12. Сернистая кислота – очень слабая, неустойчивая, легко разлагается на сернистый газ и воду (является аналогом угольной
- 13. степень окисления серы + 6 Серный ангидрид или оксид серы (Vl) –SO3 Серная кислота –H2SO4 Сульфаты
- 14. Оксид серы (Vl) – кислотный оксид, получается при окислении сернистого газа 2SO2 + O2---2SO3 Химические свойства
- 15. Н2SO4 Два вида солей от серной кислоты: средние – сульфаты CaSO4 и кислые – гидросульфаты Ba(HSO4)2
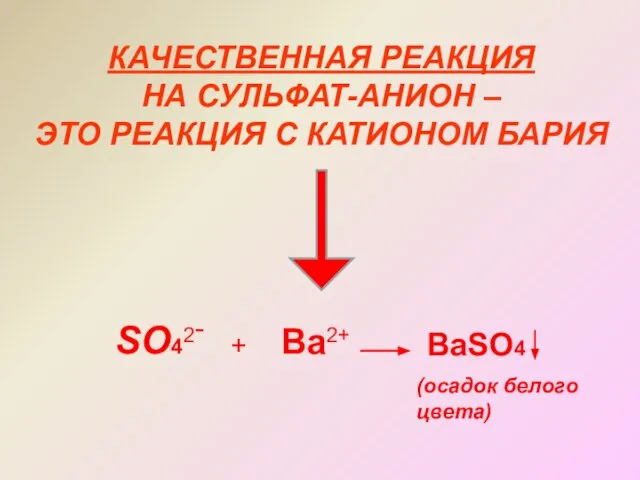
- 16. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-АНИОН – ЭТО РЕАКЦИЯ С КАТИОНОМ БАРИЯ SO42- + Ba2+ BaSO4 (осадок белого
- 17. Н2SO4 Серная кислота - тяжелая бесцветная жидкость, которая бывает концентрированная и разбавленная, в зависимости от этого
- 18. Взаимодействие разбавленной и концентрированной кислоты с металлами разной активности
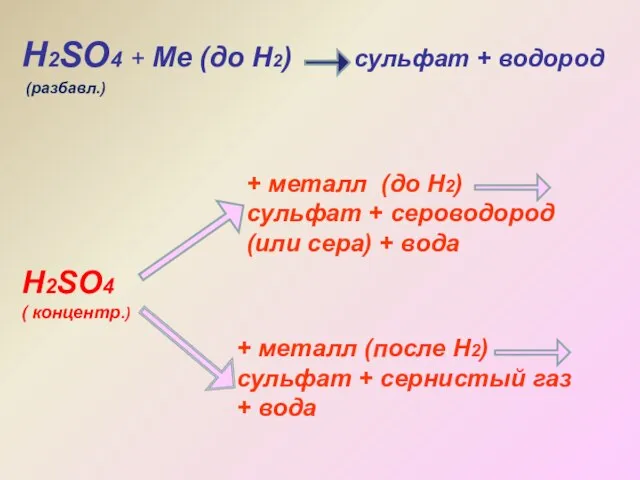
- 19. Н2SO4 + Ме (до Н2) сульфат + водород Н2SO4 ( концентр.) + металл (до Н2) сульфат
- 20. Выполните задание по вариантам: 1 вариант – сернистый газ 2 вариант – серная кислота Вам даны
- 21. Это простое вещество Это соединение с высшей степенью окисления серы 3. Это сильный электролит 4. Это
- 22. Сульфат меди(ll) Сульфат алюминия Сульфат бария Сульфат хрома(lll) Сульфат железа(ll) Сульфат кобальта Найдите соответствие между названием
- 23. Самостоятельная работа по вариантам:
- 24. 1 вариант 2 вариант Составить о.в.р: Серная кислота разб. + натрий 2. Серная кислота разб. +
- 26. Скачать презентацию




















 Опасные места
Опасные места 20140317_merzlikinaip_doc
20140317_merzlikinaip_doc ВИЧ и СПИД
ВИЧ и СПИД Анатомия
Анатомия Электронный документооборот как инструмент борьбы с бюрократией
Электронный документооборот как инструмент борьбы с бюрократией Винсент Виллем ван Гог
Винсент Виллем ван Гог Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие
Как выполнить выгрузкуотчетности в электронном виде из программ системы 1С:Предприятие Преобразования фигур в пространстве
Преобразования фигур в пространстве Предельные одноосновные карбоновые кислоты. Сложные эфиры
Предельные одноосновные карбоновые кислоты. Сложные эфиры Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое
Дизайн. Коллаборация. Цифровые технологии. Кейс №3 Перерождение одного изделия в другое Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА
Презентация на тему ДЕЙСТВИЕ ТАБАКА НА ОРГАНИЗМ ЧЕЛОВЕКА  Where is the dog?
Where is the dog? . 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти
. 1)Прочитать числа: 509, 6001, 90050, 7000850127, 620022. Назвать в каждом из чисел цифру в разряде десятков, сотен. Какие из чисел меньше 1000? 2)Найти ООО ГарантСтройХаус
ООО ГарантСтройХаус Пончики Пончкофф (фотографии)
Пончики Пончкофф (фотографии) Определение культуры. Типы культур
Определение культуры. Типы культур Искусства бумагокручения
Искусства бумагокручения Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс)
Технологический процесс ручной дуговой сварки листовых конструкций из стали (ст-3пс) МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА…
МЫ СКОРО УЙДЁМ СО ШКОЛЬНОГО ДВОРА… Эффективные приёмы запоминания учебного материала
Эффективные приёмы запоминания учебного материала Административно-правовой статус
Административно-правовой статус Развитие личности младшего школьника средствами учебного диалога
Развитие личности младшего школьника средствами учебного диалога БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ
БЭК-ОФИС СОЗДАНИЕ, РАЗВИТИЕ, АВТОМАТИЗАЦИЯ Внеурочная работа по математике
Внеурочная работа по математике Слайды
Слайды ГОГОЛЬ: знакомый и незнакомый
ГОГОЛЬ: знакомый и незнакомый The Cable News Network
The Cable News Network Сила. Основы методики ее воспитания
Сила. Основы методики ее воспитания