Слайд 21. Оксиды щелочных металлов
а) физические свойства:
б) химические свойства:

Слайд 32. Гидроксиды щелочных металлов
а) физические свойства:
б) химические свойства:
Инструкция
Налейте в чистую пробирку гидроксид

натрия, добавьте несколько капель фенолфталеина. Что наблюдаете?
Добавьте в эту же пробирку раствор соляной кислоты. Что наблюдаете? Запишите уравнение реакции.
Налейте в чистую пробирку гидроксид натрия и добавьте раствор сульфата меди. Что наблюдаете? Запишите уравнение реакции.
В пробирку с гидроксидом цинка осторожно добавьте гидроксид натрия. Что наблюдаете? Запишите уравнение реакции.
Сделайте вывод о химических свойствах гидроксидов щелочных металлов.
Слайд 42. Гидроксиды щелочных металлов
в) применение: Гидроксид натрия – NaOH – едкий натр,
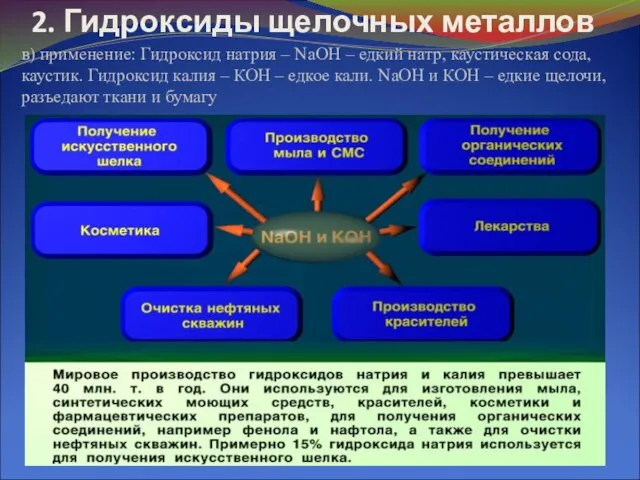
каустическая сода, каустик. Гидроксид калия – КОН – едкое кали. NaOH и КОН – едкие щелочи, разъедают ткани и бумагу
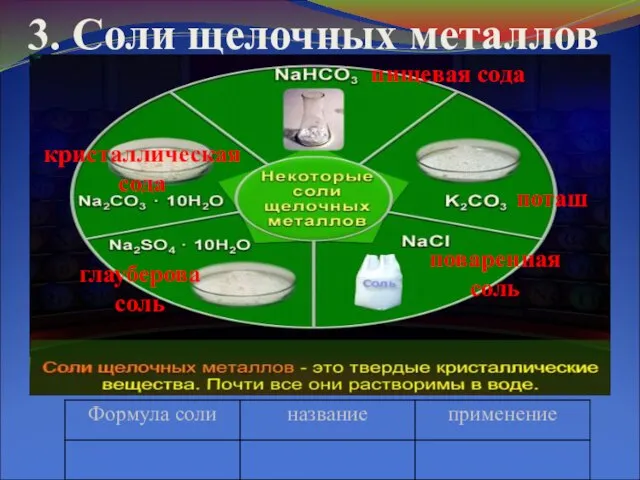
Слайд 53. Соли щелочных металлов
пищевая сода
поташ
поваренная соль
глауберова соль
кристаллическая сода
Слайд 64. Значение соединений щелочных металлов
в жизнедеятельности организмов
Ионы натрия и калия играют

большую биологическую роль: Na+ - главный внеклеточный ион, содержится в крови и лимфе, а К+ - основной внутриклеточный ион. Соотношение концентрации этих ионов регулирует давление крови в живом организме и обеспечивает перемещение растворов солей из корней в листья растений. Ионы калия - поддерживают работу сердечной мышцы, помогают при ревматизме, улучшают работу кишечника. Соединения калия – устраняют отеки.





 Основные понятия и законы динамики
Основные понятия и законы динамики Социальные эффекты информатизации
Социальные эффекты информатизации Михаил ЕвграфовичСалтыков-Щедрин
Михаил ЕвграфовичСалтыков-Щедрин Отдел мониторинга реализации стратегии развития университета и современных образовательных технологийСЕМИНАР-ТРЕНИНГ 2011 «Вне
Отдел мониторинга реализации стратегии развития университета и современных образовательных технологийСЕМИНАР-ТРЕНИНГ 2011 «Вне Уголовная ответственность несовершенолетних за кражи
Уголовная ответственность несовершенолетних за кражи Сибирское здоровье. Бизнес-план аптеки
Сибирское здоровье. Бизнес-план аптеки Dart
Dart Наши питомцы презентация
Наши питомцы презентация Презентация_8
Презентация_8 Проект фирмы Техсервис
Проект фирмы Техсервис Япония
Япония О формировании Единого таможенного тарифа и мерах нетарифного регулирования в рамках Таможенного союза
О формировании Единого таможенного тарифа и мерах нетарифного регулирования в рамках Таможенного союза Презентация на тему Растения на гербах разных стран
Презентация на тему Растения на гербах разных стран Типичные налоговые претензии к малому и среднему бизнесу по спецрежимам, антикризисным льготам, увольнению персонала
Типичные налоговые претензии к малому и среднему бизнесу по спецрежимам, антикризисным льготам, увольнению персонала Высвобождение персонала
Высвобождение персонала XV-XVII ғасырлардағы қазақ әдеби тілінің үлгілері
XV-XVII ғасырлардағы қазақ әдеби тілінің үлгілері START UP
START UP Древня Русь (4 класс)
Древня Русь (4 класс) Просвещение
Просвещение Презентация на тему Вильгельм I Оранский
Презентация на тему Вильгельм I Оранский Инвестиционная безопасность РФ
Инвестиционная безопасность РФ Этюд Осеннее дерево
Этюд Осеннее дерево Организационная структура ТЭК ООО «Арго»
Организационная структура ТЭК ООО «Арго» Первая помощь при бытовых ожогах
Первая помощь при бытовых ожогах Работа с окнами в Windows
Работа с окнами в Windows Выборы-2001
Выборы-2001 Урок презентация на тему Откуда на небе облака
Урок презентация на тему Откуда на небе облака  Почти круглый стол Макса Вебера
Почти круглый стол Макса Вебера