Содержание
- 2. Спектроскопия УФ- и видимого диапазона Д.В. Козлов, Г.А. Костин, А.П. Чупахин «Основные принципы спектроскопии и ее
- 3. Электронная (ультрафиолетовая) спектроскопия изучает энергетические переходы между валентными молекулярными орбиталями. E = E1- Е0= hν =
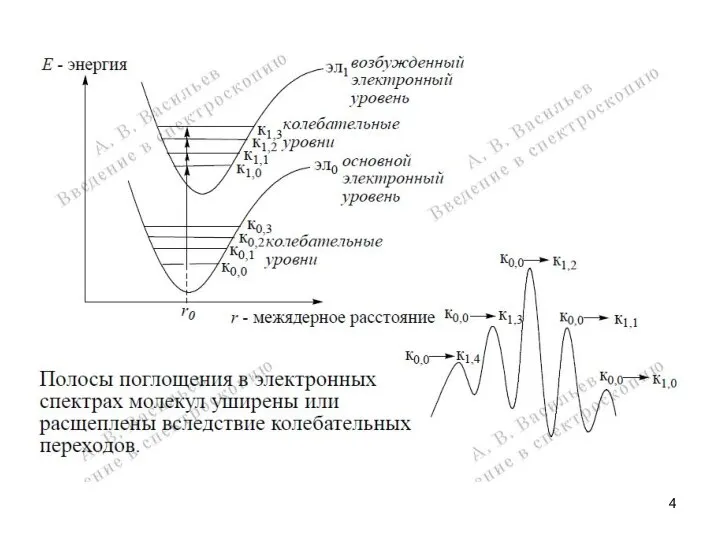
- 5. Характеристика электронных переходов Большинство электронных переходов в молекулах проявляются в диапазоне 200-750 нм, который подразделяется на
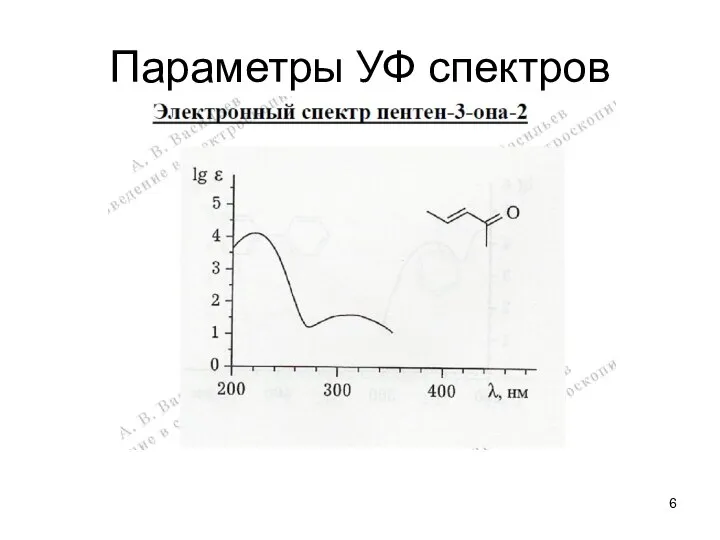
- 6. Параметры УФ спектров
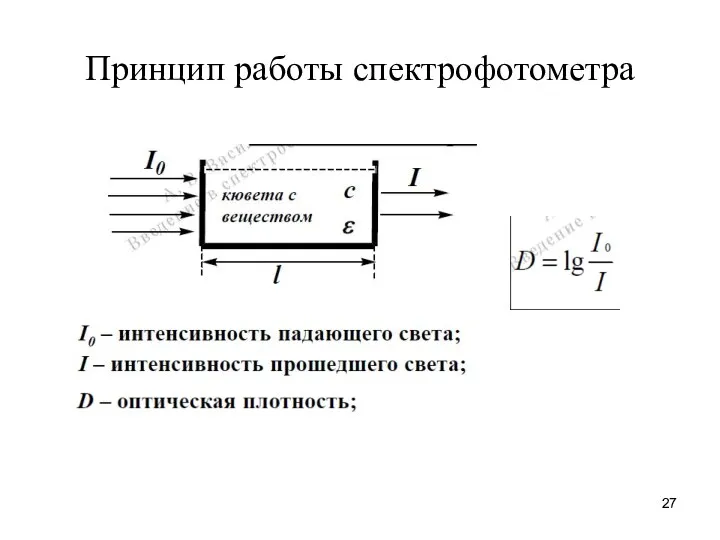
- 7. Закон Бугера-Ламберта-Бера – основной закон оптической спектроскопии D= ε*c*l D – оптическая плотность; с – концентрация
- 8. Спектроскопия УФ- и видимого диапазона Каждый Охотник Желает Знать Где Сидит Фазан
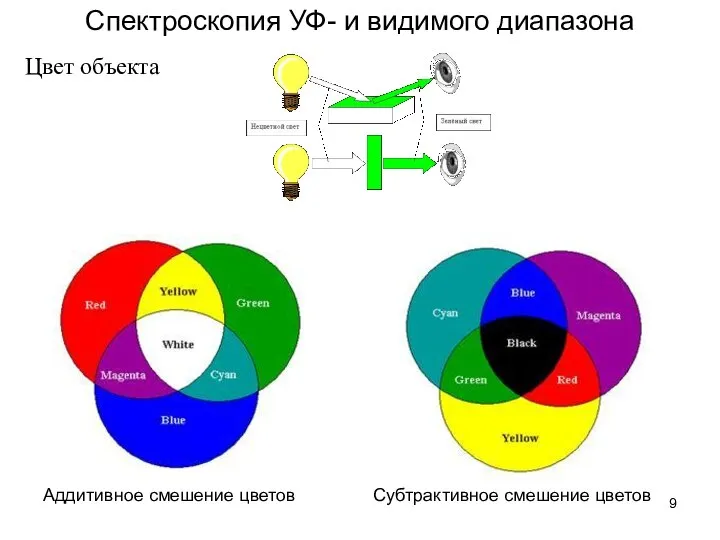
- 9. Спектроскопия УФ- и видимого диапазона Цвет объекта Аддитивное смешение цветов Субтрактивное смешение цветов
- 10. Аддитивное смешение цветов - метод синтеза цвета, основанный на сложении цветов непосредственно излучающих объектов. RGB- система
- 11. Субтрактивный синтез цвета - получение цвета путём вычитания из спектрально-равномерного белого света отдельных спектральных составляющих. CMYK
- 12. Спектроскопия УФ- и видимого диапазона Примерные границы основных цветов спектра Цвет объекта
- 13. Энергия переходов
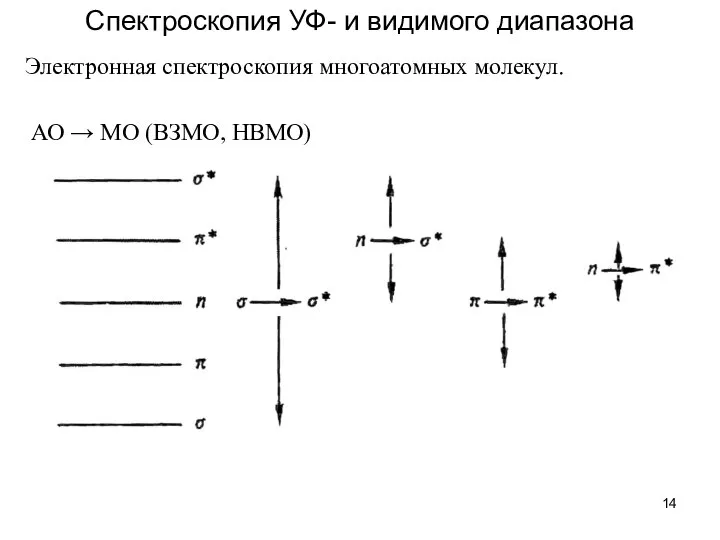
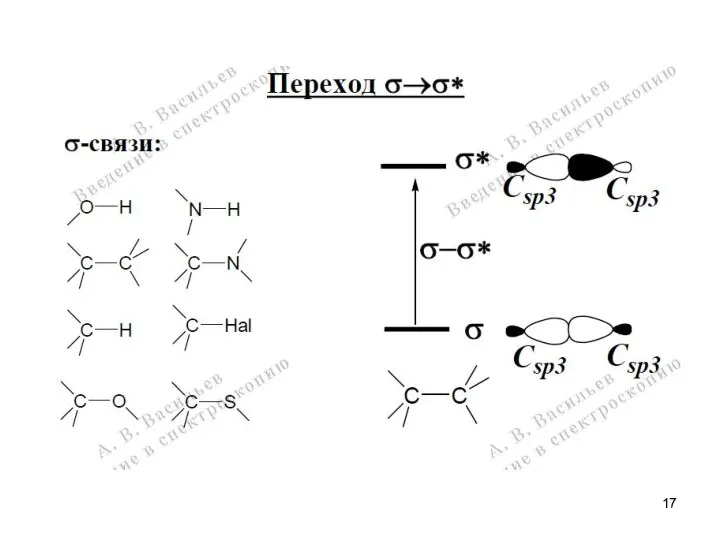
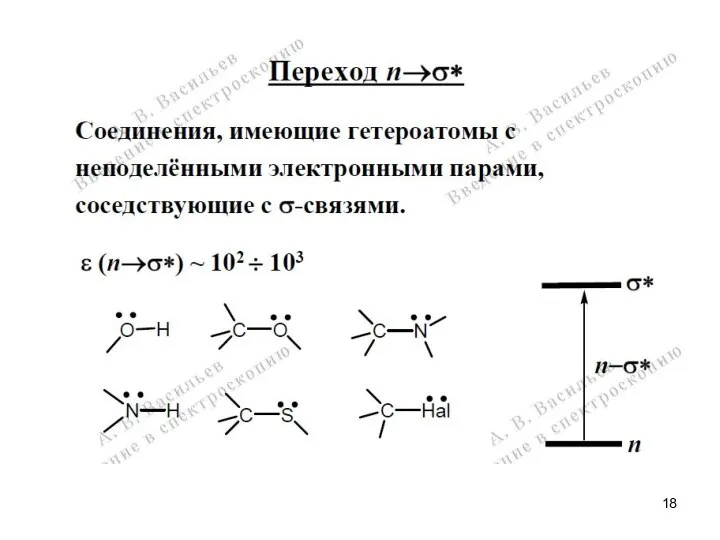
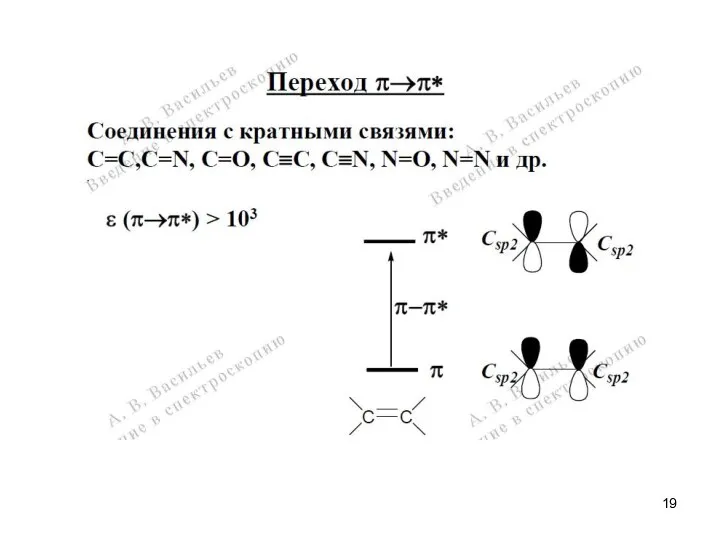
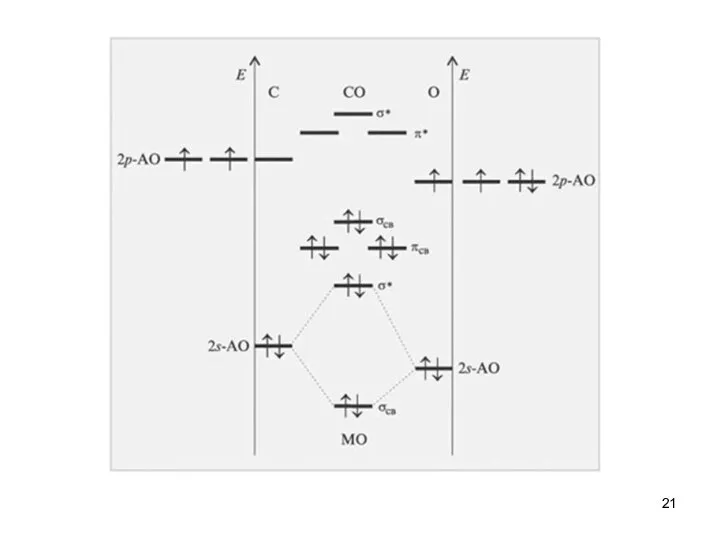
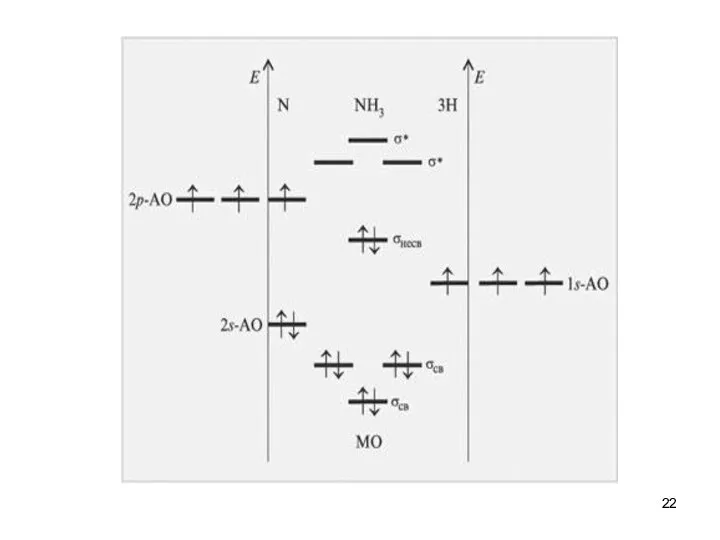
- 14. Спектроскопия УФ- и видимого диапазона Электронная спектроскопия многоатомных молекул. АО → МО (ВЗМО, НВМО)
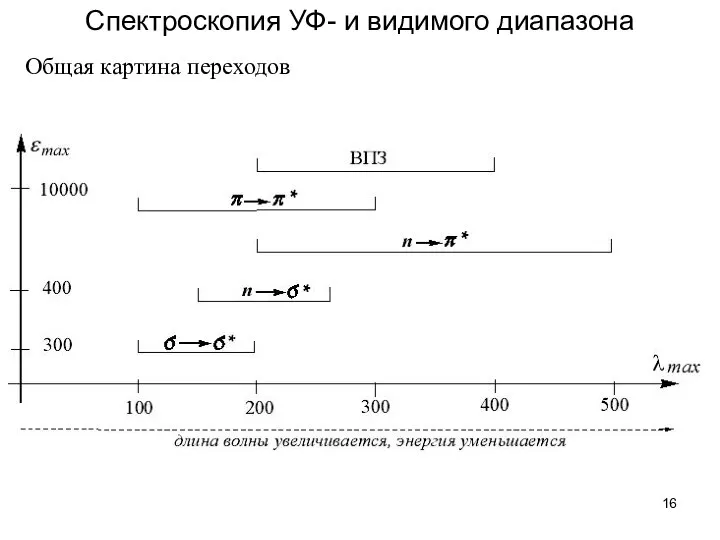
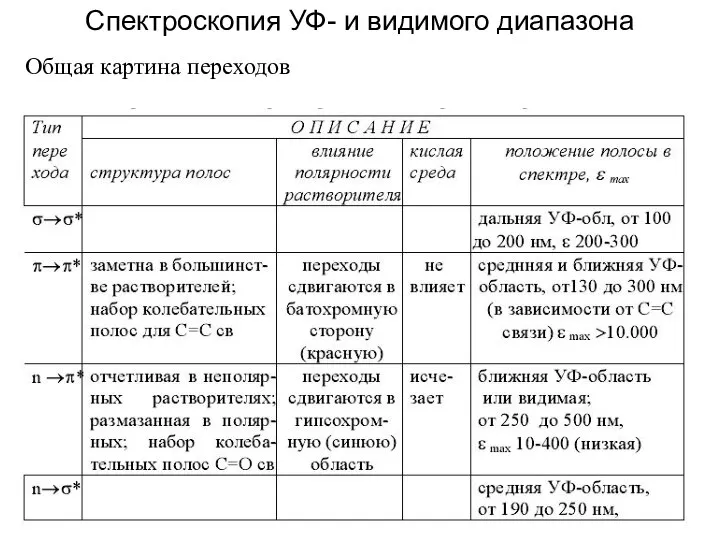
- 16. Спектроскопия УФ- и видимого диапазона Общая картина переходов
- 23. Задача Обосновать изменение окраски в ряду газообразных молекулярных галогенов: F2 - светло-желтый, Сl2 – желто-зеленый, Br2
- 24. Спектроскопия УФ- и видимого диапазона Общая картина переходов
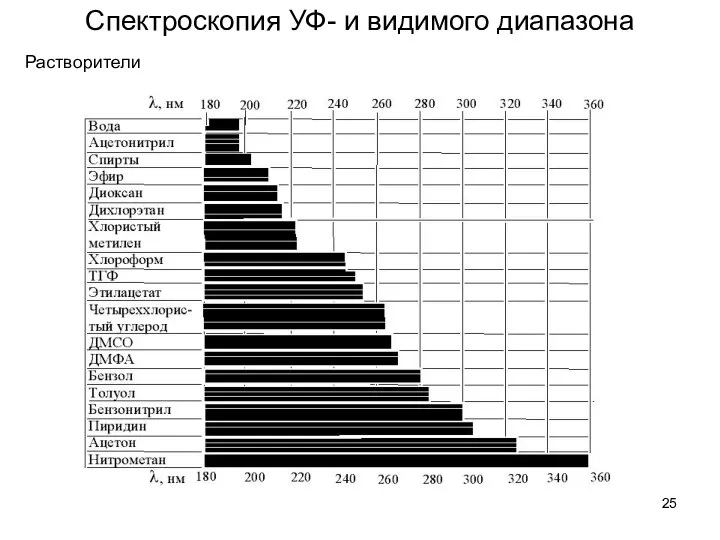
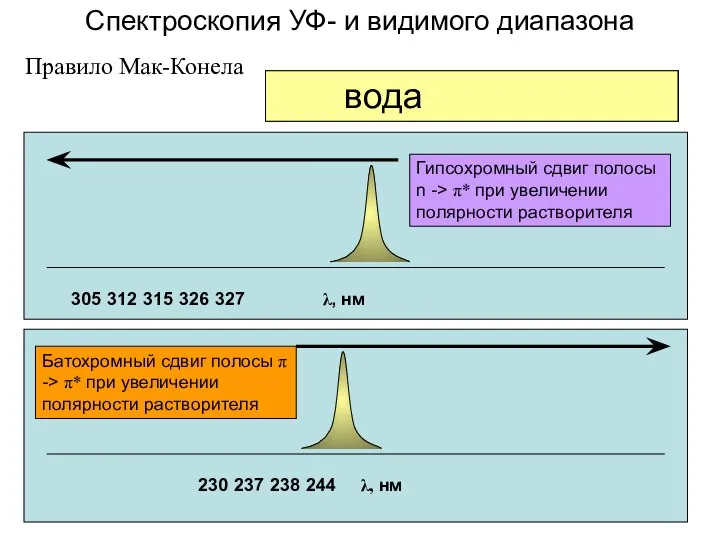
- 25. Спектроскопия УФ- и видимого диапазона Растворители
- 26. 230 237 238 244 λ, нм 305 312 315 326 327 λ, нм гексан диэтиловый эфир
- 27. Принцип работы спектрофотометра
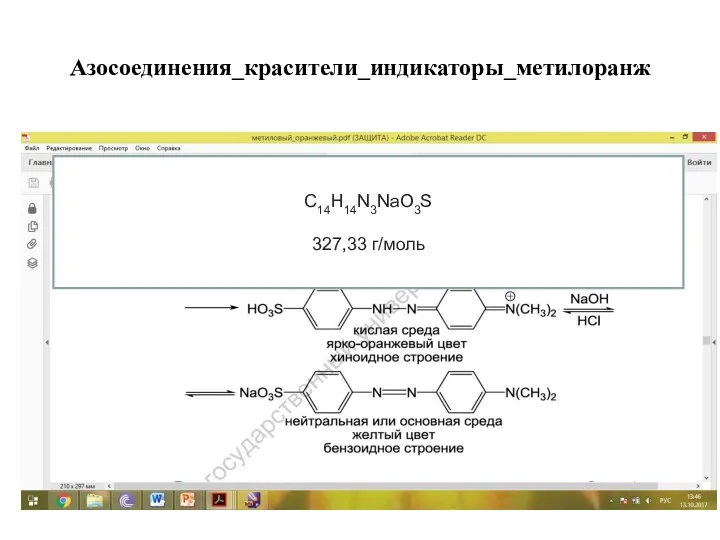
- 28. Азосоединения_красители_индикаторы_метилоранж C14H14N3NaO3S 327,33 г/моль
- 30. Скачать презентацию












 ПРИРОДНОЕ СООБЩЕСТВО ЛУГ
ПРИРОДНОЕ СООБЩЕСТВО ЛУГ НАЦИОНАЛЬНЫЙ СОЮЗ НЕКОММЕРЧЕСКИХ ОРГАНИЗАЦИЙ ФИНАНСОВОЙ ВЗАИМОПОМОЩИ
НАЦИОНАЛЬНЫЙ СОЮЗ НЕКОММЕРЧЕСКИХ ОРГАНИЗАЦИЙ ФИНАНСОВОЙ ВЗАИМОПОМОЩИ Святогорский монастырь
Святогорский монастырь Формы работы на приходе с молодежью: организация направлений деятельности и приходских кружков
Формы работы на приходе с молодежью: организация направлений деятельности и приходских кружков Курсы дистанционного обучения для электроэнергетики
Курсы дистанционного обучения для электроэнергетики Обучение и стажировка В Чешской республике
Обучение и стажировка В Чешской республике Нечеткая логика и нечеткие множества
Нечеткая логика и нечеткие множества Товарная политика
Товарная политика В гостях у русских умельцев
В гостях у русских умельцев Travel America
Travel America ЛИДЕР ии
ЛИДЕР ии Урок русского языка в 8 классе. Обобщение изученного по теме «Главные члены предложения» Учитель русского языка и литературы М
Урок русского языка в 8 классе. Обобщение изученного по теме «Главные члены предложения» Учитель русского языка и литературы М Международное разделение труда и его основные принципы
Международное разделение труда и его основные принципы Презентация на тему Электрический ток
Презентация на тему Электрический ток Леонард Эйлер
Леонард Эйлер Типологизация рекламы
Типологизация рекламы Система упражнений по подготовке к написанию сжатого изложения
Система упражнений по подготовке к написанию сжатого изложения Теплота
Теплота Технологии тестового контроля для мониторинга качества знаний
Технологии тестового контроля для мониторинга качества знаний Тета хилинг –технология будущего
Тета хилинг –технология будущего Ліпікар Молочко
Ліпікар Молочко Интеллектуальная игра
Интеллектуальная игра 3М Innovations
3М Innovations Из истории Троице-Сергиева монастыря г. Великие Луки. Страницы жизни игумена Аркадия (Чанк)
Из истории Троице-Сергиева монастыря г. Великие Луки. Страницы жизни игумена Аркадия (Чанк) Финансовая академия при Правительстве Российской Федерации
Финансовая академия при Правительстве Российской Федерации Материальный склад. Объём работы
Материальный склад. Объём работы Технология подготовки и проведенияпрезентаций
Технология подготовки и проведенияпрезентаций Дисковая подсистема компьютера
Дисковая подсистема компьютера