Содержание
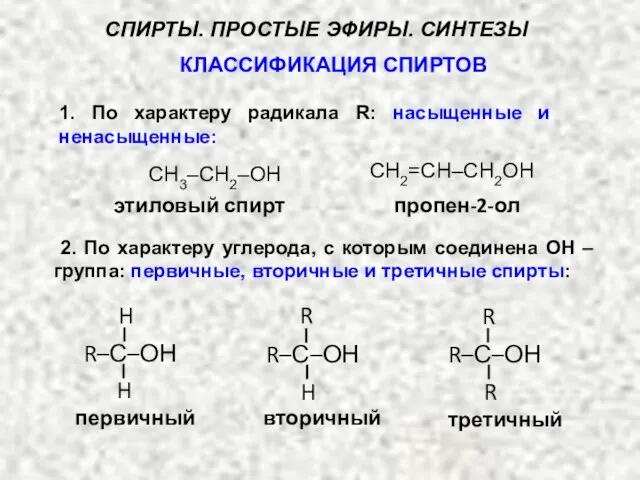
- 2. 2. По характеру углерода, с которым соединена ОН – группа: первичные, вторичные и третичные спирты: первичный
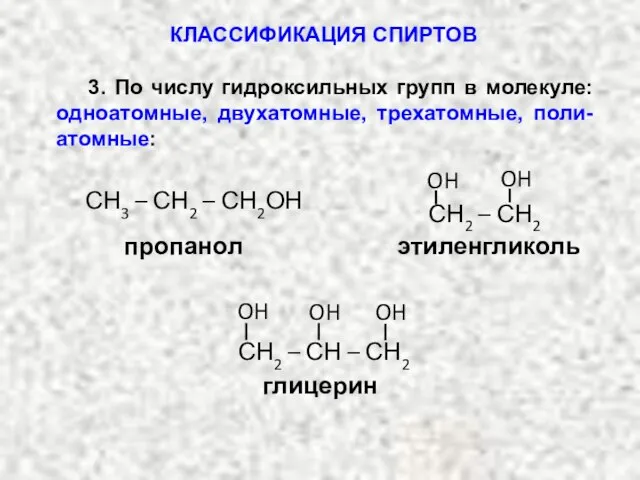
- 3. 3. По числу гидроксильных групп в молекуле: одноатомные, двухатомные, трехатомные, поли-атомные: пропанол СН3 – СН2 –
- 4. НОМЕНКЛАТУРА СПИРТОВ 1. Рациональная номенклатура: спирты называют по радикалу, связанному с ОН – группой: СН3ОН метиловый
- 5. СН3ОН метанол СН3–СН–СН3 СН3–СН2–СН– СН2СН3 пропанол-2 OH CH2OH НОМЕНКЛАТУРА СПИРТОВ СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ 2. Заместительная
- 6. СН3 – ОН карбинол СН3 – СН – ОН НОМЕНКЛАТУРА СПИРТОВ СПИРТЫ. ПРОСТЫЕ ЭФИРЫ. СИНТЕЗЫ 3.
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА СПИРТОВ СН3 – СН3 ………….. 30 - 88,5 СН3 – Сl……………. 50,5 - 24,2
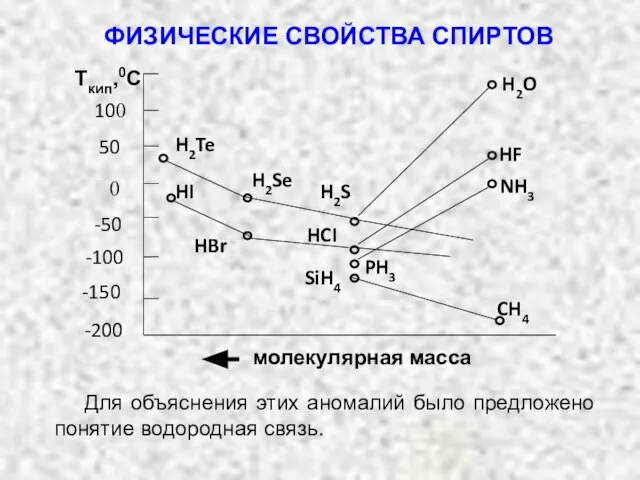
- 8. Влияние водородной связи на температуру кипения: «В группах периодической системы уменьшение молекулярной массы в ряду однотипных
- 9. молекулярная масса 50 100 -50 -100 -150 -200 0 Tкип,0С Для объяснения этих аномалий было предложено
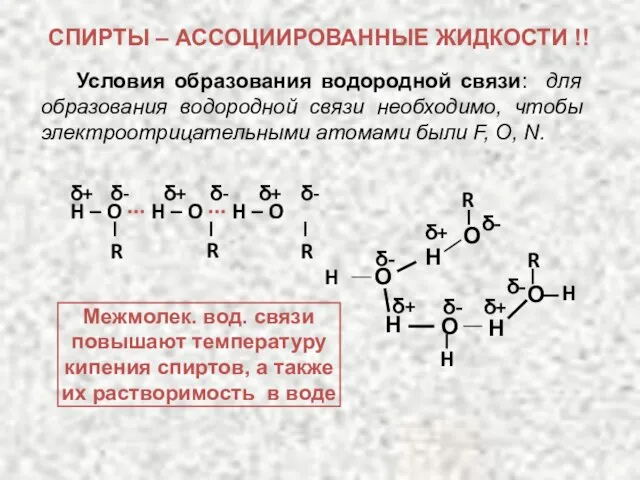
- 10. ВОДОРОДНАЯ СВЯЗЬ Атом водорода служит мостиком между двумя электроотрицательными атомами, причем с одним из них он
- 11. Условия образования водородной связи: для образования водородной связи необходимо, чтобы электроотрицательными атомами были F, O, N.
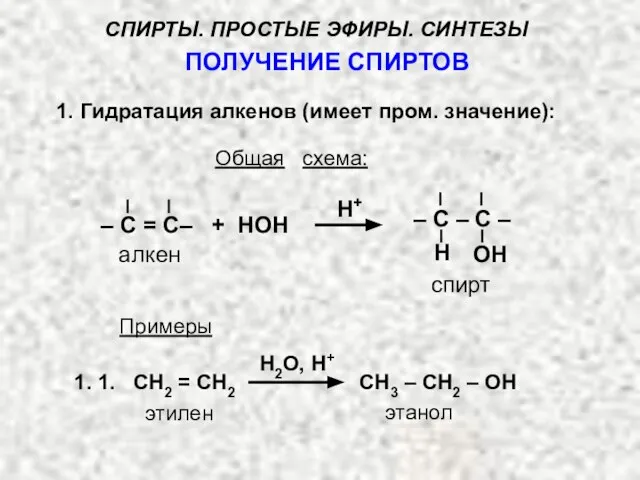
- 12. ПОЛУЧЕНИЕ СПИРТОВ 1. Гидратация алкенов (имеет пром. значение): Общая схема: Н+ алкен спирт – С =
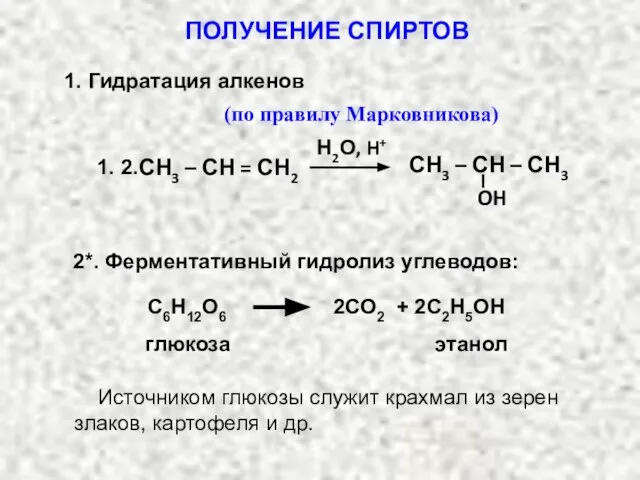
- 13. Н2О, H+ СН3 – СН – СН3 OH СН3 – СН = СН2 1. 2. (по
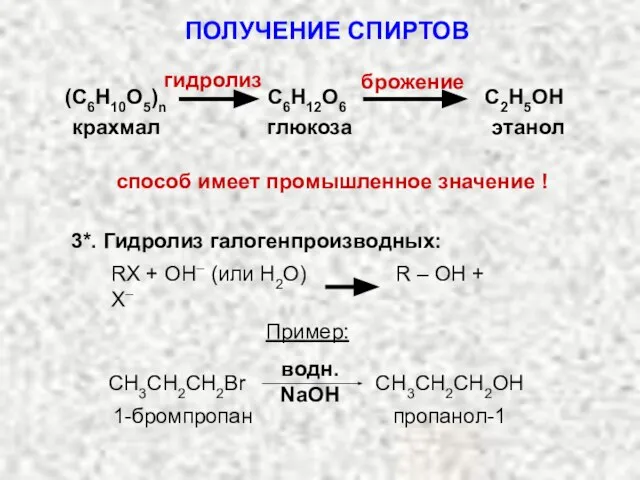
- 14. (С6Н10О5)n С6Н12О6 С2Н5ОН гидролиз брожение крахмал глюкоза этанол способ имеет промышленное значение ! 3*. Гидролиз галогенпроизводных:
- 15. Условия реакции галогенпроизводных с NaOH: 1) водный ра-р NaOH – замещение 2) спиртовый ра-р NaOH –
- 16. Альдегиды восстанавливаются в первичные спирты, кетоны дают вторичные спирты. [2Н] альдегид R – СН2ОН первичный спирт
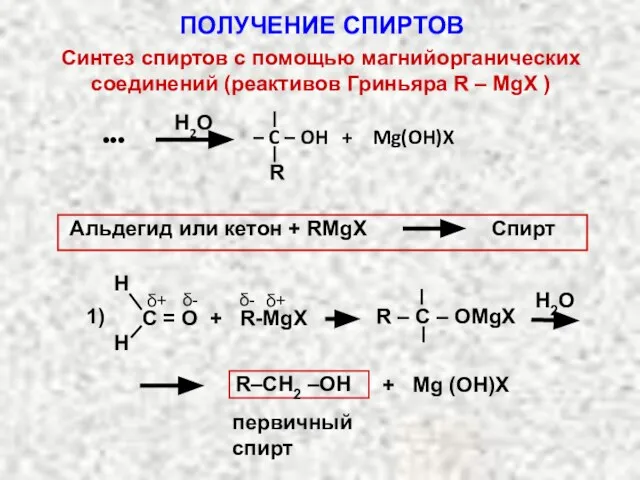
- 17. Синтез спиртов с помощью магнийорганических соединений (реактивов Гриньяра R – MgX ) Реактив Гриньяра RMgX получают
- 18. Н2О R – C – OH + Mg(OH)X Альдегид или кетон + RMgX Спирт Н2О R
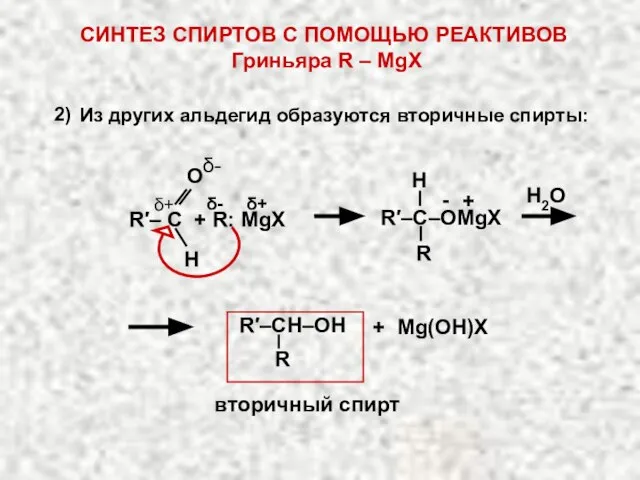
- 19. Н2О R Н R′–C–OMgX δ- δ+ δ+ Н О δ- R′– C + R: MgX 2)
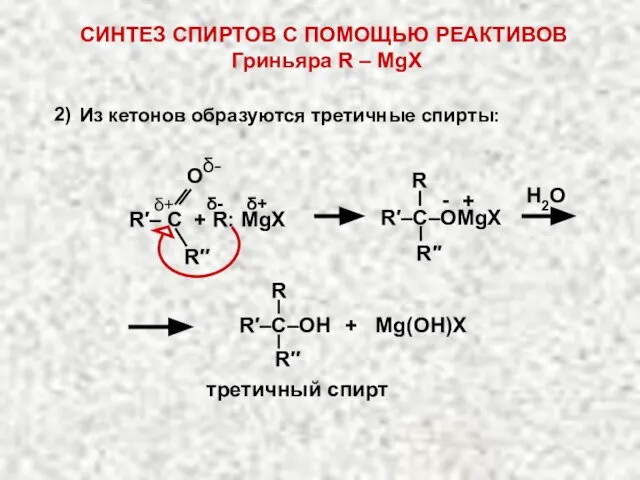
- 20. Н2О R′′ R R′–C–OMgX δ- δ+ δ+ R′′ О δ- R′– C + R: MgX 2)
- 21. ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ Предложите схему возможного в лаборатории синтеза приведенных ниже соединений, исходя из н
- 22. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ Химия спиртов определяется их функциональной группой – гидроксильной группой ОН. Для спиртов характерны
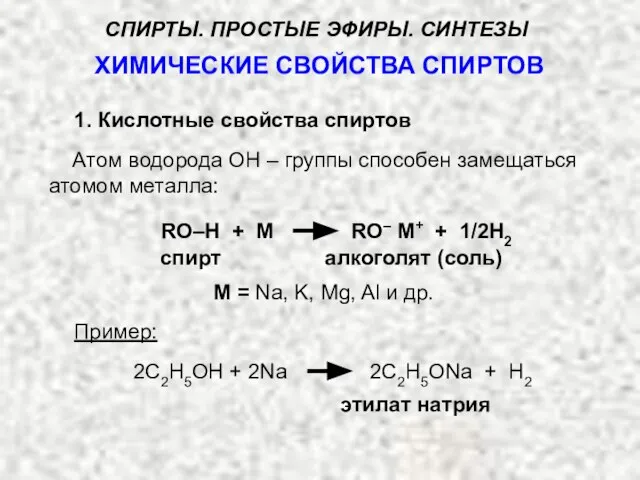
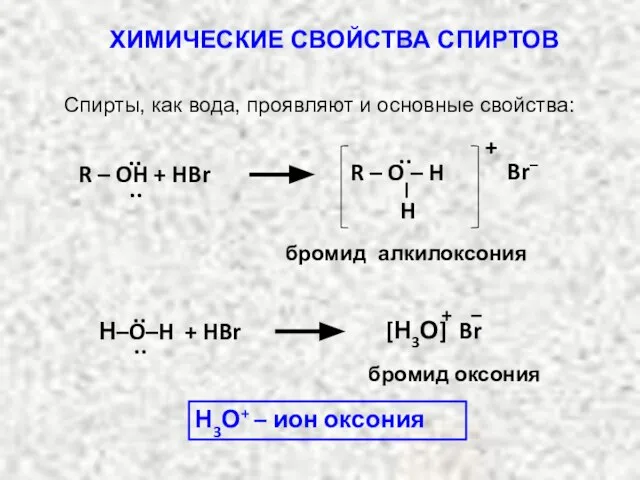
- 23. ХИМИЧЕСКИЕ СВОЙСТВА СПИРТОВ Атом водорода ОН – группы способен замещаться атомом металла: RO–H + M RO–
- 24. Алкоголяты легко разлагаются водой, что указывает на то, что спирты – более слабые кислоты, чем вода!
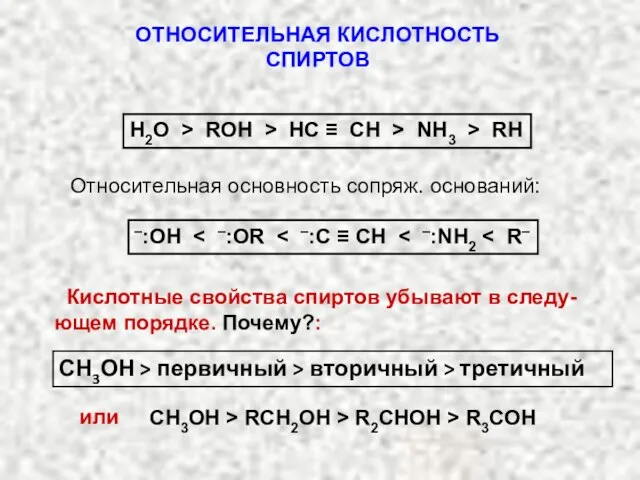
- 25. ОТНОСИТЕЛЬНАЯ КИСЛОТНОСТЬ СПИРТОВ Н2О > ROH > HC ≡ CH > NH3 > RН Относительная основность
- 26. ОБЩИЕ ЗАКОНОМЕРНОСТИ: сопряженная сопряженное протон Н+ :А– + A–H Кислотность кислоты АН зависит от того, насколько
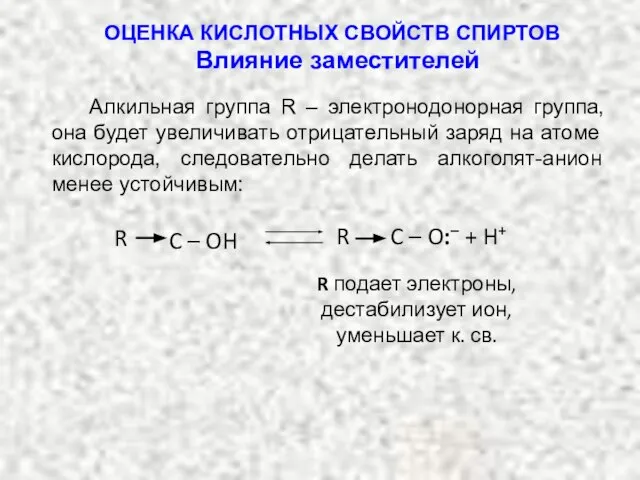
- 27. Алкильная группа R – электронодонорная группа, она будет увеличивать отрицательный заряд на атоме кислорода, следовательно делать
- 28. бромид алкилоксония ·· ·· + Br– ·· H R – O – H R – OH
- 29. 2. Образование простых эфиров R–О – R′ При взаимодействии алкоголятов (вернее алкоголят-ионов) с алкилгалогенидами получают простые
- 30. ПРОСТЫЕ ЭФИРЫ Простые эфиры – химически малоактивные соединения. Разбавленные кислоты, щелочи, Na, на холоду на них
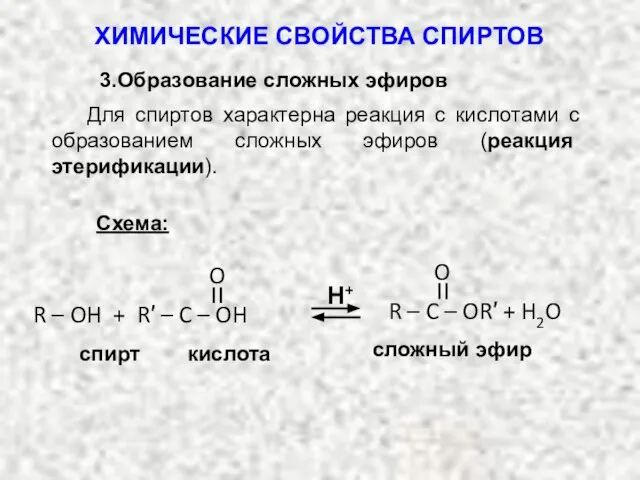
- 31. Для спиртов характерна реакция с кислотами с образованием сложных эфиров (реакция этерификации). Схема: Н+ спирт кислота
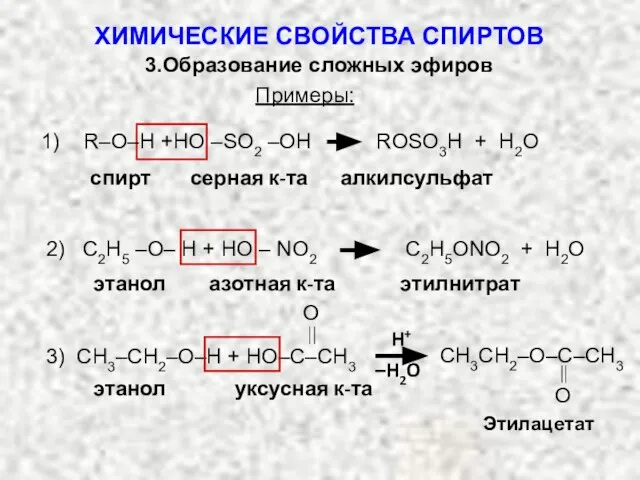
- 32. Примеры: 1) R–O–H +HO –SO2 –OH ROSO3Н + H2O спирт серная к-та алкилсульфат 2) С2Н5 –О–
- 33. Реакции с разрывом связи С – О: 4. Замещение OH – группы галогеном: R – X
- 34. Механизм взаимодействия спиртов с галогеноводородами: факты: 1. Реакция катализируется кислотами 2. Порядок изменения реакционной способности спиртов
- 35. 1. По SN1 – механизму: для всех спиртов исключая метанол и первичные спирты. Реакции предшествует предварительная
- 36. SN2 – механизм: характерен для метанола и большинства первичных спиртов. Предварительная стадия: H + + :X–
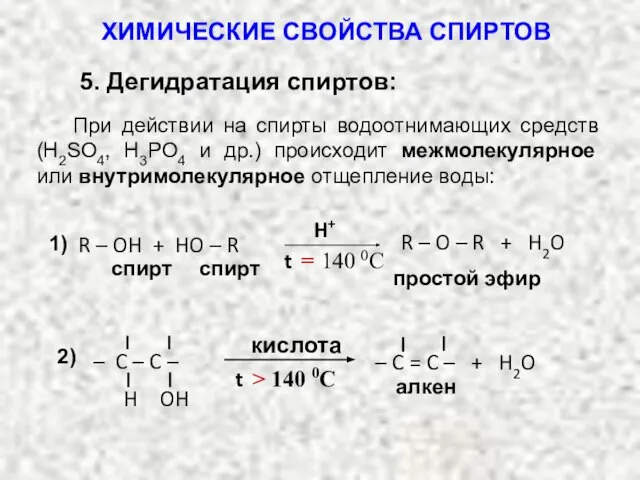
- 37. 5. Дегидратация спиртов: При действии на спирты водоотнимающих средств (H2SO4, H3PO4 и др.) происходит межмолекулярное или
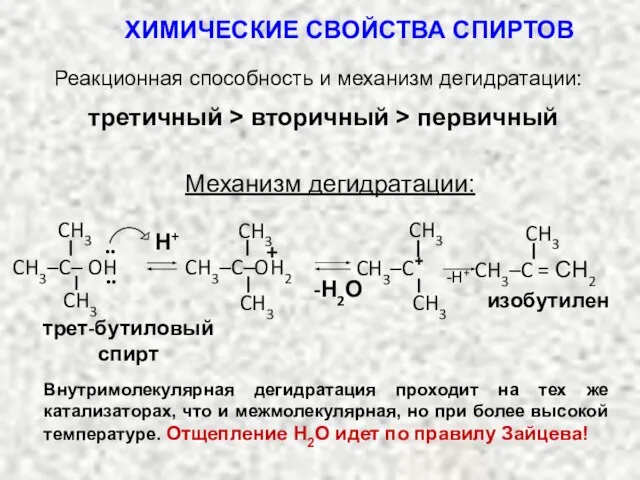
- 38. Реакционная способность и механизм дегидратации: третичный > вторичный > первичный Механизм дегидратации: трет-бутиловый спирт Н+ -Н2О
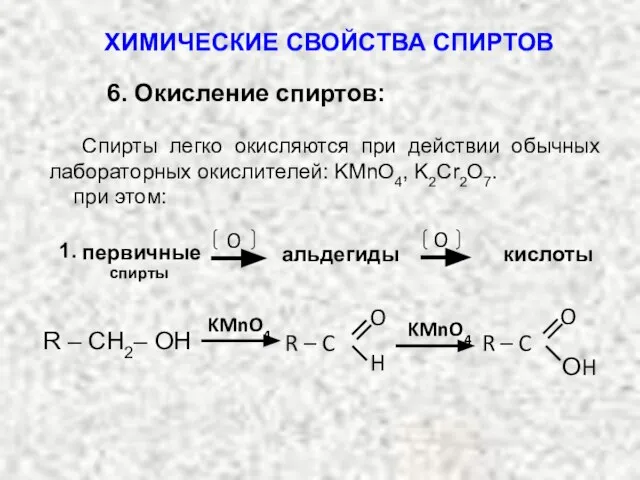
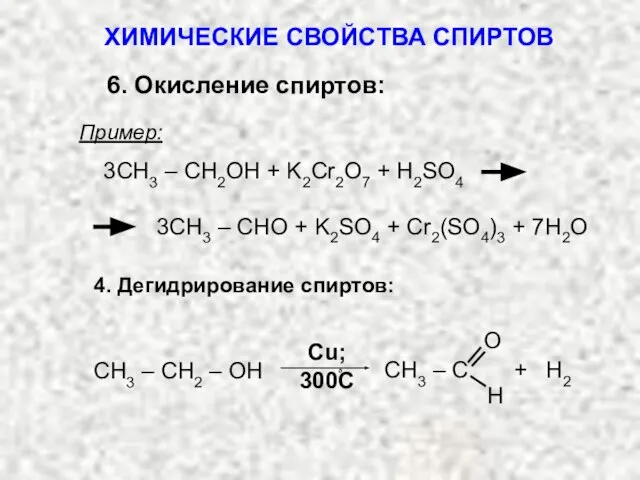
- 39. 6. Окисление спиртов: Спирты легко окисляются при действии обычных лабораторных окислителей: KMnO4, K2Cr2O7. при этом: 1.
- 40. 3. Третичные спирты устойчивы к окислению, но в жестких условиях происходит разрыв углерод-углеродной связи с образованием
- 41. Пример: 3СH3 – CH2OH + K2Cr2O7 + H2SO4 3CH3 – CHO + K2SO4 + Cr2(SO4)3 +
- 42. СПИРТЫ. ЭФИРЫ. СИНТЕЗЫ МНОГОТОМНЫЕ СПИРТЫ Этиленгликоль – представитель двухатомных спиртов –гликолей (диолов) (Т. кип. 197 ْС)
- 43. Гликоли (диолы) – спирты с двумя гидроксиль-ными группами при разных углеродных атомах. Общая формула СnH2n(OH)2 Триолы
- 44. Многоатомные спирты хорошо растворимы в воде, но плохо – в органических растворителях; они имеют высокие температуры
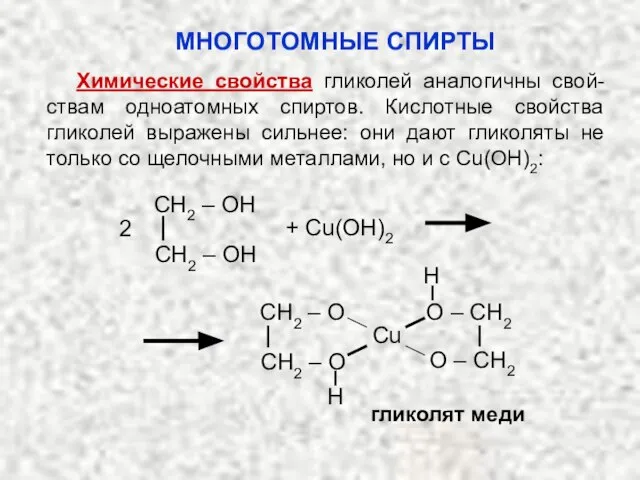
- 45. Химические свойства гликолей аналогичны свой-ствам одноатомных спиртов. Кислотные свойства гликолей выражены сильнее: они дают гликоляты не
- 46. ГЛИЦЕРИН МНОГОТОМНЫЕ СПИРТЫ Водный 50%-й раствор этиленгликоля используют в качестве антифриза. (Т. замерз. -34 ْ С);
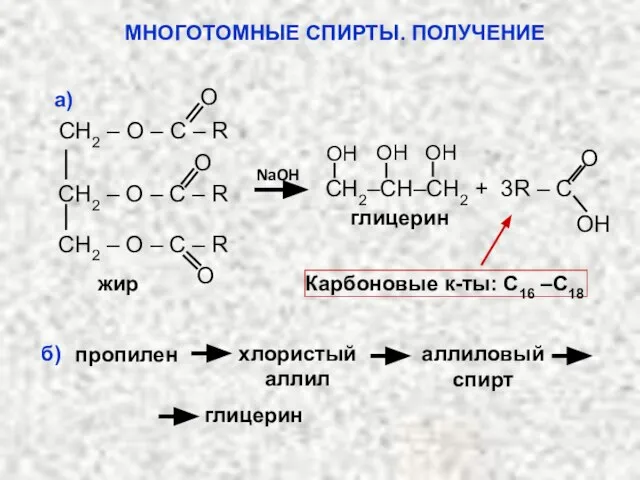
- 47. NaOH Карбоновые к-ты: С16 –С18 глицерин OH O СН2–CH–СН2 + 3R – C жир O СН2
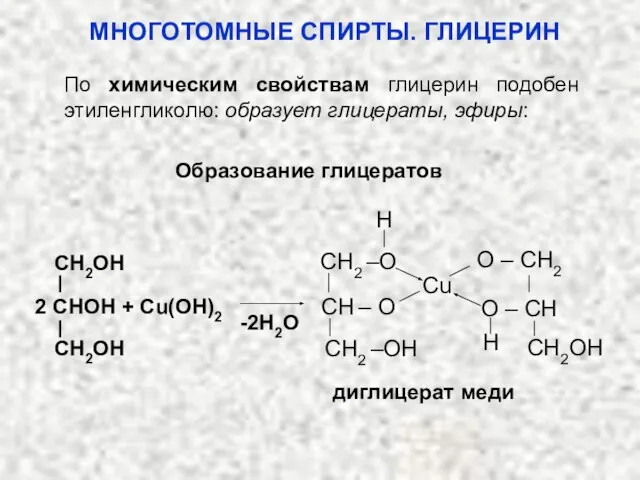
- 48. Образование глицератов диглицерат меди -2H2O 2 CHOH + Cu(OH)2 CH2OH CH2OH H H CH2OH O –
- 49. тринитроглицерин (динамит) HONO2 [H2SO4] ONO2 ONO2 ONO2 СН2 – CH – СН2 + 3H2O OH OH
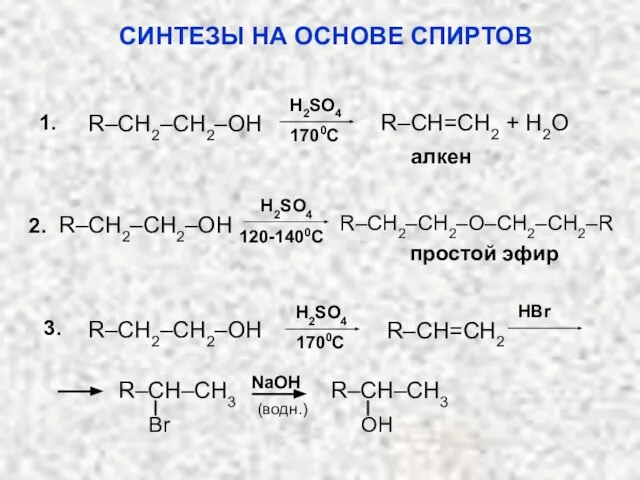
- 50. СИНТЕЗЫ НА ОСНОВЕ СПИРТОВ 1700C алкен R–CH=CH2 + H2O R–CH2–CH2–OH 1. H2SO4 2. H2SO4 120-1400C R–CH2–CH2–OH
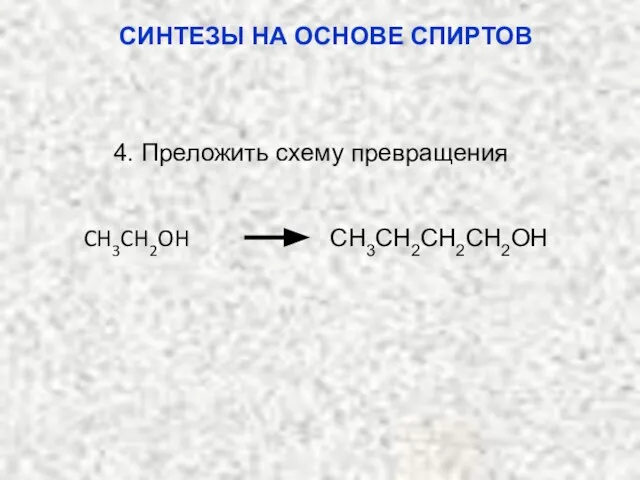
- 51. СИНТЕЗЫ НА ОСНОВЕ СПИРТОВ 4. Преложить схему превращения CH3CH2OH CH3CH2CH2CH2OH
- 52. H2SO4 O2 -H2O O CH2 H2C [Ag+] CH2=CH2 CH3CH2OH СИНТЕЗЫ НА ОСНОВЕ СПИРТОВ Решение задания 4
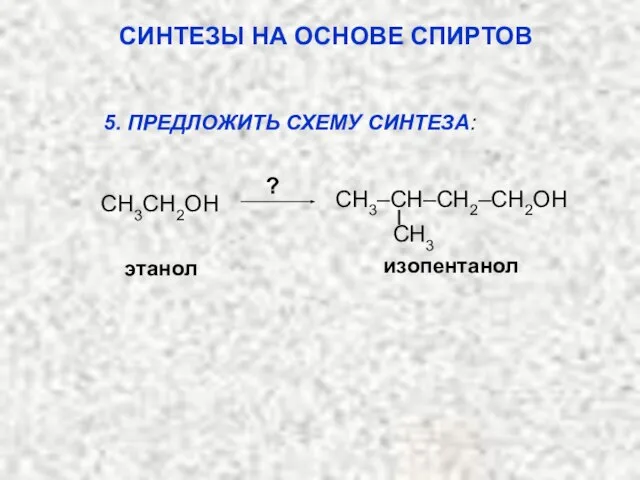
- 53. этанол ? изопентанол 5. ПРЕДЛОЖИТЬ СХЕМУ СИНТЕЗА: СИНТЕЗЫ НА ОСНОВЕ СПИРТОВ CH3CH2OH CH3 CH3–CH–CH2–CH2OH
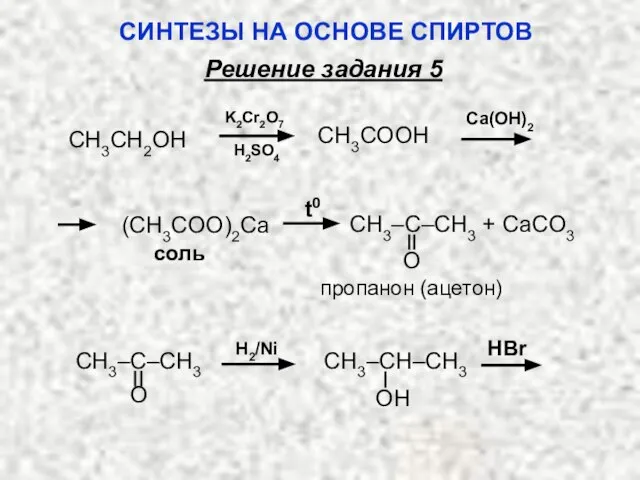
- 54. H2SO4 Ca(OH)2 K2Cr2O7 CH3COOH CH3CH2OH соль пропанон (ацетон) t0 CH3–C–CH3 + CaCO3 O (CH3COO)2Ca H2/Ni HBr
- 55. HBr Mg СH3 эфир CH3–CH–MgBr CH3–CH–CH3 H2O – CH3 CH3–CH–CH2–CH2–OMgBr [H+] CH3 CH3–CH–CH2–CH2OH СИНТЕЗЫ НА ОСНОВЕ
- 57. Скачать презентацию







![Альдегиды восстанавливаются в первичные спирты, кетоны дают вторичные спирты. [2Н] альдегид R](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389081/slide-15.jpg)
















![тринитроглицерин (динамит) HONO2 [H2SO4] ONO2 ONO2 ONO2 СН2 – CH – СН2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389081/slide-48.jpg)
![H2SO4 O2 -H2O O CH2 H2C [Ag+] CH2=CH2 CH3CH2OH СИНТЕЗЫ НА ОСНОВЕ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389081/slide-51.jpg)
![HBr Mg СH3 эфир CH3–CH–MgBr CH3–CH–CH3 H2O – CH3 CH3–CH–CH2–CH2–OMgBr [H+] CH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389081/slide-54.jpg)
 Древняя история славян: расселение, занятия, религия и общественный строй
Древняя история славян: расселение, занятия, религия и общественный строй Электролиз расплавов и растворов
Электролиз расплавов и растворов День Русской Тельняшки. Игра Нас мало, но мы в тельняшках
День Русской Тельняшки. Игра Нас мало, но мы в тельняшках Они первыми открыли путь к звёздам
Они первыми открыли путь к звёздам Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Дистанционный арт-моб, посвященный Дню народного единства Вместе – целая страна!
Дистанционный арт-моб, посвященный Дню народного единства Вместе – целая страна! Презентация на тему И я любил Всем напряженьем душевных сил. М.Ю.Лермонтов
Презентация на тему И я любил Всем напряженьем душевных сил. М.Ю.Лермонтов  У истоков детской литературы
У истоков детской литературы О компании
О компании Виды деятельности
Виды деятельности ЗАЩИТА ПРАВ ПАЦИЕНТОВ
ЗАЩИТА ПРАВ ПАЦИЕНТОВ Презентация на тему Двугранный угол
Презентация на тему Двугранный угол Содержание - Покрытие ТНТ по Москве - ТНТ – самая интересная аудитория - Рекламные возможности на ТНТ - Москва.
Содержание - Покрытие ТНТ по Москве - ТНТ – самая интересная аудитория - Рекламные возможности на ТНТ - Москва. Методика силовой тренировки. Лекция 3
Методика силовой тренировки. Лекция 3 МЕХ Выполнила: студентка 1-ого курса ФТД группы Т-116с Цьопа Дарья
МЕХ Выполнила: студентка 1-ого курса ФТД группы Т-116с Цьопа Дарья Эта такая интересная фонетика
Эта такая интересная фонетика Сайт МБУК «ЦБС г.Орска»
Сайт МБУК «ЦБС г.Орска» Итоги VIII Регионального чемпионата Молодые профессионалы (WorldSkills Russia) по компетенции Кирпичная кладка
Итоги VIII Регионального чемпионата Молодые профессионалы (WorldSkills Russia) по компетенции Кирпичная кладка Огневая подготовка. Автомат Калашникова
Огневая подготовка. Автомат Калашникова Русские народные свадебные костюмы
Русские народные свадебные костюмы Программа магистратуры Управление в образовании
Программа магистратуры Управление в образовании Откуда взять клиентов? эффективные решения для интернет-магазинов Першко Мария Пермь, 15 марта 2012.
Откуда взять клиентов? эффективные решения для интернет-магазинов Першко Мария Пермь, 15 марта 2012. Поздравляем
Поздравляем Футбольная школа Атлант. Отчёт о работе с 01.08. по 06.09
Футбольная школа Атлант. Отчёт о работе с 01.08. по 06.09 Экологические взаимоотношения организмов
Экологические взаимоотношения организмов Построение чертежа фартука с нагрудником
Построение чертежа фартука с нагрудником Юрий Алексеевич Гагарин
Юрий Алексеевич Гагарин Садово-парковый ансамбль Петергоф
Садово-парковый ансамбль Петергоф