Содержание
- 2. АЛЬДЕГИДЫ И КЕТОНЫ У альдегидов одна валентность затрачивается на связь с радикалом, вторая – на связь
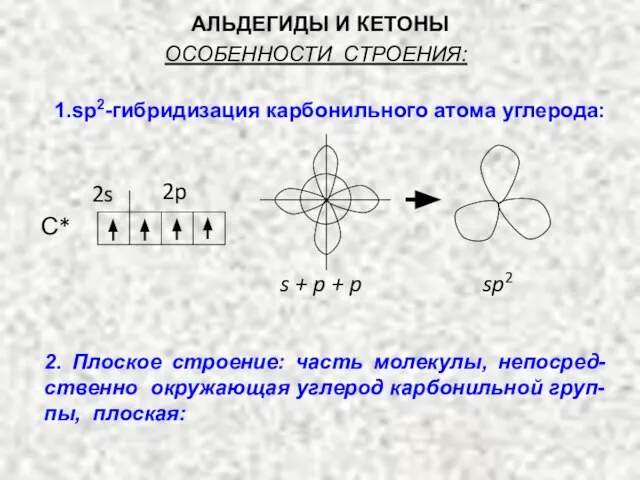
- 3. АЛЬДЕГИДЫ И КЕТОНЫ ОСОБЕННОСТИ СТРОЕНИЯ: 1.sp2-гибридизация карбонильного атома углерода: С* 2s 2p s + p +
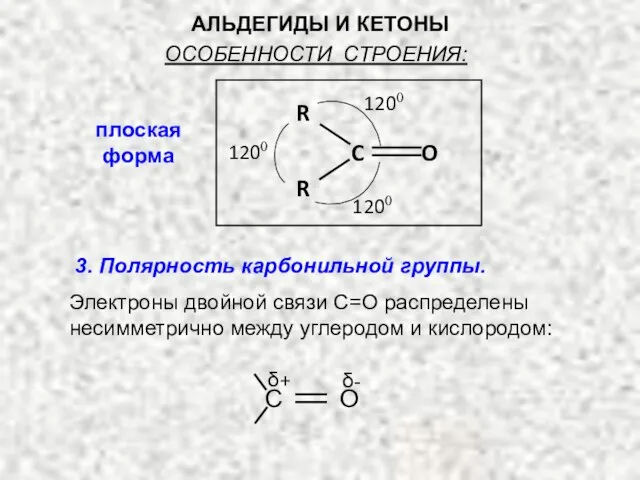
- 4. АЛЬДЕГИДЫ И КЕТОНЫ плоская форма С О δ+ δ- 3. Полярность карбонильной группы. Электроны двойной связи
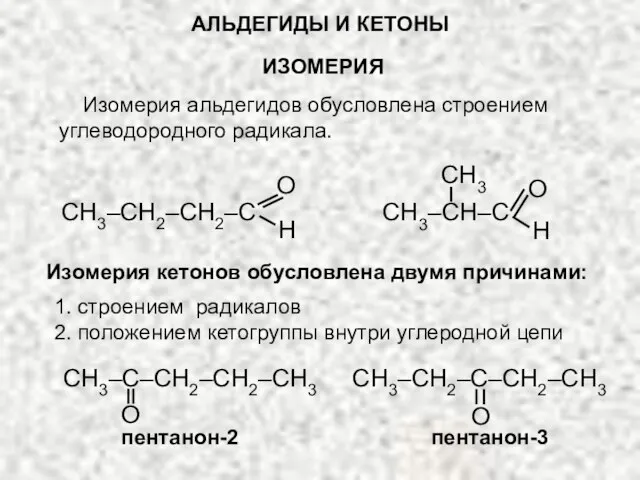
- 5. АЛЬДЕГИДЫ И КЕТОНЫ ИЗОМЕРИЯ Изомерия альдегидов обусловлена строением углеводородного радикала. O H CH3–CH2–CH2–C O H CH3
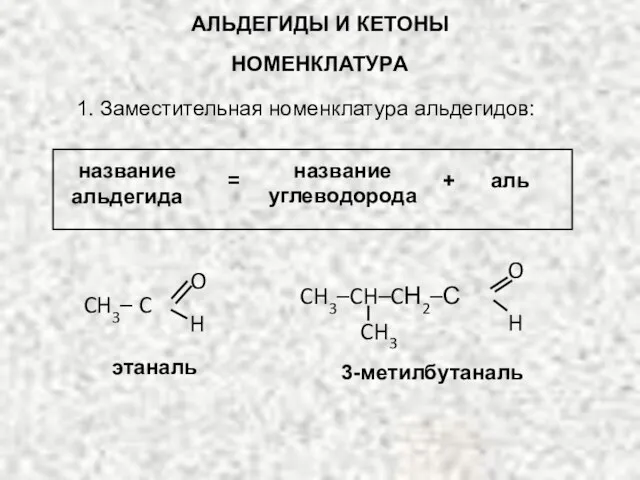
- 6. АЛЬДЕГИДЫ И КЕТОНЫ НОМЕНКЛАТУРА 1. Заместительная номенклатура альдегидов: название альдегида = + аль название углеводорода CH3–
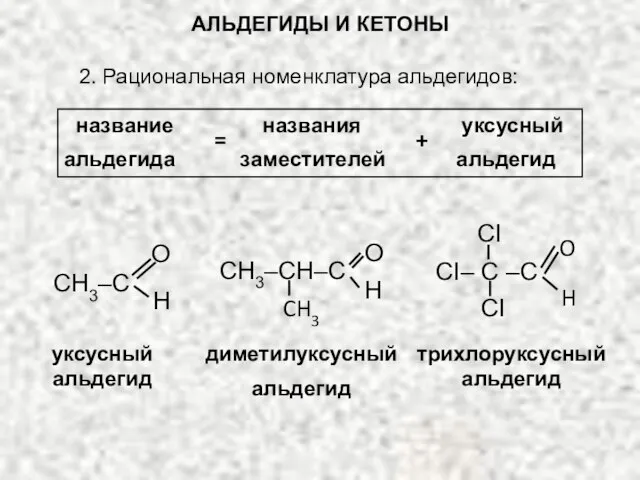
- 7. АЛЬДЕГИДЫ И КЕТОНЫ 2. Рациональная номенклатура альдегидов: = название названия уксусный альдегида заместителей альдегид + CH3–C
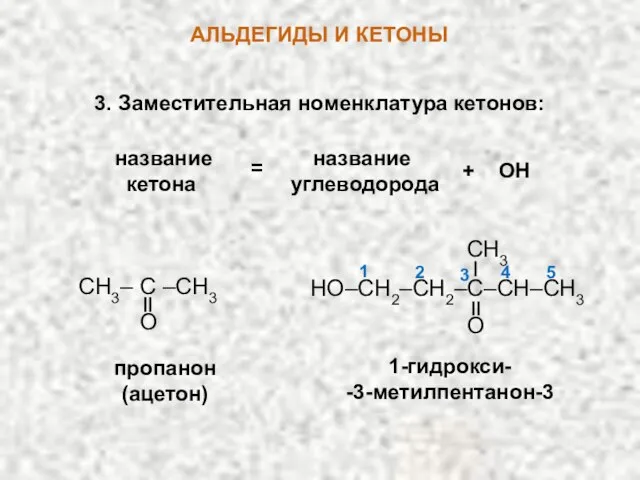
- 8. АЛЬДЕГИДЫ И КЕТОНЫ название название кетона углеводорода = + ОН CH3– C –CH3 O пропанон (ацетон)
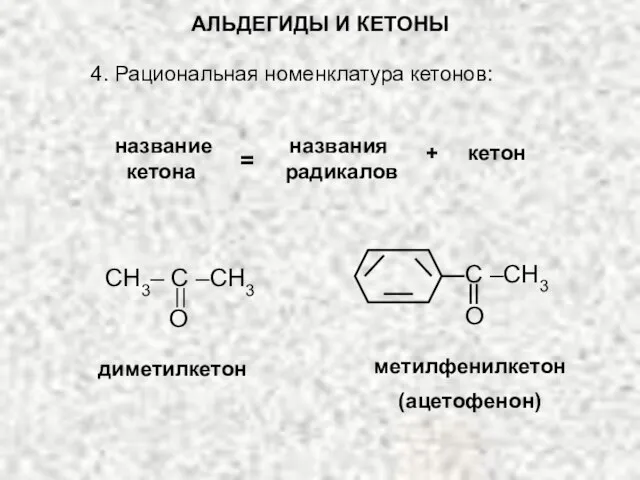
- 9. АЛЬДЕГИДЫ И КЕТОНЫ 4. Рациональная номенклатура кетонов: название названия кетона радикалов = + кетон CH3– C
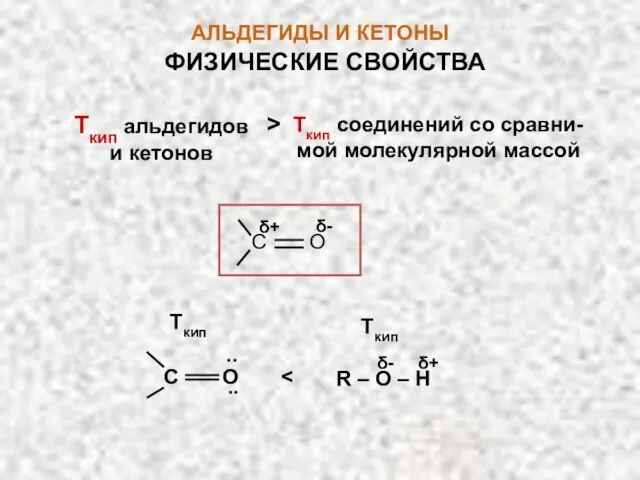
- 10. АЛЬДЕГИДЫ И КЕТОНЫ ФИЗИЧЕСКИЕ СВОЙСТВА Так как альдегиды и кетоны − полярные соединения, они имеют более
- 11. АЛЬДЕГИДЫ И КЕТОНЫ Ткип альдегидов и кетонов Ткип соединений со сравни-мой молекулярной массой > С О
- 12. АЛЬДЕГИДЫ И КЕТОНЫ Растворимость альдегидов и кетонов > до С5 СnH2n+2, CnH2n, CnH2n-2, R-X (X= CI,
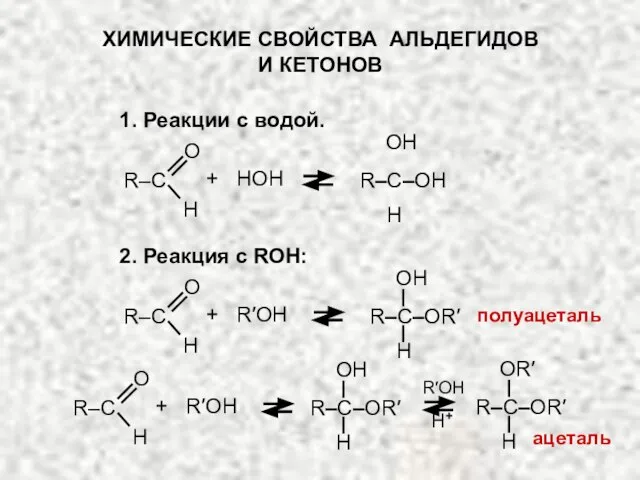
- 13. ХИМИЧЕСКИЕ СВОЙСТВА АЛЬДЕГИДОВ И КЕТОНОВ 1. Реакции с водой. 2. Реакция c ROH: O H H
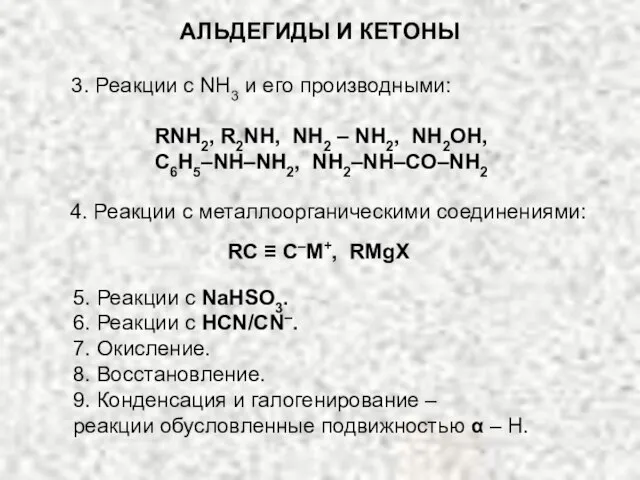
- 14. АЛЬДЕГИДЫ И КЕТОНЫ 3. Реакции с NH3 и его производными: RNH2, R2NH, NH2 – NH2, NH2OH,
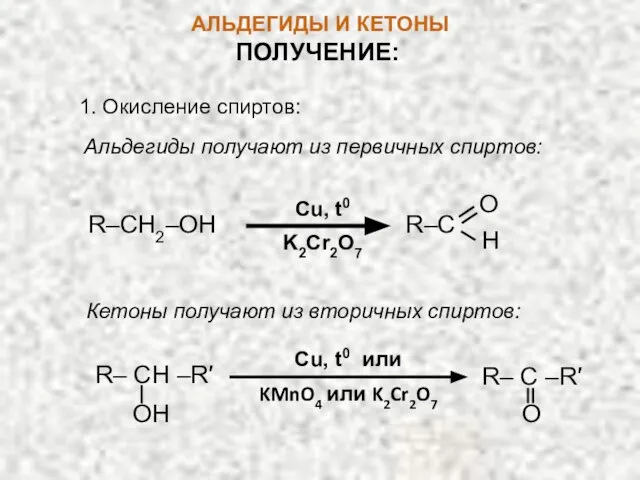
- 15. АЛЬДЕГИДЫ И КЕТОНЫ ПОЛУЧЕНИЕ: 1. Окисление спиртов: Альдегиды получают из первичных спиртов: Cu, t0 K2Cr2O7 R–CH2–OH
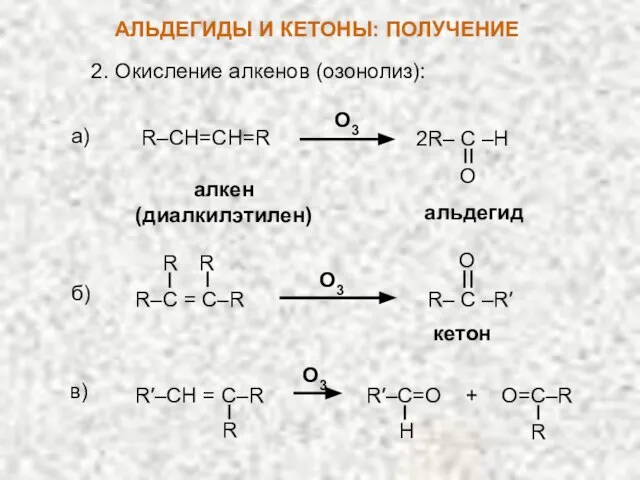
- 16. АЛЬДЕГИДЫ И КЕТОНЫ: ПОЛУЧЕНИЕ 2. Окисление алкенов (озонолиз): а) О3 альдегид 2R– C –H O б)
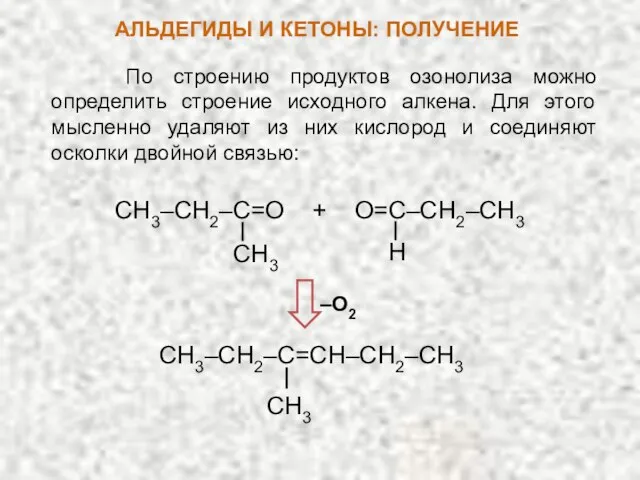
- 17. По строению продуктов озонолиза можно определить строение исходного алкена. Для этого мысленно удаляют из них кислород
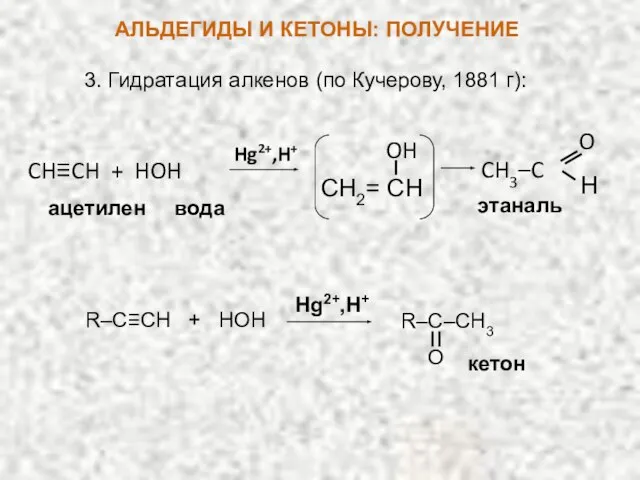
- 18. 3. Гидратация алкенов (по Кучерову, 1881 г): Hg2+,H+ CH≡CH + HOH ацетилен вода CH2= CH OH
- 19. CO + H2 [Co(CO)4]2, t0,P R–CH=CH2 R–CH–C O H CH3 4. Присоединение (СО + Н2) к
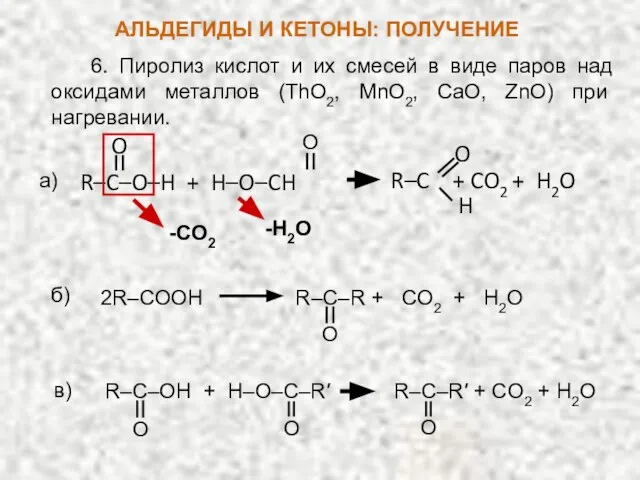
- 20. 6. Пиролиз кислот и их смесей в виде паров над оксидами металлов (ThO2, MnO2, CaO, ZnO)
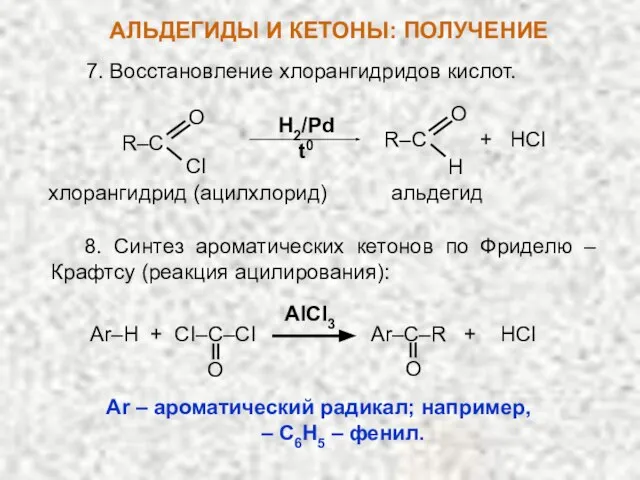
- 21. 7. Восстановление хлорангидридов кислот. H2/Pd t0 R–C O CI H R–C + HCI O альдегид хлорангидрид
- 22. АЛЬДЕГИДЫ И КЕТОНЫ Химия оксосоединений определяется наличием карбонильной группы. ОСОБЕННОСТИ КАРБОНИЛЬНОЙ ГРУППЫ: 2. Карбонильная группа содержит
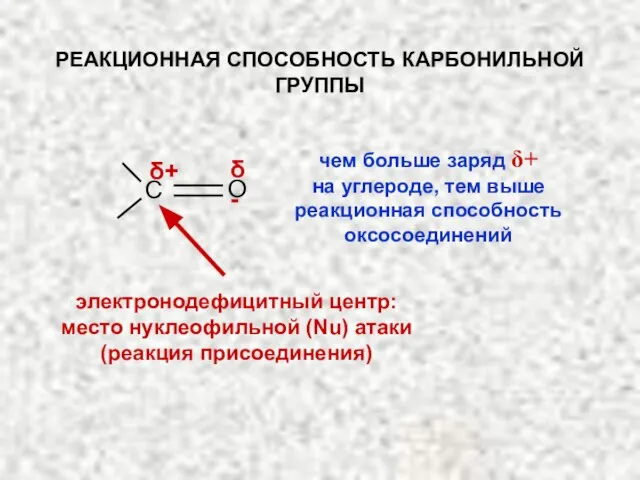
- 23. С О δ+ δ- электронодефицитный центр: место нуклеофильной (Nu) атаки (реакция присоединения) чем больше заряд δ+
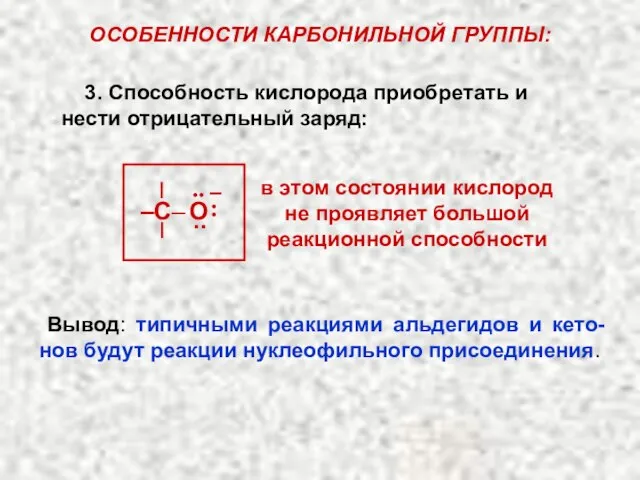
- 24. ОСОБЕННОСТИ КАРБОНИЛЬНОЙ ГРУППЫ: 3. Способность кислорода приобретать и нести отрицательный заряд: в этом состоянии кислород не
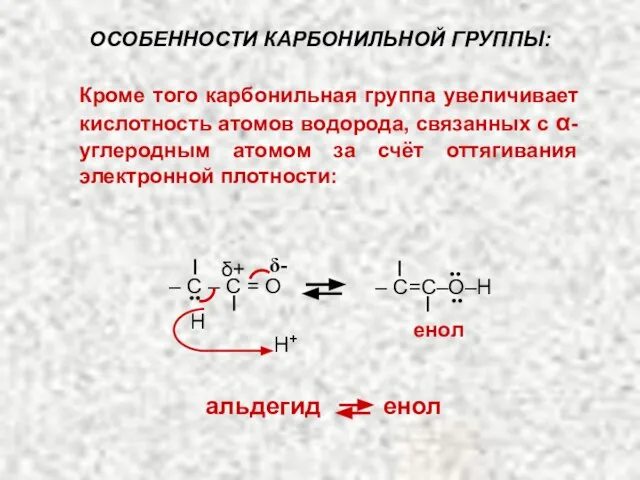
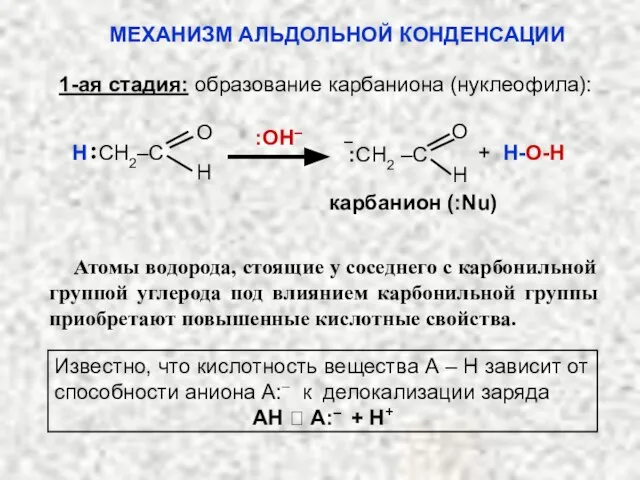
- 25. Кроме того карбонильная группа увеличивает кислотность атомов водорода, связанных с α-углеродным атомом за счёт оттягивания электронной
- 26. ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВ НУКЛЕОФИЛЬНОЕ ПРИСОЕДИНЕНИЕ Процесс протекает ступенчато и начинается с медленной атаки нуклеофила (:Nu−)
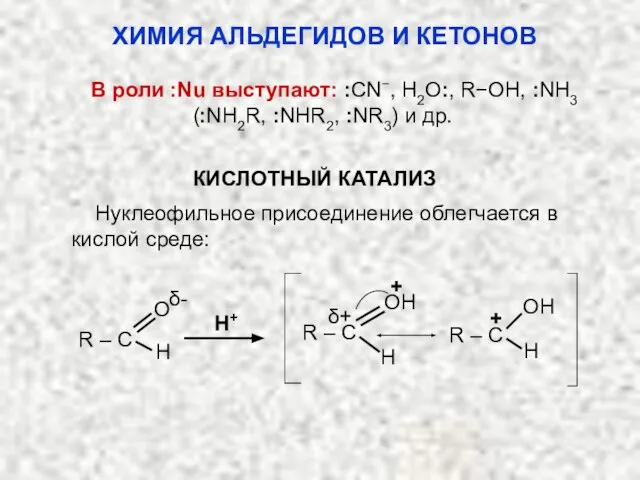
- 27. В роли :Nu выступают: :CN−, H2O:, R−OH, :NH3 (:NH2R, :NHR2, :NR3) и др. КИСЛОТНЫЙ КАТАЛИЗ Нуклеофильное
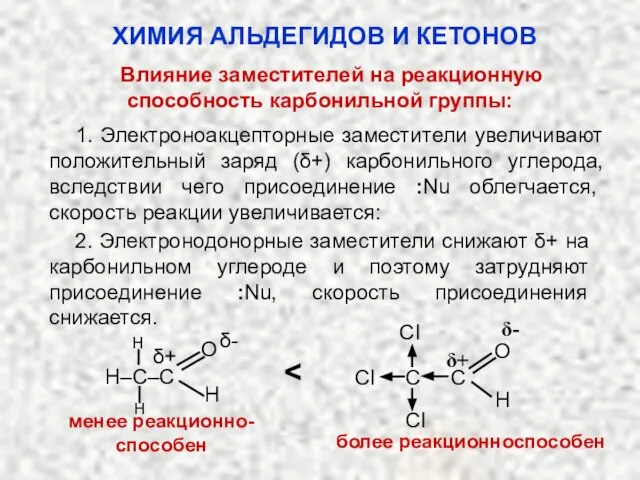
- 28. Влияние заместителей на реакционную способность карбонильной группы: ХИМИЯ АЛЬДЕГИДОВ И КЕТОНОВ 1. Электроноакцепторные заместители увеличивают положительный
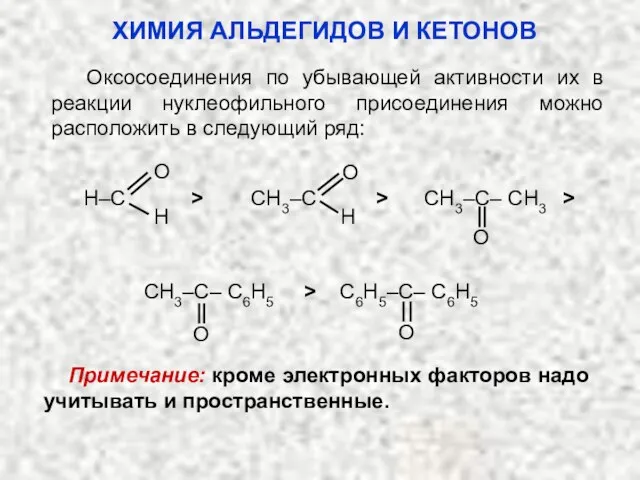
- 29. Оксосоединения по убывающей активности их в реакции нуклеофильного присоединения можно расположить в следующий ряд: H–C >
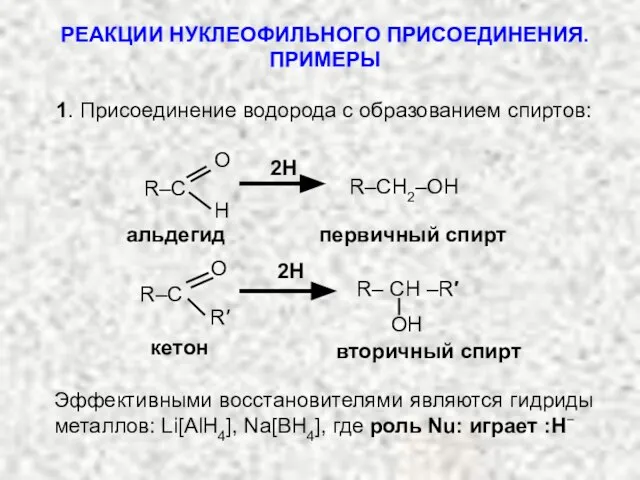
- 30. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ПРИСОЕДИНЕНИЯ. ПРИМЕРЫ 1. Присоединение водорода с образованием спиртов: R–CH2–OH альдегид первичный спирт 2Н R–C
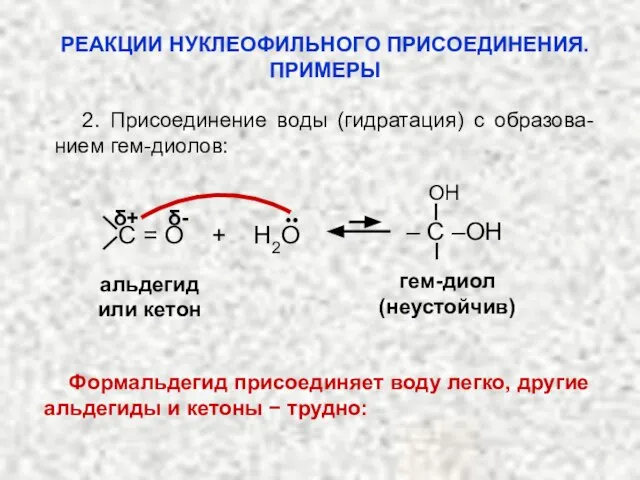
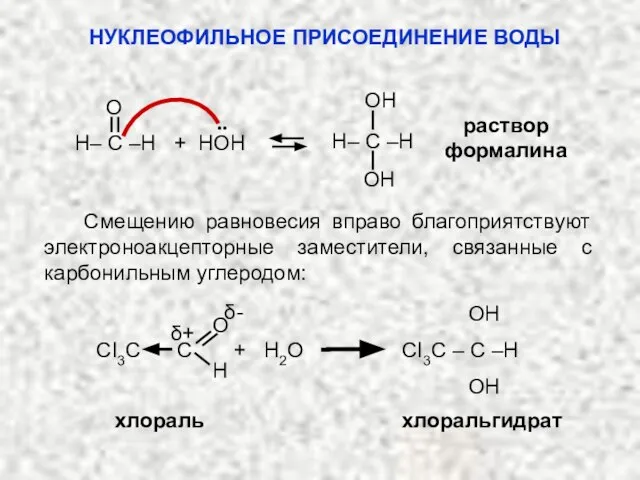
- 31. 2. Присоединение воды (гидратация) с образова-нием гем-диолов: альдегид или кетон гем-диол (неустойчив) δ+ δ- OH ..
- 32. раствор формалина O OH OH H– C –H H– C –H + HOH .. δ+ OH
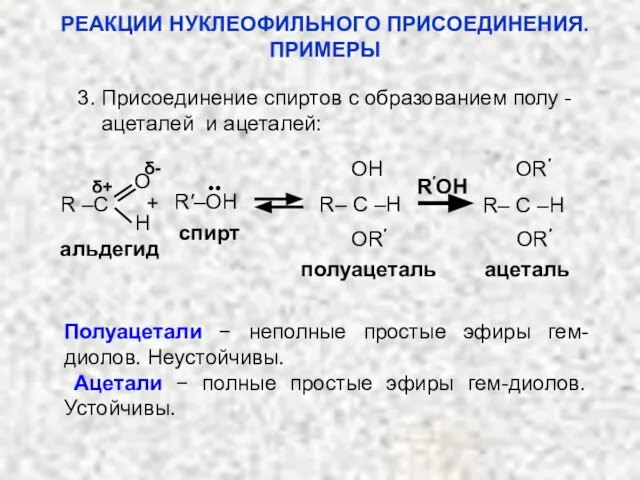
- 33. 3. Присоединение спиртов с образованием полу - ацеталей и ацеталей: альдегид полуацеталь ацеталь δ+ δ- R′OH
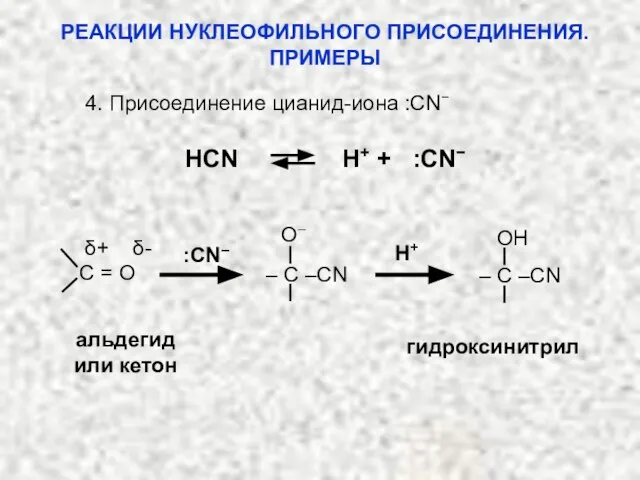
- 34. 4. Присоединение цианид-иона :CN− HCN H+ + :CN− альдегид или кетон гидроксинитрил δ+ δ- :CN– H+
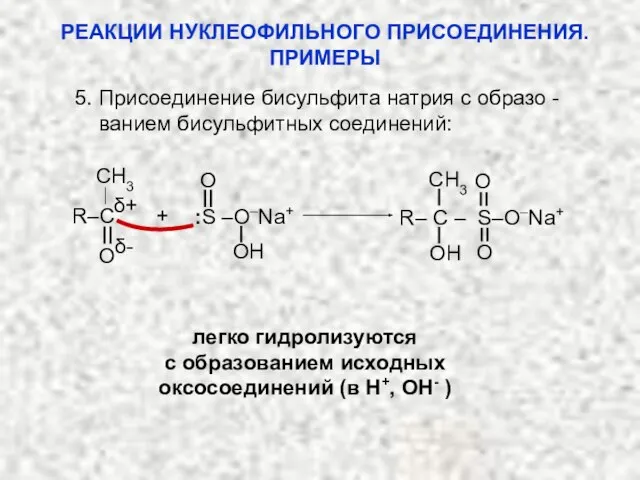
- 35. 5. Присоединение бисульфита натрия с образо - ванием бисульфитных соединений: δ- O OH R–C + O
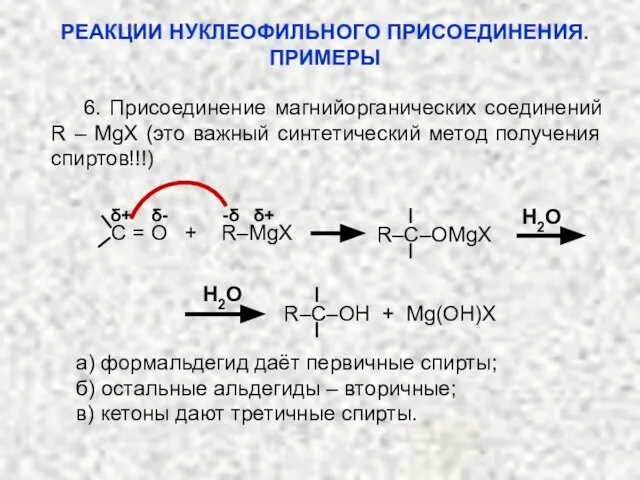
- 36. 6. Присоединение магнийорганических соединений R – MgX (это важный синтетический метод получения спиртов!!!) δ+ δ- -δ
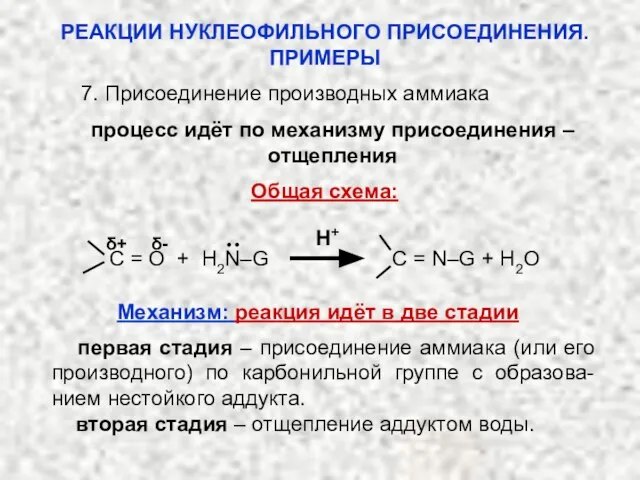
- 37. 7. Присоединение производных аммиака процесс идёт по механизму присоединения – отщепления Общая схема: H+ ·· δ+
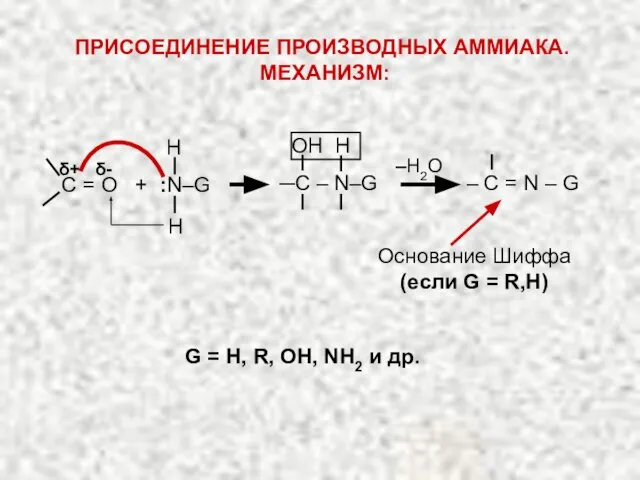
- 38. δ+ δ- ‒H2O Н Н OH H С = О + :N–G ─C – N–G Основание
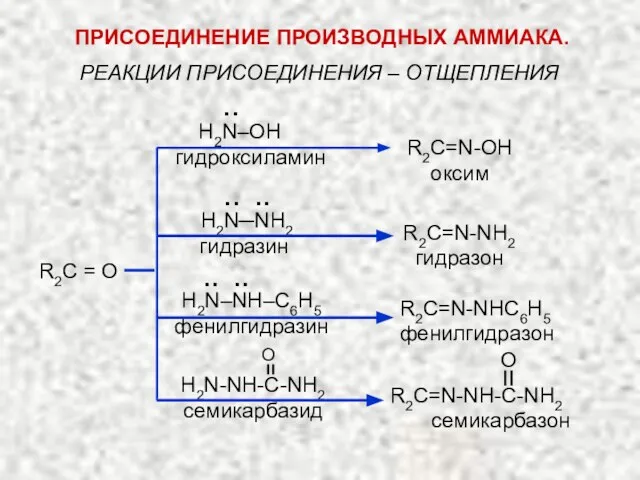
- 39. РЕАКЦИИ ПРИСОЕДИНЕНИЯ – ОТЩЕПЛЕНИЯ R2C = O H2N‒OH гидроксиламин R2C=N-OH оксим H2N─NH2 гидразин R2C=N-NH2 гидразон H2N‒NH‒C6H5
- 40. ПРОДУКТЫ ПРИСОЕДИНЕНИЯ АММИАКА И ЕГО ПРОИЗВОДНЫХ: Оксимы, гидразоны, фенилгидразоны – твёрдые, кристаллические вещества с характерными температурами
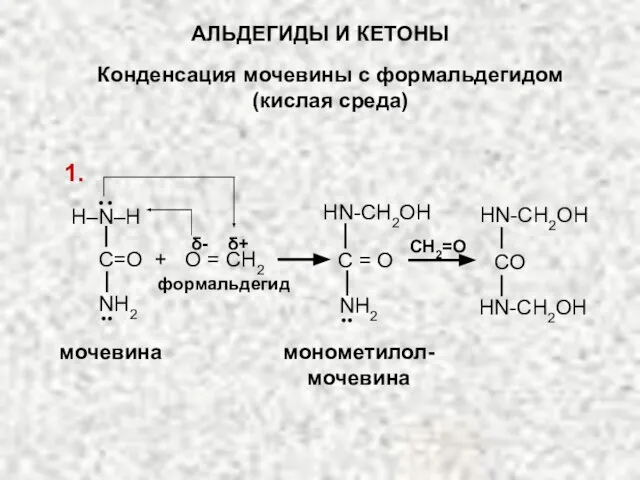
- 41. По механизму присоединения – отщепления происходит поликонденсация мочевины или анилина (а также фенола) с формальдегидом Синтез
- 42. АЛЬДЕГИДЫ И КЕТОНЫ Конденсация мочевины с формальдегидом (кислая среда) CH2=O монометилол- мочевина HN-CH2OH HN-CH2OH HN-CH2OH CO
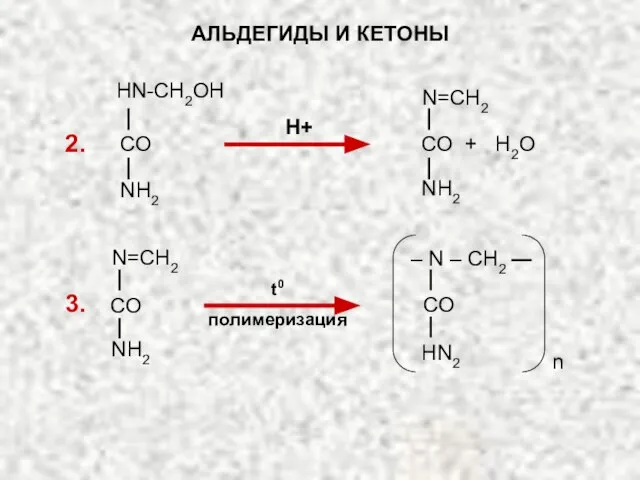
- 43. t0 полимеризация АЛЬДЕГИДЫ И КЕТОНЫ 2. 3. Н+ CO + H2O N=CH2 NH2 CO HN-CH2OH NH2
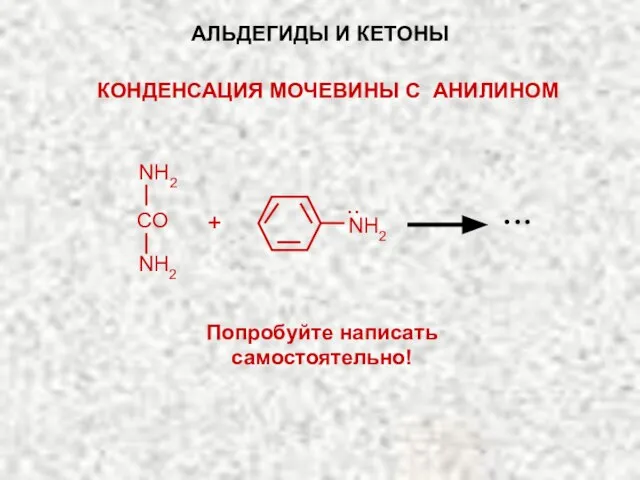
- 44. NH2 Попробуйте написать самостоятельно! АЛЬДЕГИДЫ И КЕТОНЫ КОНДЕНСАЦИЯ МОЧЕВИНЫ С АНИЛИНОМ ·· NH2 NH2 CO +
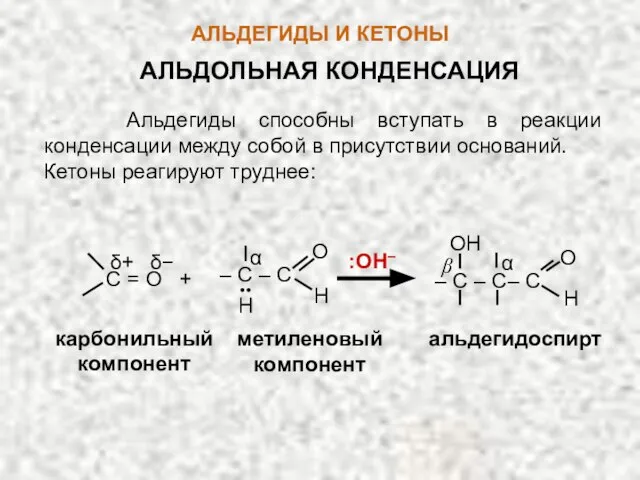
- 45. β АЛЬДЕГИДЫ И КЕТОНЫ АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ Альдегиды способны вступать в реакции конденсации между собой в присутствии
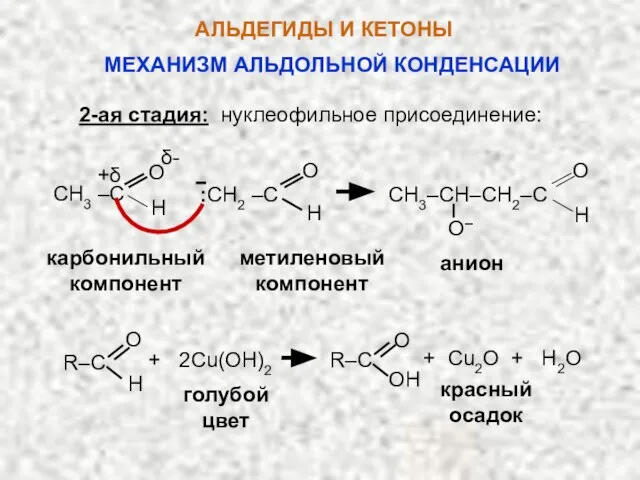
- 46. В этой реакции одна молекула альдегида участвует своей карбонильной группой (карбонильный компонент), другая – α-водородом (метиленовый
- 47. карбанион (:Nu) О Н :OH– О Н CH2‒C :CH2 –C + H-O-Н Атомы водорода, стоящие у
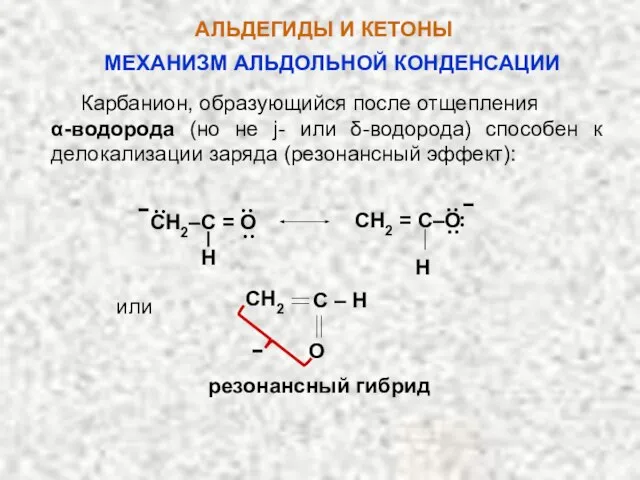
- 48. АЛЬДЕГИДЫ И КЕТОНЫ Карбанион, образующийся после отщепления α-водорода (но не j- или δ-водорода) способен к делокализации
- 49. 2-ая стадия: нуклеофильное присоединение: O– карбонильный компонент метиленовый компонент анион О О +δ δ- Н CH3
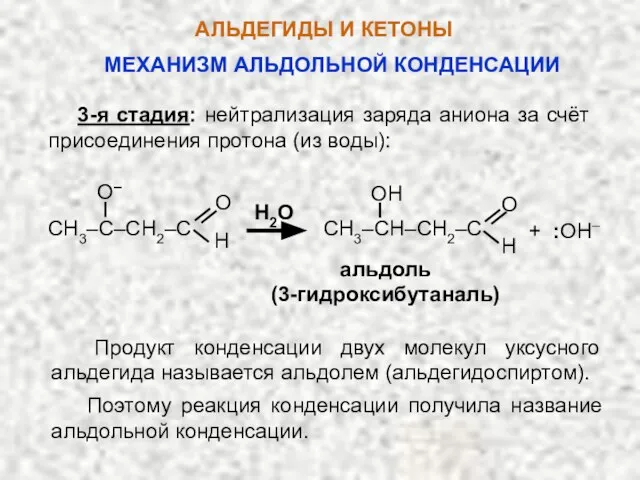
- 50. АЛЬДЕГИДЫ И КЕТОНЫ 3-я стадия: нейтрализация заряда аниона за счёт присоединения протона (из воды): H2O альдоль
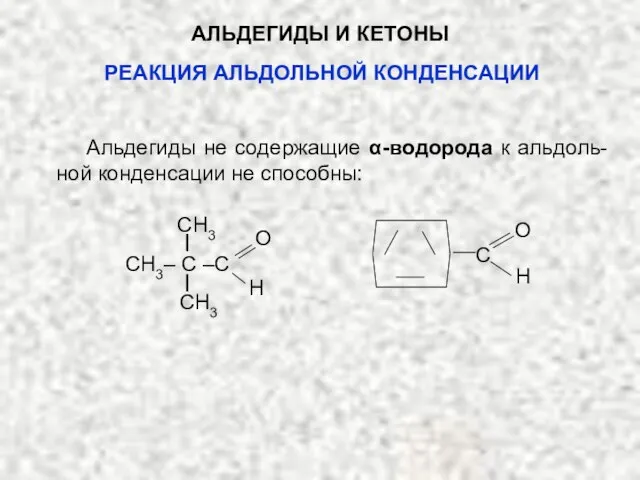
- 51. АЛЬДЕГИДЫ И КЕТОНЫ Альдегиды не содержащие α-водорода к альдоль-ной конденсации не способны: CH3 CH3 H O
- 52. альдегид кислота O H O OH R–C R–C + 2[Ag(NH3)2] + 2Ag↓+ 4NH3+ H2O РЕАКЦИЯ СЕРЕБРЯНОГО
- 53. Кетоны этих реакций не дают. Они устойчивы к слабым окислителям и к кислороду воздуха. Сильные окислители
- 55. Скачать презентацию



![CO + H2 [Co(CO)4]2, t0,P R–CH=CH2 R–CH–C O H CH3 4. Присоединение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389082/slide-18.jpg)





![альдегид кислота O H O OH R–C R–C + 2[Ag(NH3)2] + 2Ag↓+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389082/slide-51.jpg)

 Интернет ресурсы по правам потребителя
Интернет ресурсы по правам потребителя Рукокрылые
Рукокрылые Health is the Greatest wealth
Health is the Greatest wealth Красноярские художники XXI века
Красноярские художники XXI века Как мы влюбляемся? И почему?
Как мы влюбляемся? И почему? Великобритания
Великобритания Кредитный потребительский кооператив «ПЕРВЫЙ ДАЛЬНЕВОСТОЧНЫЙ»
Кредитный потребительский кооператив «ПЕРВЫЙ ДАЛЬНЕВОСТОЧНЫЙ» Загрязнение вод
Загрязнение вод ОСНОВЫ РЕЛИГИОЗНЫХ КУЛЬТУР И СВЕТСКОЙ ЭТИКИ
ОСНОВЫ РЕЛИГИОЗНЫХ КУЛЬТУР И СВЕТСКОЙ ЭТИКИ Краткий словарь современных профессий
Краткий словарь современных профессий Sibnet.ru сибирский информационно-развлекательный портал. более 4 000 000 уникальных пользователей в месяц* более 2 500 000 просмотров ежесут
Sibnet.ru сибирский информационно-развлекательный портал. более 4 000 000 уникальных пользователей в месяц* более 2 500 000 просмотров ежесут Деревня Юрьевец
Деревня Юрьевец Breyn-ring. Предприниматели и предпринимательство
Breyn-ring. Предприниматели и предпринимательство ОДИН ДОМА. ПРАВИЛА ПОВЕДЕНИЯ
ОДИН ДОМА. ПРАВИЛА ПОВЕДЕНИЯ Круговорот воды в природе
Круговорот воды в природе K.Borutos romano „Baltaragio malūnas” veikėjai (2 pam.) Pirmoje pamokoje buvo aptartas velnio Pinčuko paveikslas
K.Borutos romano „Baltaragio malūnas” veikėjai (2 pam.) Pirmoje pamokoje buvo aptartas velnio Pinčuko paveikslas ПРЕЗЕНТАЦИЯ Подписка Sixt Газ
ПРЕЗЕНТАЦИЯ Подписка Sixt Газ Урок русского языка в 5 классе
Урок русского языка в 5 классе 16 и 19 ноября 124
16 и 19 ноября 124 1 ИЮНЯ ДЕНЬ ЗАЩИТЫ ДЕТЕЙ.
1 ИЮНЯ ДЕНЬ ЗАЩИТЫ ДЕТЕЙ. «…Металлургическая отрасль должна стать в первых рядах форсированного индустриально-инновационного развития…» Н.А. Назарбаев
«…Металлургическая отрасль должна стать в первых рядах форсированного индустриально-инновационного развития…» Н.А. Назарбаев Ноктурия и ее влияние на качество жизни
Ноктурия и ее влияние на качество жизни Спорт как социальное явление
Спорт как социальное явление Урок лыжной подготовки в 9 классе
Урок лыжной подготовки в 9 классе Стратегический План на 2008-2011 годыДля обсуждения с НПО22 февраля 2008 г.
Стратегический План на 2008-2011 годыДля обсуждения с НПО22 февраля 2008 г. Конфликты супругов пожилого возраста
Конфликты супругов пожилого возраста Методы и методики исследования влияния видеоигр на деятельность психики
Методы и методики исследования влияния видеоигр на деятельность психики Способы создания образов воображения
Способы создания образов воображения