Содержание
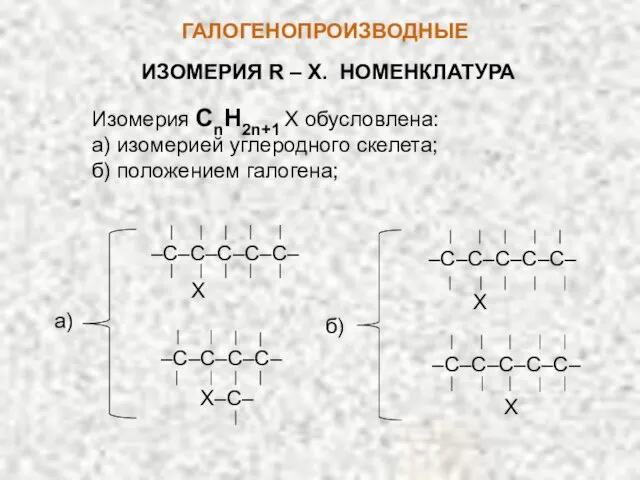
- 2. ГАЛОГЕНОПРОИЗВОДНЫЕ ИЗОМЕРИЯ R – X. НОМЕНКЛАТУРА Изомерия CnH2n+1 X обусловлена: а) изомерией углеродного скелета; б) положением
- 3. ГАЛОГЕНОПРОИЗВОДНЫЕ НОМЕНКЛАТУРА R – X Причем название X ставится либо перед, либо после названия радикала:
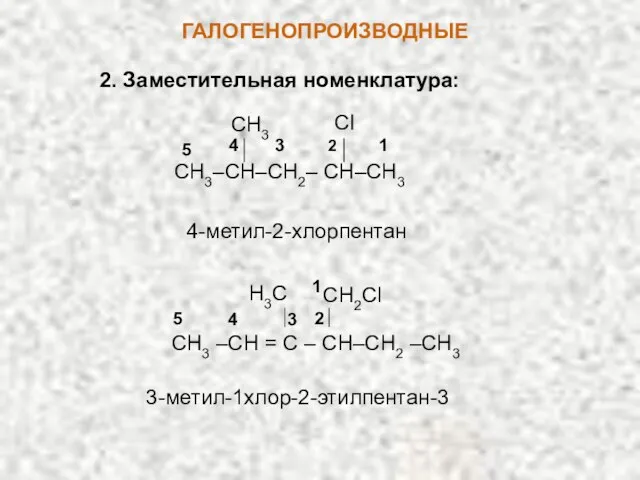
- 4. ГАЛОГЕНОПРОИЗВОДНЫЕ 2. Заместительная номенклатура:
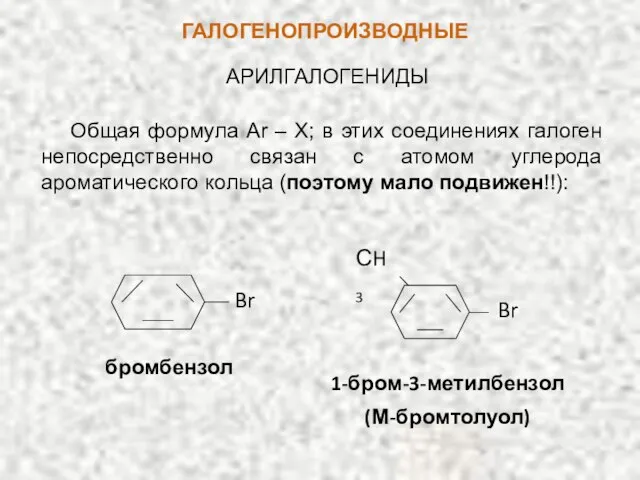
- 5. ГАЛОГЕНОПРОИЗВОДНЫЕ АРИЛГАЛОГЕНИДЫ Общая формула Ar – X; в этих соединениях галоген непосредственно связан с атомом углерода
- 6. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X (звездочкой (*) отмечены методы, используемые также в промышленности). 1. Из
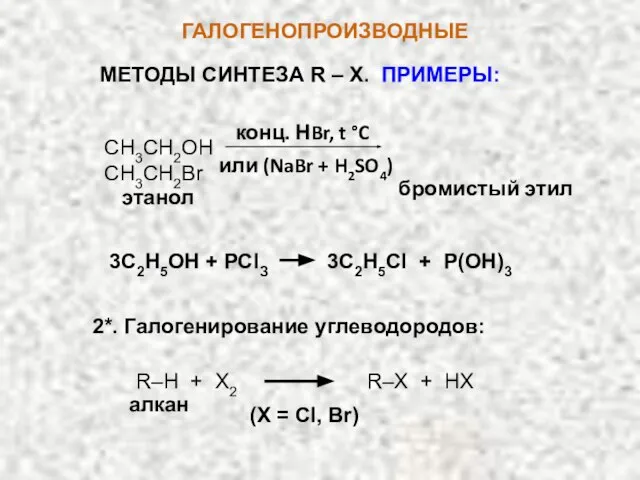
- 7. ГАЛОГЕНОПРОИЗВОДНЫЕ МЕТОДЫ СИНТЕЗА R – X. ПРИМЕРЫ: СН3СН2OН СН3СН2Br конц. НBr, t °C или (NaBr +
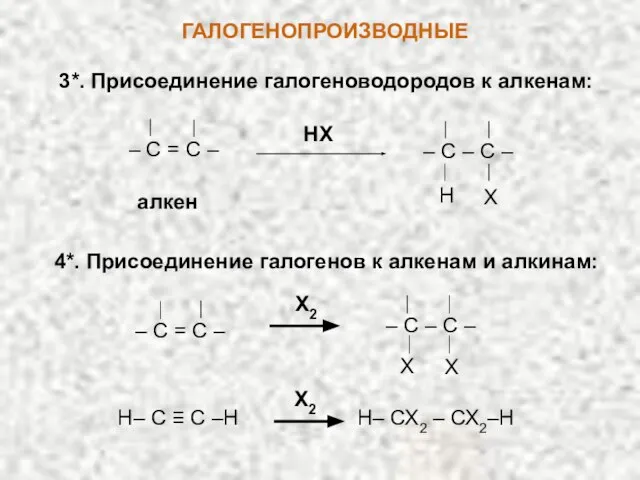
- 8. ГАЛОГЕНОПРОИЗВОДНЫЕ 3*. Присоединение галогеноводородов к алкенам: 4*. Присоединение галогенов к алкенам и алкинам: Х2 Х Х
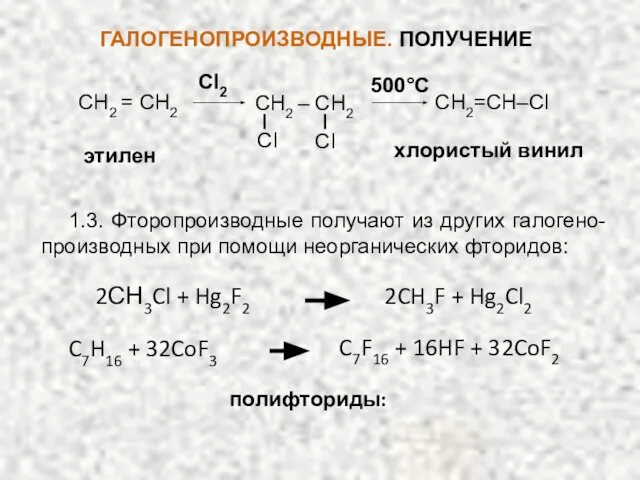
- 9. ГАЛОГЕНОПРОИЗВОДНЫЕ. ПОЛУЧЕНИЕ Промышленные способы: 1.1. Галогенирование алканов (обычно образуются смеси изомеров, что несколько снижает ценность метода):
- 10. Cl2 500°C хлористый винил этилен СН2=СН–Сl СН2 = СН2 СН2 – СН2 Сl Сl 1.3. Фторопроизводные
- 11. ГАЛОГЕНОПРОИЗВОДНЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА R – X Температура плавления и кипения R – X Температура плавления и
- 12. ГАЛОГЕНОПРОИЗВОДНЫЕ РАСТВОРИМОСТЬ: ОБЩИЕ ЗАКОНОМЕРНОСТИ Компонент А Компонент В 1. ЕА∙∙∙A > ЕA∙∙∙B ⎯ нет растворения 2.
- 13. ГАЛОГЕНОПРОИЗВОДНЫЕ ХИМИЧЕСКИЕ СВОЙСТВА R – X Характерной чертой RX является наличие группировки: : .. .. δ-
- 14. ГАЛОГЕНОПРОИЗВОДНЫЕ «S» - от слова «substitution» - замещение; «N» - от слова «nucleophilic». В SN –
- 15. МЕХАНИЗМ РЕАКЦИИ В зависимости от природы галогено-производного (R – X), нуклеофильного реагента (:Nu) и условий реакции
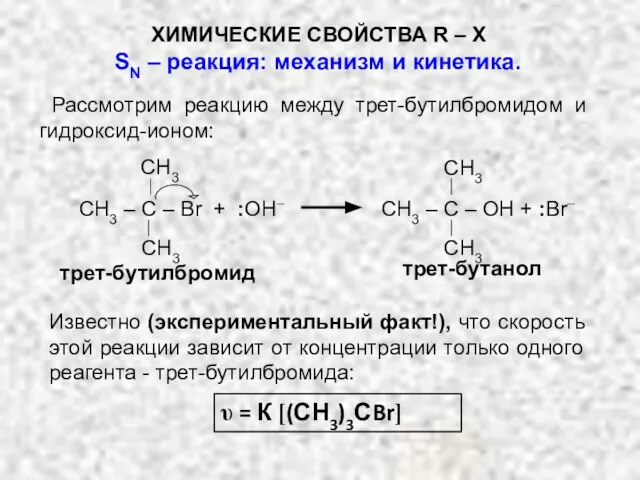
- 16. Рассмотрим реакцию между трет-бутилбромидом и гидроксид-ионом: трет-бутилбромид трет-бутанол CH3 CH3 CH3 – C – OH +
- 17. Возникает вопрос, почему скорость реакции не зависит от концентрации гидроксид-иона :ОН– ? Ответ: Если скорость реакции
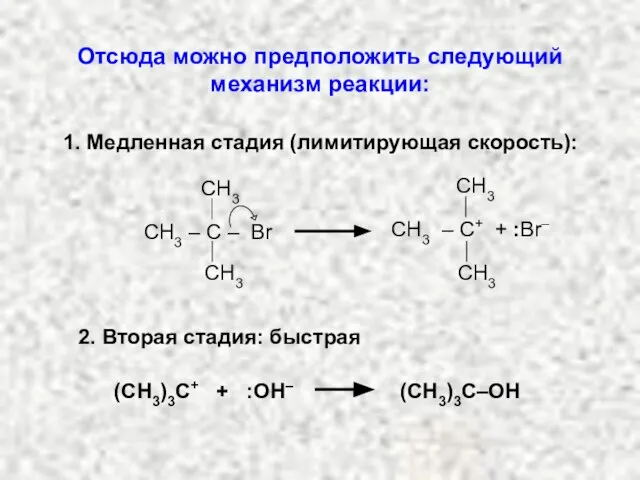
- 18. (СН3)3С+ + :ОН– (СН3)3С–ОН 2. Вторая стадия: быстрая Отсюда можно предположить следующий механизм реакции: CH3 CH3
- 19. Первая стадия – ионизация реагента и образование карбкатиона (протекает медленно) Вторая стадия – взаимодействие карбкатиона с
- 20. Скорость SN1 – реакции зависит только от концентра-ции алкилгалогенида, т. е. SN1 – реакция является реакцией
- 21. СН3Br + :ОН– СН3ОН + :Br Рассмотрим теперь реакцию бромистого метила с гидроксид-ионом, приводящую к метиловому
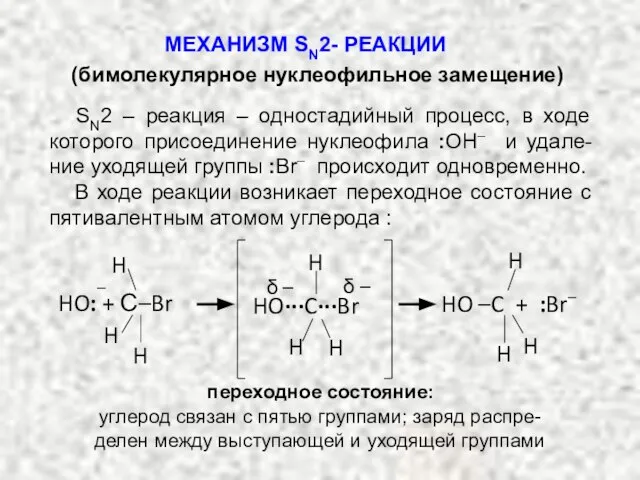
- 22. МЕХАНИЗМ SN2- РЕАКЦИИ (бимолекулярное нуклеофильное замещение) SN2 – реакция – одностадийный процесс, в ходе которого присоединение
- 23. SN2-ЗАМЕЩЕНИЕ МЕХАНИЗМ РЕАКЦИИ. ОБЩИЙ ВИД: SN2 – реакция – одностадийный процесс, в ходе которого присоединение нуклеофила
- 24. Роль нуклеофильного реагента могут играть как анионы, так и нейтральные частицы. Характер действия каждого их них
- 25. ПРИМЕРЫ НУКЛЕОФИЛОВ: а) Анионы: НО– (гидроксил-анион) RO– (алкоголят-ионы) RCOO– (ионы органических кислот) СN– (цианид-ион)
- 26. ГАЛОГЕНОПРОИЗВОДНЫЕ С2H5Cl + KOH C2H5OH + KCl CH3CH2Cl + H2O CH3CH2OH + HCl этилхлорид этанол НУКЛЕОФИЛЬНОЕ
- 27. ОБШАЯ СХЕМА: R:X + :Nu R:Nu + :X– 1. R:X + :ОН– R:OH + :X– спирт
- 28. 4. R:X + –:С ≡ СR′ R:C ≡ CR′ + :X– алкин 5. R:X + Na:R′
- 29. 9. R:X+ :NH3 [R:NH3]+:X– R–NH2 амин 10. R:X + :NH2R′ [R:NH2R′]+X– RNHR′ + НX алкилбензол реакция
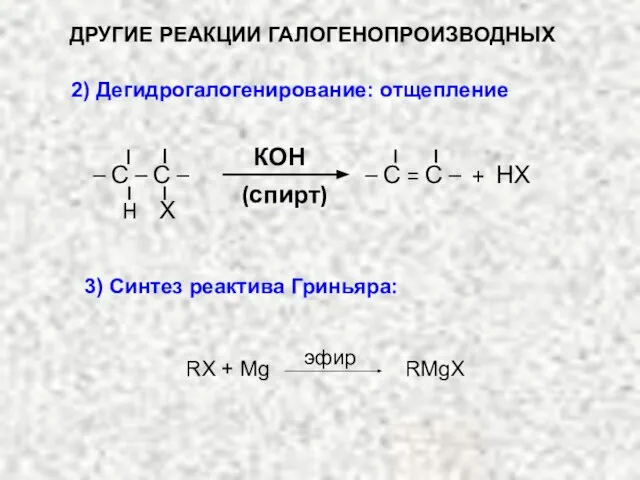
- 30. ДРУГИЕ РЕАКЦИИ ГАЛОГЕНОПРОИЗВОДНЫХ 2) Дегидрогалогенирование: отщепление КОН (спирт) – С = С – + НХ Х
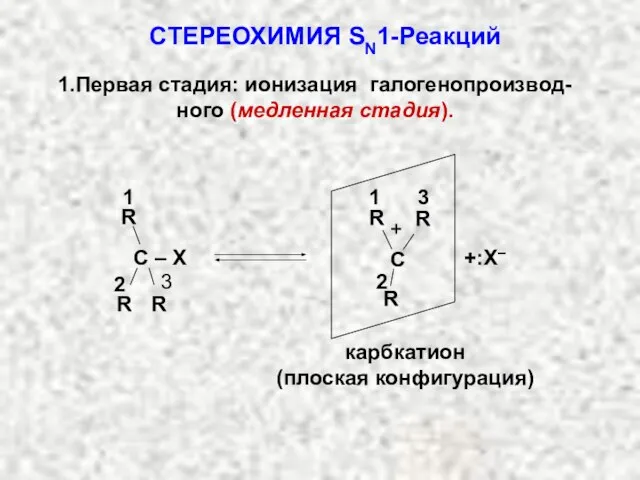
- 31. СТЕРЕОХИМИЯ SN1-Реакций 1.Первая стадия: ионизация галогенопроизвод-ного (медленная стадия). карбкатион (плоская конфигурация)
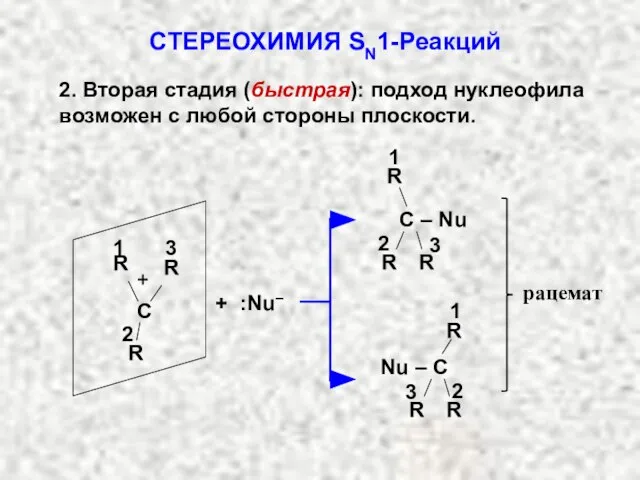
- 32. рацемат 2. Вторая стадия (быстрая): подход нуклеофила возможен с любой стороны плоскости. СТЕРЕОХИМИЯ SN1-Реакций
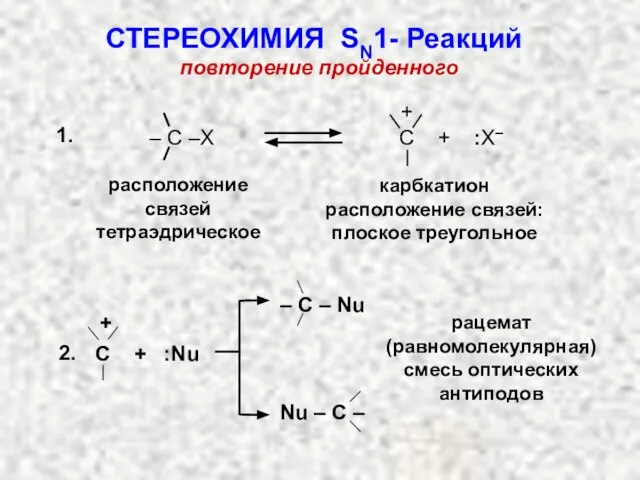
- 33. повторение пройденного 1. расположение связей тетраэдрическое карбкатион расположение связей: плоское треугольное + C + :X– –
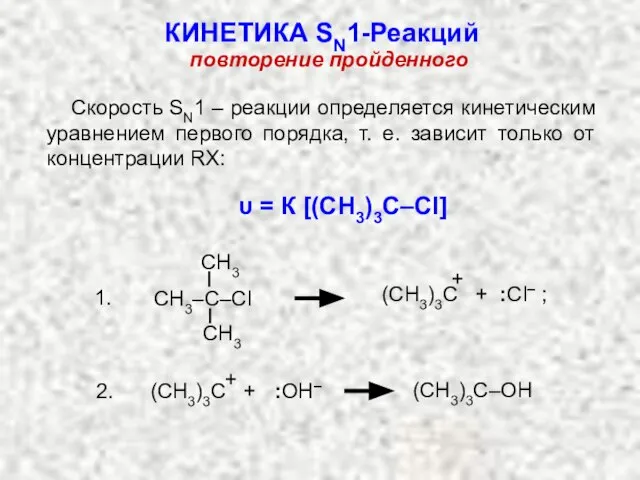
- 34. Скорость SN1 – реакции определяется кинетическим уравнением первого порядка, т. е. зависит только от концентрации RX:
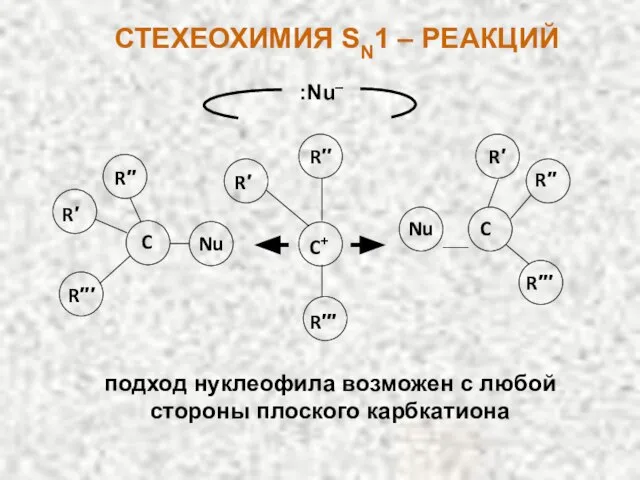
- 35. СТЕХЕОХИМИЯ SN1 – РЕАКЦИЙ Конечный продукт SN1 – реакции представляет собой смесь оптических антиподов – рацемат.
- 36. подход нуклеофила возможен с любой стороны плоского карбкатиона :Nu‒ СТЕХЕОХИМИЯ SN1 – РЕАКЦИЙ
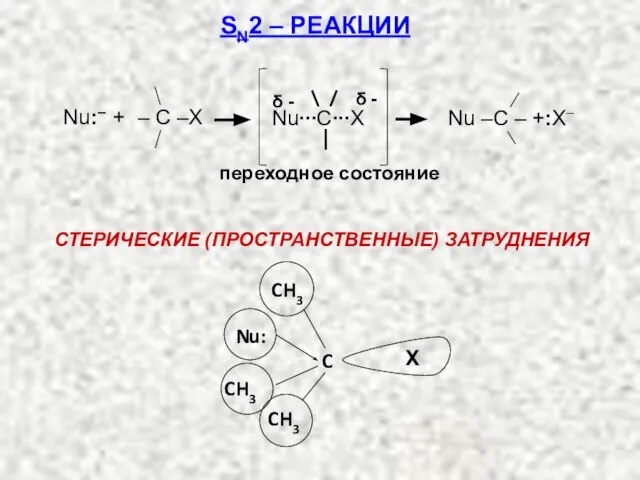
- 37. СТЕРИЧЕСКИЕ (ПРОСТРАНСТВЕННЫЕ) ЗАТРУДНЕНИЯ SN2 – РЕАКЦИИ X CH3 CH3 CH3 Nu: C переходное состояние
- 38. Выше отмечалось, что SN1 – реакция – двухстадийный процесс, общая скорость которого определяется лимитирующей стадией, т.
- 39. Реакционная способность RX в SN1 – реакции уменьшается в ряду: Такой порядок реакционной способности RX соответст-вует
- 40. ГАЛОГЕНОПРОИЗВОДНЫЕ Механизм SN2 (бимолекулярное нуклеофильное замещение) SN2 – реакция – одностадийный процесс, в ходе которого присоединение
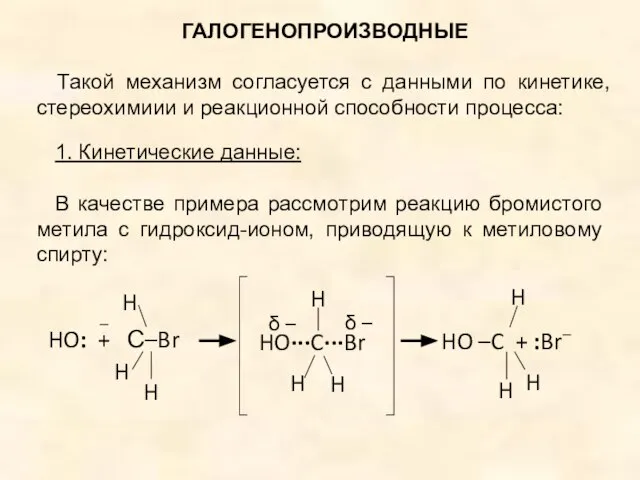
- 41. ГАЛОГЕНОПРОИЗВОДНЫЕ Такой механизм согласуется с данными по кинетике, стереохимиии и реакционной способности процесса: 1. Кинетические данные:
- 42. ГАЛОГЕНОПРОИЗВОДНЫЕ В решающей стадии реакции участвуют оба реагента и НО:– и СН3Br, следовательно скорость реакции должна
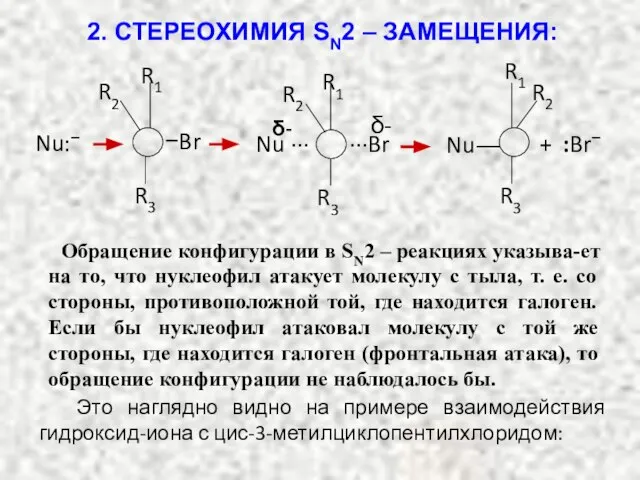
- 43. 2. СТЕРЕОХИМИЯ SN2 – ЗАМЕЩЕНИЯ: Изучение SN – реакций на примере оптически активных алкилгалогенидов (и др.
- 44. R1 R2 R3 −Br Nu:– R1 R2 R3 + :Br– Nu― δ- ∙∙∙Br R1 R2 R3
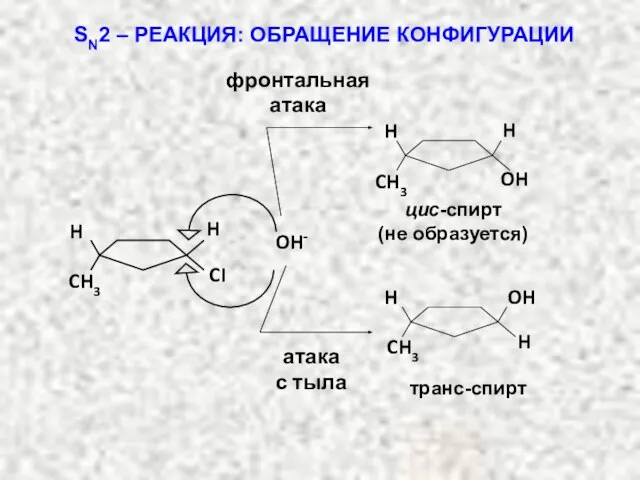
- 45. SN2 – РЕАКЦИЯ: ОБРАЩЕНИЕ КОНФИГУРАЦИИ цис-спирт (не образуется) транс-спирт фронтальная атака атака с тыла CH3 H
- 46. 3. Данные по реакционной способности: В SN2 – реакциях реакционная способность RX уменьшается в следующем порядке:
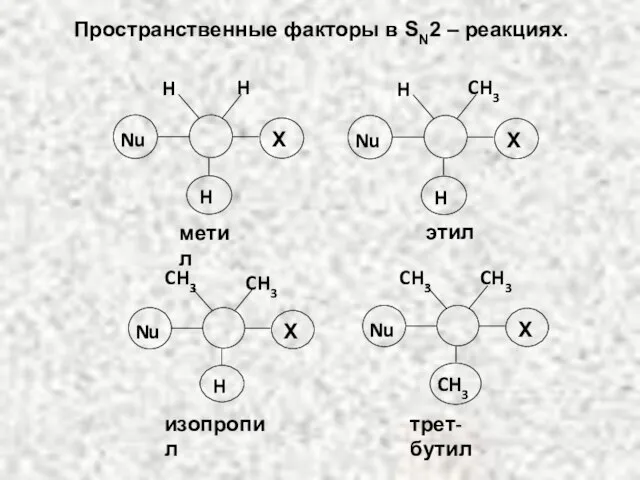
- 47. Пространственные факторы в SN2 – реакциях. этил метил трет-бутил изопропил
- 48. Увеличение числа алкильных заместителей создает пространственные препятствия для приближения атакующего реагента с тыльной стороны. Более объемным
- 49. ВЛИЯНИЕ СТРУКТУРНЫХ ФАКТОРОВ И ПРИРОДЫ РАСТВОРИТЕЛЯ В SN2 – РЕАКЦИЯХ Механизму SN1 способствуют: 1) Большой объем
- 50. ВЛИЯНИЕ АЛКИЛЬНОГО РАДИКАЛА: Полезно правило: первичные алкил-галогениды реагируют по механизму SN2, а третичные – по механизму
- 51. ГАЛОГЕНОПРОИЗВОДНЫЕ Скорость SN2 – реакции возрастает Скорость SN1 – реакции возрастает RX=CH X, первичный, вторичный, третичный
- 52. СРАВНЕНИЕ СКОРОСТЕЙ РЕАКЦИЙ SN1 И SN2 RBr + I– RI + :Br– (SN2) RBr + H2O:
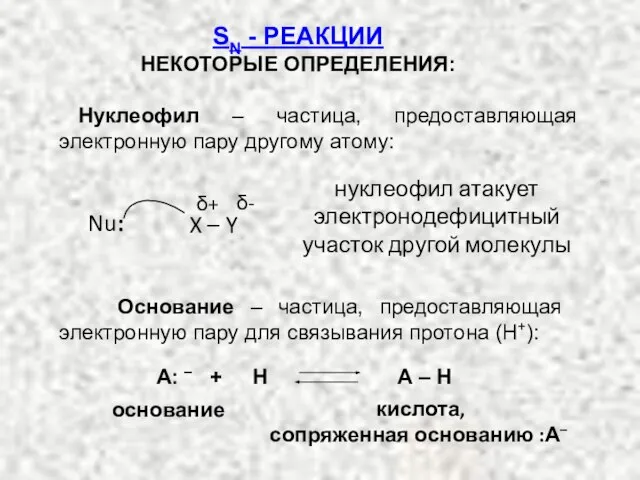
- 53. Нуклеофил – частица, предоставляющая электронную пару другому атому: SN - РЕАКЦИИ НЕКОТОРЫЕ ОПРЕДЕЛЕНИЯ: нуклеофил атакует электронодефицитный
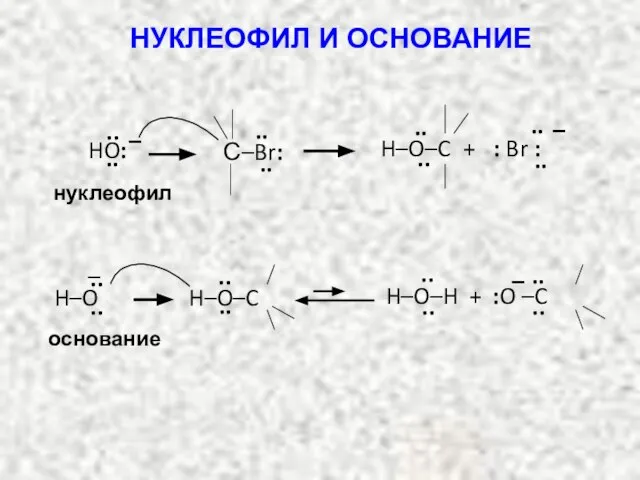
- 54. Общее: и нуклеофил, и основание – доноры электронных пар. НУКЛЕОФИЛ И ОСНОВАНИЕ Различие: если электронной парой
- 55. нуклеофил .. .. – HO: .. .. .. .. – H–O–C + : Br : ..
- 56. НУКЛЕОФИЛЬНОСТЬ И ОСНОВНОСТЬ: Нуклеофильность частицы – способность к взаимодействию за счет своей электронной пары с атомом
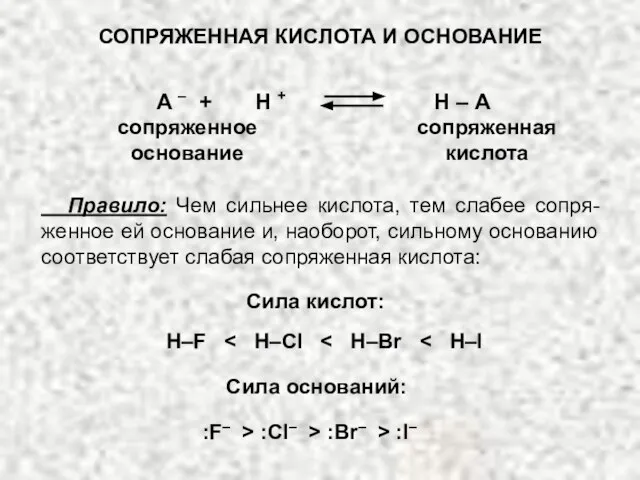
- 57. А – + Н + Н – А сопряженное основание Правило: Чем сильнее кислота, тем слабее
- 58. ГАЛОГЕНОПРОИЗВОДНЫЕ Нуклеофильность реагентов не всегда изменяется параллельно их основности: нуклеофильность растет: F– , Cl– , Br–
- 59. ГАЛОГЕНОПРОИЗВОДНЫЕ Правило: 1. Если атакующий атом один и тот же, то нуклеофильность аниона прямо пропорцио-нальна его
- 60. ГАЛОГЕНОПРОИЗВОДНЫЕ нуклеофильность растет (основность падает) :F– , :Cl– , :Br– , :I– поляризуемость растет Поляризуемость электронов
- 61. ГАЛОГЕНОПРОИЗВОДНЫЕ Наименее прочно удерживаются несвязывающие электроны, откуда следует, что атом, выступая в качестве нуклеофила, использует, как
- 62. ГАЛОГЕНОПРОИЗВОДНЫЕ Из этого правила следует: сильные основания обычно бывают плохими уходящими группами; слабые основания обычно являются
- 63. ГАЛОГЕНОПРОИЗВОДНЫЕ плохие уходящие группы (сильные основания): :ОН– , RO:– , :NH2– , :CH3– , :H– хорошие
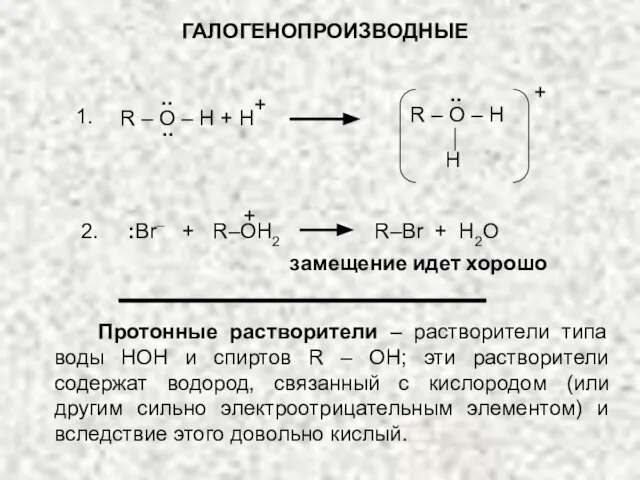
- 64. ГАЛОГЕНОПРОИЗВОДНЫЕ .. + H R – O – H .. .. + R – O –
- 65. Протонные растворители – растворители типа воды НОН и спиртов R – OH; эти растворители содержат водород,
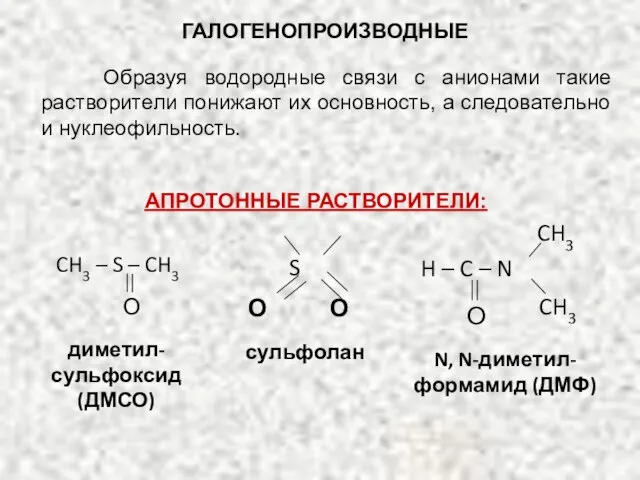
- 66. ГАЛОГЕНОПРОИЗВОДНЫЕ Образуя водородные связи с анионами такие растворители понижают их основность, а следовательно и нуклеофильность. АПРОТОННЫЕ
- 67. ГАЛОГЕНОПРОИЗВОДНЫЕ Апротонные растворители – полярные раствори-тели с высокой диэлектрической проницаемостью, но не способны к образованию водородных
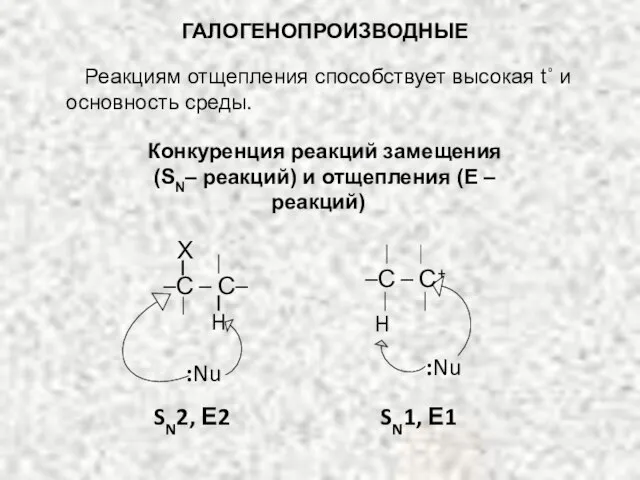
- 68. ГАЛОГЕНОПРОИЗВОДНЫЕ Реакциям отщепления способствует высокая t˚ и основность среды. Конкуренция реакций замещения (SN– реакций) и отщепления
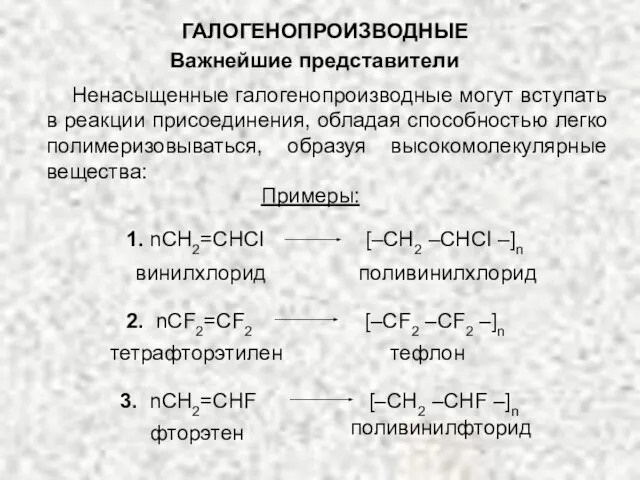
- 69. ГАЛОГЕНОПРОИЗВОДНЫЕ Важнейшие представители Ненасыщенные галогенопроизводные могут вступать в реакции присоединения, обладая способностью легко полимеризовываться, образуя высокомолекулярные
- 71. Скачать презентацию


















![9. R:X+ :NH3 [R:NH3]+:X– R–NH2 амин 10. R:X + :NH2R′ [R:NH2R′]+X– RNHR′](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/389080/slide-28.jpg)






















 ORDERS OF ARCHITECTURE
ORDERS OF ARCHITECTURE Кабельные системы обогрева в строительстве
Кабельные системы обогрева в строительстве Презентация на тему Жаркие пустыни
Презентация на тему Жаркие пустыни Воронцов А.Б. 21 мая 2010
Воронцов А.Б. 21 мая 2010 Имидж, поведение и репутация как фактор жизненного успеха
Имидж, поведение и репутация как фактор жизненного успеха День матери
День матери Пингвины
Пингвины Политическая власть. Тема 3
Политическая власть. Тема 3 Разработка электрической винто-моторной группы для лёгкого летательного аппарата
Разработка электрической винто-моторной группы для лёгкого летательного аппарата  Детское воскресное служение
Детское воскресное служение Технология кислородной резки
Технология кислородной резки История вышивки лентами
История вышивки лентами 11 Программа развития МБСКОУ СКОШ 3 VIII вида г. Ишима на 2012 – 2014 гг. Департамент по социальным вопросам администрации г. Ишима Муницип
11 Программа развития МБСКОУ СКОШ 3 VIII вида г. Ишима на 2012 – 2014 гг. Департамент по социальным вопросам администрации г. Ишима Муницип Решение задач на движение
Решение задач на движение Olympiade in der Schule
Olympiade in der Schule Имущественные права личного характера в российском гражданском праве
Имущественные права личного характера в российском гражданском праве Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет
Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет Традиции Бурятии
Традиции Бурятии Сайт, который продает. Интернет магазин – это легко!
Сайт, который продает. Интернет магазин – это легко! Применение СУП в командной работе
Применение СУП в командной работе Н.В. Гоголь «Женитьба»
Н.В. Гоголь «Женитьба» Девиантное поведение
Девиантное поведение Педагогическая компетентность учителя как результат самообразования
Педагогическая компетентность учителя как результат самообразования Натюрморт с чучелом птицы
Натюрморт с чучелом птицы Право на оружие
Право на оружие "Ты не одинока"
"Ты не одинока" Курсы дистанционного обучения для электроэнергетики
Курсы дистанционного обучения для электроэнергетики Церковь Иль-Джезу
Церковь Иль-Джезу