Содержание
- 2. Консультации Четверг 15-25-18-30 д/з №3635 Методичка к лабораторным работам
- 3. ЭлектронЭлектрон имеет двойственную природу (частица и волна). Движение электрона подчиняется законам квантовой механики. Связь между волновыми
- 4. Энергию и координаты электрона, невозможно одновременно измерить с одинаковой точностью (принцип неопределенности Гейзенберга) Часть пространства, в
- 5. Свойства электрона
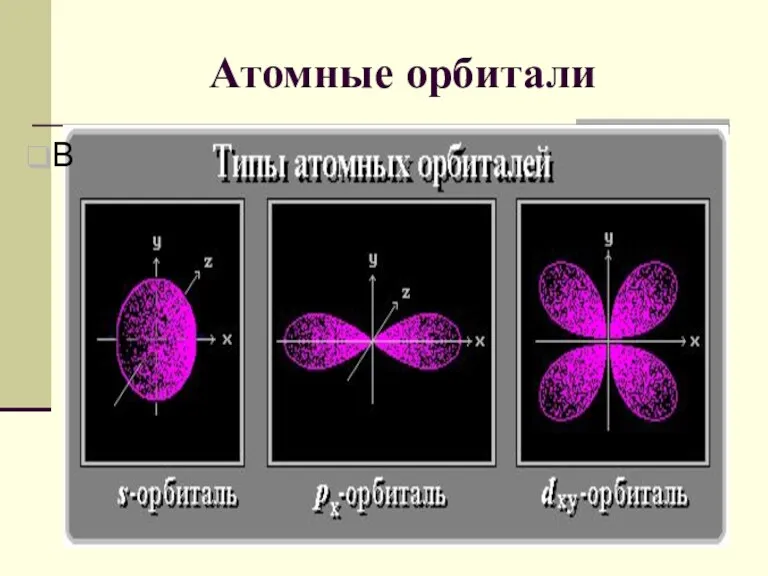
- 6. Атомные орбитали В
- 7. Квантовые числа Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой
- 8. Квантовые числа 2. Орбитальное (побочное) квантовое число l определяет форму атомной орбитали. Значения от 0 до
- 9. Квантовые числа 3. Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или
- 10. Квантовые числа 4.Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они
- 11. Пример орбиталей
- 12. Пример орбиталей
- 13. Заполнение атомных орбиталей электронами При заполнении атомных орбиталей электронами соблюдаются три основные правила. Принцип Паули. Правило
- 14. Заполнение атомных орбиталей электронами Принцип Паули: В атоме не может быть двух электронов, у которых все
- 15. Заполнение атомных орбиталей электронами Принцип Хунда: Устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического
- 17. Скачать презентацию













 В. Гинуков. Условный портрет автора Слова
В. Гинуков. Условный портрет автора Слова Кафедра естественных наук
Кафедра естественных наук 249175
249175 Голосовой помощник Маруся
Голосовой помощник Маруся Девять предметов в системе счисления
Девять предметов в системе счисления Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про»
Саморегулирующиеся организации «СРО Телеком» и СРО Телеком-Про» «Страницы семейного архива»
«Страницы семейного архива» Статистика терроризма
Статистика терроризма Социальные, этнические, конфессиональные и культурные различия личности
Социальные, этнические, конфессиональные и культурные различия личности Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой.
Опиливание заготовок из сортового проката.Резание металла слесарной ножовкой. Гай Юлий Цезарь
Гай Юлий Цезарь Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом
Презентация на тему Новогодние игры со Снегурочкой и Дедом Морозом Презентация на тему Ёлочка из перьев
Презентация на тему Ёлочка из перьев Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u
Структура спонсорского пакета для чемпионата Санкт-Петербурга по водному поло.u Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru.
Заголовок Название раздела 1 Ленвендо Кто мы www.lenvendo.ru. ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА
ПОЛЯРИЗАЦИЯ И ДИФРАКЦИЯ СВЕТА Тема урока: «Тайны поэзии Н.Гумилева»
Тема урока: «Тайны поэзии Н.Гумилева» Презентация на тему Лингвистический проект
Презентация на тему Лингвистический проект Цифровые автоматы, кодирование сигнала
Цифровые автоматы, кодирование сигнала Самодержавие Алексея Михайловича Тишайшего
Самодержавие Алексея Михайловича Тишайшего Презентация на тему Рулевое управление автомобиля
Презентация на тему Рулевое управление автомобиля Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам
Евгений Замятин. Роман-антиутопия "Мы“ как предупреждение потомкам Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом
Модель управления имущественными комплексами вузов и вопросы распоряжения имуществом Техника построения эллипсов во фронтальной плоскости проекций
Техника построения эллипсов во фронтальной плоскости проекций Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска
Нательные кресты XI – конца XIX вв. в экспозиции музея им. 1000-летия Брянска Запатентован первый кассовый аппарат (1879)
Запатентован первый кассовый аппарат (1879) Система права
Система права Тест по рыбе
Тест по рыбе