Содержание
- 2. Цели занятия: 1. Рассмотреть природу химической связи в комплексных соединениях. 2. Изучить реакции комплексных соединений и
- 3. 1. Природа химической связи в комплексных соединениях
- 4. Способы описания химической связи в комплексных соединениях 1. Метод валентных связей (МВС). 2. Теория кристаллического поля
- 5. Положения метода валентных связей 1. В комплексе связь между комплексообразователем и лигандами координационная (ковалентная, донорно- акцепторная).
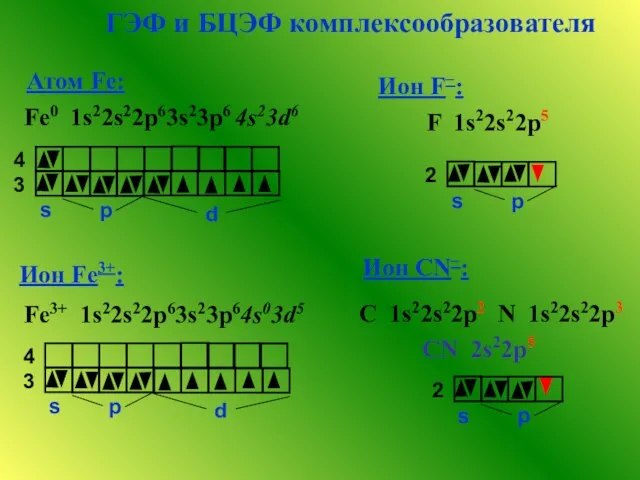
- 6. ГЭФ и БЦЭФ комплексообразователя Атом Fe: Fe0 1s22s22p63s23p6 4s23d6 Fe3+ 1s22s22p63s23p64s03d5 Ион Fe3+: Ион F−: Ион
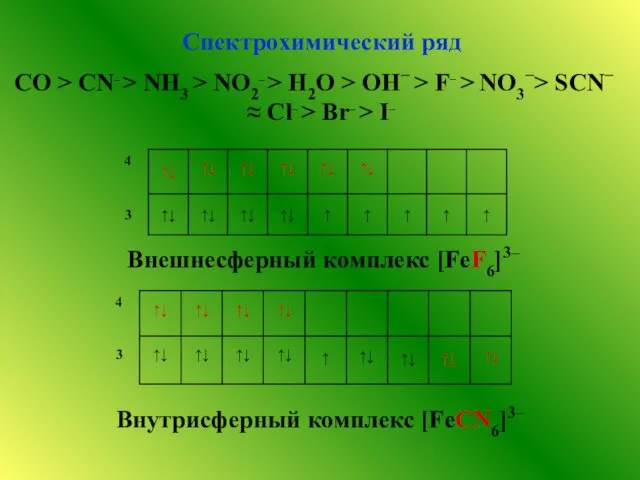
- 7. Спектрохимический ряд СO > CN– > NH3 > NO2– > H2O > OH− > F− >
- 8. [Co(H2O)6]2+ розовый [Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый [Co(NH3)6]2+ буро-розовый Усиление поля лигандов Влияние поля лигандов на окраску
- 9. 2. Реакции комплексных соединений. Устойчивость комплексных соединений и константа нестойкости
- 10. K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Диссоциация КС по внешней сфере (первичная диссоциация)
- 11. [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Ag+ + 2 NH3 Диссоциация КС по внутренней сфере (вторичная диссоциация)
- 12. Реакции комплексных соединений по внешней сфере 2K3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2↓ + 3K2SO4 [CoCl2(NH3)4]Cl + AgNO3
- 13. Br- Br- 2Br- Cu2+ [CuBr]+ [CuBr2] [CuBr4]2- + H2O + H2O + H2O Ступенчатое образование и
- 14. Реакции комплексных соединений с разрушением комплекса 1.Образование более прочного комплекса Fe3+ + 6 SCN- = [Fe(SCN)6]3-
- 15. 3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6] + 3Сl2 + 4KOH =
- 16. При разном координационном числе Расчет средней константы нестойкости 2. Расчет концентрации комплексообразователя в растворе. 3. Сравнение
- 17. При одинаковом координационном числе Сравнение прочности комплексов по общим константам нестойкости [Fe(SCN)6]3- + 6 F- =
- 18. При разном координационном числе 1. Сравнение устойчивости комплексов по средней константе нестойкости где n – координационное
- 20. При разном координационном числе 3. Сравнение устойчивости комплексов по ступенчатым константам нестойкости
- 22. Скачать презентацию




![[Co(H2O)6]2+ розовый [Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый [Co(NH3)6]2+ буро-розовый Усиление поля лигандов Влияние](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-7.jpg)

![K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Диссоциация КС по внешней сфере (первичная диссоциация)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-9.jpg)
![[Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Ag+ + 2 NH3 Диссоциация КС по внутренней сфере (вторичная диссоциация)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-10.jpg)
![Реакции комплексных соединений по внешней сфере 2K3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2↓ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-11.jpg)
![Br- Br- 2Br- Cu2+ [CuBr]+ [CuBr2] [CuBr4]2- + H2O + H2O +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-12.jpg)

![3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-14.jpg)

![При одинаковом координационном числе Сравнение прочности комплексов по общим константам нестойкости [Fe(SCN)6]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361887/slide-16.jpg)



 Инфраструктурные инвестиции
Инфраструктурные инвестиции Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09
Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09 Pos материалы гербион
Pos материалы гербион Презентация на тему Неофициальные символы России
Презентация на тему Неофициальные символы России CPA launches FOD
CPA launches FOD Методы и приборы разрушающего контроля, применяемые при обследовании
Методы и приборы разрушающего контроля, применяемые при обследовании ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ
ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи»
Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи» Колористика при окрашивании волос. Тест
Колористика при окрашивании волос. Тест Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна»)
Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна») Греческая вазопись
Греческая вазопись Холод в нефтянной промышленности
Холод в нефтянной промышленности Урок-путешествие по разделу «Были-небылицы». Оценка достижений
Урок-путешествие по разделу «Были-небылицы». Оценка достижений LobbyWorks
LobbyWorks Самоиндукция
Самоиндукция Correct сommunication. Правильное общение
Correct сommunication. Правильное общение Тема: «Положение человека в системе животного мира. Эволюция гоминид».
Тема: «Положение человека в системе животного мира. Эволюция гоминид». Презентация на тему Выживание в природных условиях после аварии
Презентация на тему Выживание в природных условиях после аварии  ангелы
ангелы Интеллектуально-познавательная игра
Интеллектуально-познавательная игра Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208-
Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208- Fruit and vegetables
Fruit and vegetables Ты подвиг совершил во имя жизни на земле
Ты подвиг совершил во имя жизни на земле Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите
Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите ТВ - тюнеры
ТВ - тюнеры Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров
Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров Евгений Замятин
Евгений Замятин Characteristic of grain mass
Characteristic of grain mass