Содержание
- 2. Проработать ключевые моменты изученной темы и подготовиться к контрольной работе. Цель.
- 3. 1. Систематизировать и обобщить знания особенностей строения атомов неметаллов, свойств простых веществ, а также их соединений.
- 4. Случай помогает только тренированному уму. Видеофрагмент №1 Видеофрагмент №2 Видеофрагмент №3
- 5. Задание 1. Составитьте электронную схему, электронную и графическую формулу, спрогнозируйте возможные степени окисления химического элемента. Охарактеризуйте
- 6. Задание 2. Подтвердите окислитель-но-восстановительные возможности простых веществ - неметаллов уравнениями реакций с электронным балансом: неметалл-окислитель (1
- 7. Осуществите цепочку превращений и на основании электронных балансов сделайте вывод об окислительно- восстановительных возможностях вещества: «С»
- 8. Задание 4. Напишите уравнения реакций, характеризующие химические свойства оксидов на примере оксида серы(VI) SO3 – команде
- 9. Задание 5. Докажите наличие генетической связи между классами неорганических соединений, осуществив цепочку превращений: «С» C CH4
- 10. Задание 6. Выбрав необходимые реактивы, проведите качественные реакции на ионы: «C» - CO32- «S» - SO42-
- 11. Качественные реакции на ионы Карбонат-ион Сульфат-ион Ион аммония
- 12. Задание 7. Тест – экспресс. 1. Разновидности простого вещества образованного одним и тем же элементом. 2.
- 13. Проверь свои знания «С» «S» «N» 1.аллотропия 1. аллотропия 1.аллотропия 2.1s22s22p2 2.1s22s22p63s23p4 2.1s22s22p3 3. 4 3.
- 14. Критерии оценок «5» - 0-1 ошибка «4» - 2-3 ошибки «3» - 4-5 ошибок «2» -
- 16. Скачать презентацию











 НазванияХимическихЭлементов
НазванияХимическихЭлементов Акты применения права. Характеристика и классификация
Акты применения права. Характеристика и классификация САМЫЕ-САМЫЕ
САМЫЕ-САМЫЕ Отчет о научно-организационной деятельности Президиума АН РБ в 2009 году
Отчет о научно-организационной деятельности Президиума АН РБ в 2009 году Невидимые нити (2 класс)
Невидимые нити (2 класс) НИКОЛАЯ ДМИТРИЕВИЧА ПАПАЛЕКСИ
НИКОЛАЯ ДМИТРИЕВИЧА ПАПАЛЕКСИ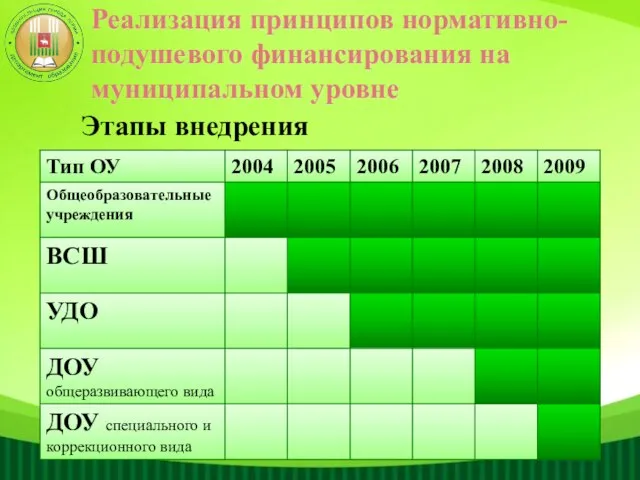 Реализация принципов нормативно-подушевого финансирования на муниципальном уровне
Реализация принципов нормативно-подушевого финансирования на муниципальном уровне Верейская по деньгам - ИТОГ
Верейская по деньгам - ИТОГ Дизайнер в отечественном ИТ бизнесе: многообразие деятельности, недооцененные компоненты профессионализма, стратегия роста Сер
Дизайнер в отечественном ИТ бизнесе: многообразие деятельности, недооцененные компоненты профессионализма, стратегия роста Сер Симметрия в архитектуре
Симметрия в архитектуре Презентация на тему Основные типы задач на проценты
Презентация на тему Основные типы задач на проценты  Вопросы внедрения национальной Интернет-адресации (IDN) .КАЗ
Вопросы внедрения национальной Интернет-адресации (IDN) .КАЗ Шаблон. Название темы
Шаблон. Название темы Презентация на тему Деревья
Презентация на тему Деревья  Учимся рисовать синичку (1)
Учимся рисовать синичку (1) Ох, уж эта функция
Ох, уж эта функция ЕДИНАЯ СИСТЕМА КЛАССИФИКАТОРОВ АНАЛИТИЧЕСКИХ ДАННЫХ
ЕДИНАЯ СИСТЕМА КЛАССИФИКАТОРОВ АНАЛИТИЧЕСКИХ ДАННЫХ Основы программирования промышленных роботов
Основы программирования промышленных роботов Образ матери в искусстве
Образ матери в искусстве Исследование опорно-двигательного аппарата учащихся Кугультинской средней школы
Исследование опорно-двигательного аппарата учащихся Кугультинской средней школы Шар ( сфера )
Шар ( сфера ) Школа нумерологии Светланы Сорокиной. Основы нумерологии. Базовый курс. Урок 2
Школа нумерологии Светланы Сорокиной. Основы нумерологии. Базовый курс. Урок 2 С Новым годом поздравляю
С Новым годом поздравляю Презентация на тему Книжная миниатюра Востока
Презентация на тему Книжная миниатюра Востока  О ДОЛГОСРОЧНОМ РЕГУЛИРОВАНИИ ТАРИФОВ НА УСЛУГИ ПО ПЕРЕДАЧЕ ТЕПЛОВОЙ ЭНЕРГИИ ООО «СВЕРДЛОВСКАЯ ТЕПЛОСНАБЖАЮЩАЯ КОМПАНИЯ»
О ДОЛГОСРОЧНОМ РЕГУЛИРОВАНИИ ТАРИФОВ НА УСЛУГИ ПО ПЕРЕДАЧЕ ТЕПЛОВОЙ ЭНЕРГИИ ООО «СВЕРДЛОВСКАЯ ТЕПЛОСНАБЖАЮЩАЯ КОМПАНИЯ» Начало Второй Мировой Войны
Начало Второй Мировой Войны Понятие психологии
Понятие психологии Страховые фонды Понятие, сущность, основные формы
Страховые фонды Понятие, сущность, основные формы