Содержание
- 2. Теллур Теллур (лат. Tellurium) — это химический элемент с атомным номером №52 в периодической системе и
- 3. Из истории… Впервые был найден в 1782 году в золотоносных рудах Трансильвании горным инспектором Францом Иозефом
- 4. "Аурум парадоксум" - парадоксальное золото, так называли теллур, после того как в конце XVIII столетия он
- 5. Открытие теллура относится к началу расцвета химико-аналитических исследований во второй половине XVIII в. К тому времени
- 6. В 1782 г. Мюллер исследовал руду и выделил из нее, как он полагал, новый металл. Чтобы
- 7. Происхождение названия Позднее (1798 г.), когда М. Клапрот детальнее исследовал новое вещество, он в честь Земли,
- 8. Нахождение в природе Содержание в земной коре 1·10-6 % по массе. Металлический теллур можно встретить разве
- 9. модуль Пельтье Многие знакомы с термоэлектрическими модулями Пельтье, которые используют в портативных холодильниках, термоэлектрических генераторах и
- 10. Физические свойства Теллур серебристо-белого цвета с металлическим блеском, хрупок, при нагреве становится пластичным. Кристаллизуется в гексагональной
- 11. Теллур – неметалл. В соединениях теллур проявляет степени окисления: -2, +4, +6 (валентность II, IV, VI).
- 12. Физиологическое действие При нагревании Теллур взаимодействует с водородом с образованием теллуроводорода - H2Te бесцветного ядовитого газа
- 13. Получение Основной источник — шламы электролитического рафинирования меди и свинца. Шламы подвергают обжигу, теллур остается в
- 14. Цены Теллур — редкий элемент, и значительный спрос при малом объёме добычи определяет высокую его цену
- 15. Применение Сплавы с повышенной прочностью Термоэлектрические материалы Узкозонные проводники Производство резины Источник света СD-RW В керамике
- 17. Скачать презентацию













 MadameTussaud’s Музей Восковых фигур Мадам Тюссо
MadameTussaud’s Музей Восковых фигур Мадам Тюссо Место учебного исследования в программе Intel «Обучение для будущего»
Место учебного исследования в программе Intel «Обучение для будущего» Потребительские кредиты
Потребительские кредиты Организация пастбищного содержания животных
Организация пастбищного содержания животных А
А Структура ВС РФ
Структура ВС РФ Северная Америка
Северная Америка «Как продолжается детство»
«Как продолжается детство» Молодые менеджеры и предприниматели Кубани
Молодые менеджеры и предприниматели Кубани Презентация на тему Углекислый газ СО2
Презентация на тему Углекислый газ СО2  Солнце воздух и вода – наши лучшие друзья
Солнце воздух и вода – наши лучшие друзья Лапта. История развития
Лапта. История развития Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз
Что такое система LanDrive ? LanDrive – это универсальная система управления по витой паре. Предназначена для автоматического и централиз Презентация на тему Экологические кризисы и экологические катастрофы
Презентация на тему Экологические кризисы и экологические катастрофы История Громова Процессы на постсоветском пространстве
История Громова Процессы на постсоветском пространстве Шамшур
Шамшур Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности»
Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности» Тема урока
Тема урока Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс
Понятие о причастном обороте. Знаки препинания в предложениях с причастными оборотами. 6 класс Презентация на тему Свет и его законы
Презентация на тему Свет и его законы  Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК
Презентация "Николай I и его портреты в изобразительном искусстве" - скачать презентации по МХК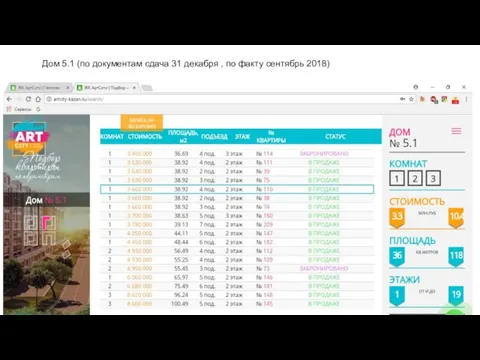 Art City. Подбор квартиры
Art City. Подбор квартиры Фалсафа - 5
Фалсафа - 5 врол
врол Бабаево – взгляд с любовью (городской путеводитель)
Бабаево – взгляд с любовью (городской путеводитель) Бесприборные тесты для подтверждения ВИЧ-Инфекции
Бесприборные тесты для подтверждения ВИЧ-Инфекции Техника безопасностииорганизация рабочего места
Техника безопасностииорганизация рабочего места Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).
Конспект урока по окружающему миру (история)с использованием информационно-коммуникационных технологий (3 класс, программа 1-4).