Слайд 2План лекції
1. Тепловий ефект хімічної реакції.
2. Теплота згоряння. Види теплоти згоряння.

Розрахункове визначення теплоти згоряння
3. Поняття та види температури горіння речовин.
4. Визначення температури горіння речовин та матеріалів.
Слайд 31. ТЕПЛОВИЙ ЕФЕКТ ХІМІЧНОЇ РЕАКЦІЇ
Тепловий ефект реакції - кількість теплоти, що виділяється

чи поглинається системою при протіканні в ній необоротної хімічної реакції за умови сталості температури й об’єму (Т, V = const) чи температури і тиску (Т, P = const).
Хімічна енергія перетворюється в теплову. Початковий і кінцевий рівні енергії системи різняться між собою на величину теплоти реакції Q.
Eкін – Eпоч = Q
Слайд 4Якщо Eкін 0, реакція супроводжу-ється виділенням тепла і

зветься екзотермічною.
Якщо Eкін >Eпоч, то Q < 0, реакція супроводжу-ється поглинанням тепла і зветься ендотермічною
Для визначення теплоти реакції застосовують перший закон термодинаміки:
- dQ = dU + PdV = dH – VdP
Якщо горіння відбувається при P =const (dP=0), теплота реакції дорівнює різниці повних ентальпій системи в початковому і кінцевому стані:
Qр = - ∫dH = - ΔH
Якщо горіння відбувається при V =const (dV=0), теплота реакції дорівнює різниці між внутрішньою енергією системи в початковому і кінцевому стані:
Qv = - ∫dU = - ΔU
Слайд 5Стандартна теплота реакції - різниця між стандартними теплотами утворення продуктів реакції і

вихідних речовин.
Qр = - ΔНхр = - (∑nкін ΔНоf кін - ∑nпоч ΔНоf поч ),
Стандартна теплота утворення речовини ΔНоf - теплота реакції, в якій утворюється один моль речовини зі складових його елементів за стандартних умов (Р=101,3 кПа, Т = 298К).
Слайд 62. ТЕПЛОТА ЗГОРЯННЯ
Теплота згоряння - кількість тепла, що виділяється під час повного

згоряння одиниці кількості ГР за умови, що вихідна суміш та кінцеві ПГ знаходяться за стандартних умов.
Оскільки ГР 1 моль, а теплота утворення О2 та N2 дорівнює 0, тепловий ефект реакції горіння становить:
Слайд 72.1. Види теплоти згоряння
Залежно від того, як визначають одиницю кількості ГР, розрізняють

теплоти згоряння:
молярну Q - кількість тепла, що виділяється при згорянні 1 молю ГР (кДж/моль),
масову Q/ - кількість тепла, що виділяється при згорянні 1 кг ГР (кДж/кг),
об’ємну Q// - кількість тепла, що виділяється при згорянні 1 м3 ГР (кДж/м3).
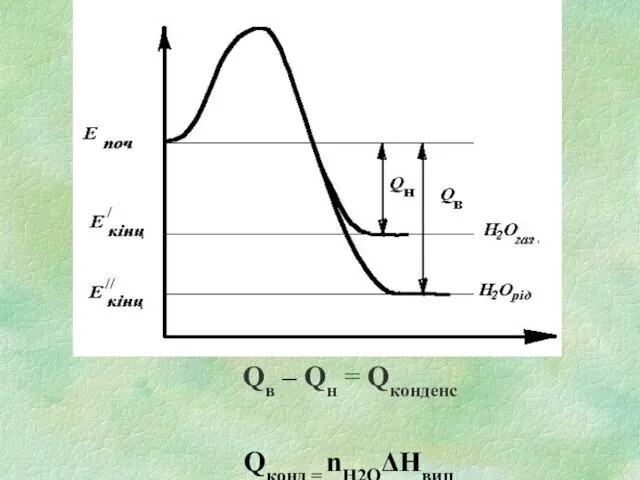
Слайд 8Залежно від агрегатного стану Н2О, яка утворилася під час горіння і знаходиться

в ПГ, розрізняють вищу та нижчу теплоту згоряння.
Вища теплота згоряння Qв - кількість тепла, що виділяється при повному згорянні одиниці кількості ГР за умови, що вода в ПГ знаходиться у рідкому стані.
Нижча теплота згоряння Qн - кількість тепла, що виділяється при повному згорянні одиниці кількості ГР за умови, що вода в ПГ знаходяться в газоподібному стані.
Слайд 9Qв – Qн = Qконденс
Qконд = nH2OΔHвип
Слайд 10При урахуванні хімічного недопалу, вологості матеріалу, втрати на теплове випромінювання, визначають практичну

або робочу теплоту згоряння матеріалу Qнр.
Слайд 112.2. Розрахунок теплоти згоряння
Горюча речовина індивідуального складу
Молярна теплота згоряння
, кДж/моль
масова ,

кДж/кг
об'ємна , кДж/м3
Слайд 12Горючі матеріали складного хімічного складу
суміш газів
тверді або рідкі складні матеріали
Qскл = ΣQi

gi
Ств + (О2 + 3,76 N2) = CO2 + 3,76 N2
Qв(Н)=285,83кДж/моль; Qв(S)= 297,09 кДж/моль
Слайд 13Внесок кожного елементу в масову теплоту згоряння:
Qв’ = 327,6⋅ϕС + 1429,2⋅ϕН +
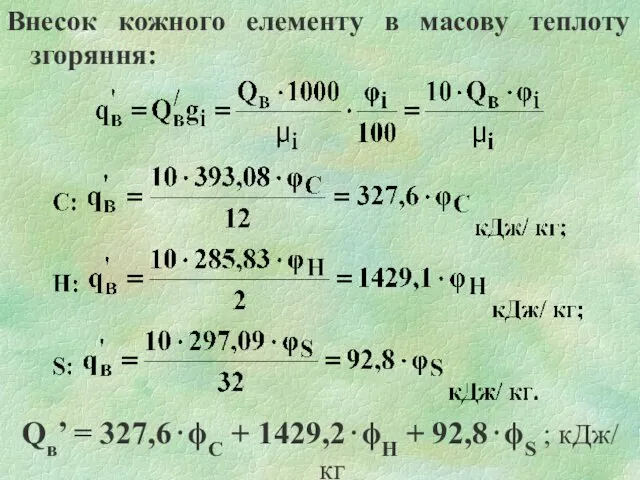
92,8⋅ϕS ; кДж/ кг
Слайд 14ФОРМУЛА МЕНДЄЛЄЄВА
Враховує наявність в ГР оксигену, нітрогену та вологи.
Вища теплота згоряння:
Q′в= 339,4ϕС

+1256,8ϕН +108,9(ϕS – ϕO – ϕN),
кДж/кг
Нижча теплота згоряння:
Qн / = Qв/ -Qконд
Qн/= 339,4⋅ϕС + 1256,8⋅ϕН + 108,9 (ϕS - ϕO - ϕN) –
– 25,1(9⋅ϕН + W), кДж/ кг
де W – мас. відсоток вологи в ГР
Слайд 15ПРАКТИЧНЕ ЗНАЧЕННЯ ТЕПЛОТИ ЗГОРЯННЯ
1) Використовують для розрахунку пожежної навантаги, що є характеристикою

теплового впливу пожежі на будівельні конструкції.
Пожежна навантага Р - кількість тепла, що може виділитися при згорянні речовин з одиниці поверхні підлоги приміщення.
Розрізняють постійну і тимчасову пожежну навантагу.
Слайд 162) Використовують для визначення горючості речовини.
Речовини є негорючими, якщо вони не

відносяться до вибухонебезпечних та їх Qн/ менша за 2100 кДж/кг або 1830 кДж/м3.
3) Використовують при розрахунку параметрів пожежної небезпеки речовин, таких як температура горіння, температура вибуху, максимальний тиск вибуху, нижча концентраційна межа поширення полум’я.
Слайд 173. ПОНЯТТЯ ТА ВИДИ
ТЕМПЕРАТУРИ ГОРІННЯ РЕЧОВИН
Температура горіння - температура, до якої

нагріваються продукти горіння в зоні реакції.
Розрахувати температуру горіння можна знаючи величину теплоти згоряння. Рівняння теплового балансу під час горіння має вигляд:
Qгор– Qнед = Qнагр. пг + Qтвт,
Залежно від умов, в яких протікає процес горіння, розрізняють температури горіння
калориметричну,
теоретичну,
адіабатичну,
дійсну.
Слайд 18Калориметрична температура горіння - температура, до якої нагріваються ПГ, якщо виконуються наступні

умови:
1) вихідна система знаходиться за стандартних умов (То=298 К, Ро=101,3 кПа);
2) відбувається повне згоряння ГР, при цьому повітря для горіння надходить у стехіометричному співвідношенні;
3) в процесі утворення ПГ не відбувається їх дисоціація;
4) немає тепловтрат від системи в навколишнє середовище.
Слайд 19Через відсутність тепловтрат і недопалу вважаємо, що все тепло, що виділилося під

час реакції, іде на нагрівання ПГ.
ПГ в зоні реакції мають високу температуру, отже вода в ПГ залишається в газоподібному стані, тому в розрахунках використовують нижчу теплоту згоряння.
Qнед = Qтвт = 0, Qнагрів пг = Qн
Слайд 20Якщо горіння відбувається за P=const, Qр=-ΔH.
Через відсутність теплообміну між системою і
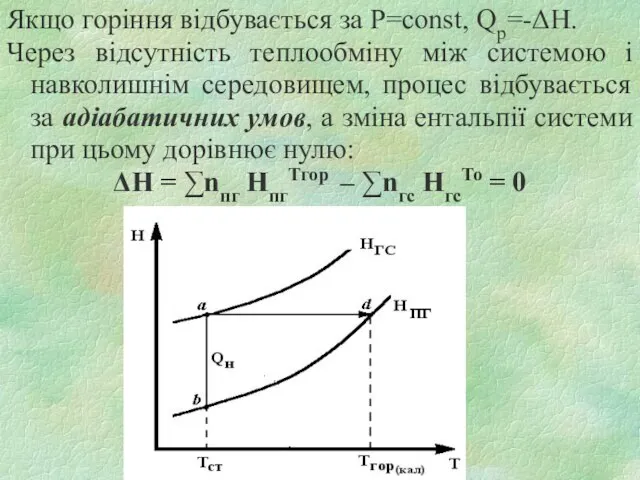
навколишнім середовищем, процес відбувається за адіабатичних умов, а зміна ентальпії системи при цьому дорівнює нулю:
ΔН = ∑nпг HпгТгор – ∑nгс HгсТо = 0
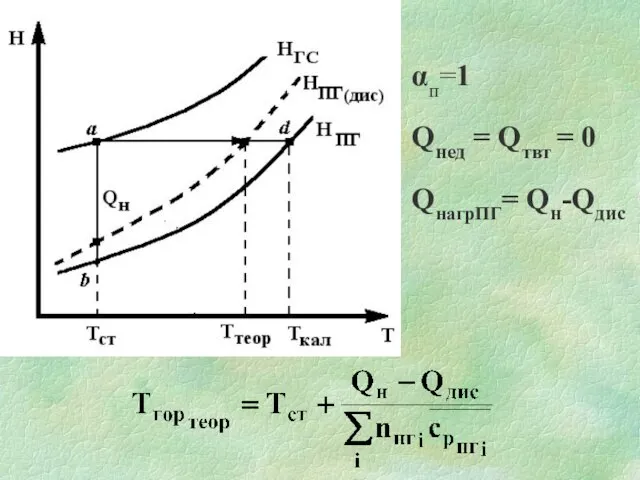
Слайд 21Якщо Тгор достатньо висока, то ПГ можуть дисоціювати з витратою значної кількості

тепла.
2СО2 = 2СО + О2 – 566 кДж
2Н2О = 2Н2 + О2 – 478 кДж
Теоретична температура горіння - ступінь нагрітості продуктів горіння з урахуванням їх дисоціації, якщо виконуються наступні умови:
1) вихідна ГС знаходиться за стандартних умов;
2) відбувається повне згоряння горючої суміші стехіометричного складу;
3) відбувається суттєва дисоціація ПГ;
4) немає тепловтрат від системи в навколишнє середовище.
Слайд 22αп=1
Qнед = Qтвт = 0
QнагрПГ= Qн-Qдис
Слайд 23Адіабатична температура горіння - температура, до якої нагріваються продукти горіння за умов:
1)

вихідна ГС знаходиться за стандартних умов;
2) горіння відбувається з надлишком чи нестачею повітря;
3) дисоціація ПГ не відбувається;
4) немає тепловтрат від системи в навколишнє середовище.
Слайд 24αп≥ 1
Qнед = Qтвт = 0
Qнагрів пг = Qн
nпг – дійсне число
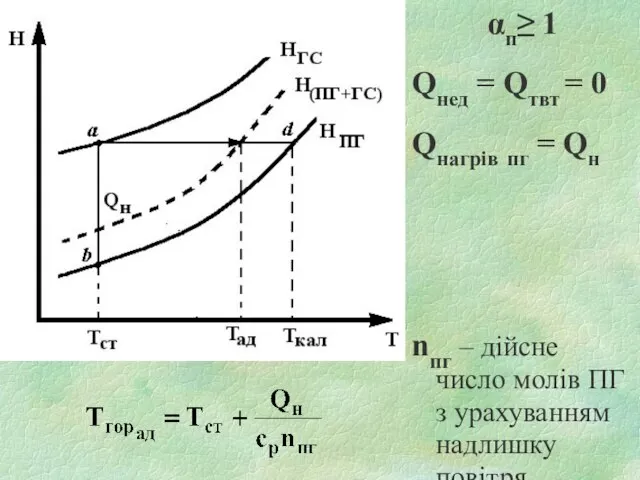
молів ПГ з урахуванням надлишку повітря
Слайд 25Дійсна температура горіння – температура, до якої нагріваються продукти горіння за реальних

умов, при цьому враховується:
1) горіння може проходити з надлишком або нестачею повітря,
2) значні тепловтрати у навколишнє середовище,
3) початкові умови, в яких знаходиться вихідна горюча суміш, можуть відрізнятися від стандартних..
Слайд 26де Qнедоп - кількість тепла, яка не реалізується в зоні горіння внаслідок

хімічного або фізичного недопалу.
Qнед = (1- η) Qн,
η - коефіцієнт повноти згоряння η = 0,9÷0,75
Qтвт - кількість тепла, що втрачається в навколишнє середовище.
Слайд 27Фактори, що впливають на Тгор:
1. То ↑ Тгор↑
2. Р ↑ Qдис↓ Тгор
↑
3. Qтвт ↑ Тгор ↓
4. Qн ↑ Тгор ↑
5. φнг↑ Тгор ↓
6. φО2↑ Тгор ↑
7. αп = 1 Тгор= max
αп < 1 Qнед ↑ Тгор ↓
αп > 1 Qтвт ↑ Тгор ↓











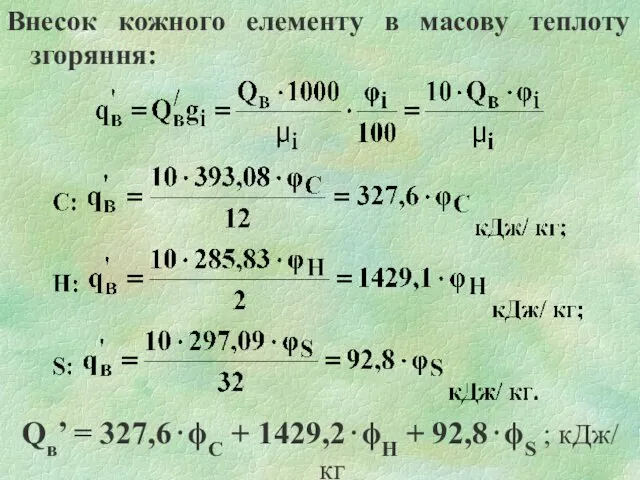














 М.Ю. Лермонтов «Демон»
М.Ю. Лермонтов «Демон» Спорт и спортсмены
Спорт и спортсмены Путешествие по морю Рукоделия
Путешествие по морю Рукоделия www.vocabul.ru
www.vocabul.ru Колесо жизни. Цели (большие или маленькие + умение планировать и достигать)
Колесо жизни. Цели (большие или маленькие + умение планировать и достигать) Черепахи
Черепахи Dlya_Andreya
Dlya_Andreya Аннотация проекта
Аннотация проекта УДИВИТЕЛЬНОЕ РЯДОМ
УДИВИТЕЛЬНОЕ РЯДОМ Партнерская программа по внедрению дистанционного образования для профессионального роста женщин-инженеров в Украине
Партнерская программа по внедрению дистанционного образования для профессионального роста женщин-инженеров в Украине Easter in France
Easter in France Объект политологии
Объект политологии ФАКУЛЬТЕТ ПОСЛЕДИПЛОМНОГО И ДОПОЛНИТЕЛЬНОГО ОБРАЗОВАНИЯ
ФАКУЛЬТЕТ ПОСЛЕДИПЛОМНОГО И ДОПОЛНИТЕЛЬНОГО ОБРАЗОВАНИЯ Волейбол
Волейбол Пособие мамам и папам, которые в одиночку воспитывают детей
Пособие мамам и папам, которые в одиночку воспитывают детей Брак в Древней Иудее
Брак в Древней Иудее Блок 23. Расчет показателей, связанных с населением
Блок 23. Расчет показателей, связанных с населением Написание и оформление автобиографии
Написание и оформление автобиографии Игромафия - интернет магазин
Игромафия - интернет магазин Здоровьесберегающие технологии в образовательном пространстве начальной школы Здоровьесберегающие технологии в образовательно
Здоровьесберегающие технологии в образовательном пространстве начальной школы Здоровьесберегающие технологии в образовательно История_Журналюги
История_Журналюги «Предкредитная обработка»
«Предкредитная обработка» Презентация на тему Звук и буква Л 1 класс
Презентация на тему Звук и буква Л 1 класс Культура питания
Культура питания СЛЕТ ЮНЫХ ТЕХНИКОВ
СЛЕТ ЮНЫХ ТЕХНИКОВ Есть ли жизнь в космосе,вне Земли?
Есть ли жизнь в космосе,вне Земли? Франция
Франция Презентация на тему Опасные погодные явления
Презентация на тему Опасные погодные явления