Слайд 2Цель урока:
Выяснить, что такое скорость химической реакции.
Выяснить, какие факторы и как влияют

на скорость химической реакции.
Слайд 3
Скорость химической реакции:
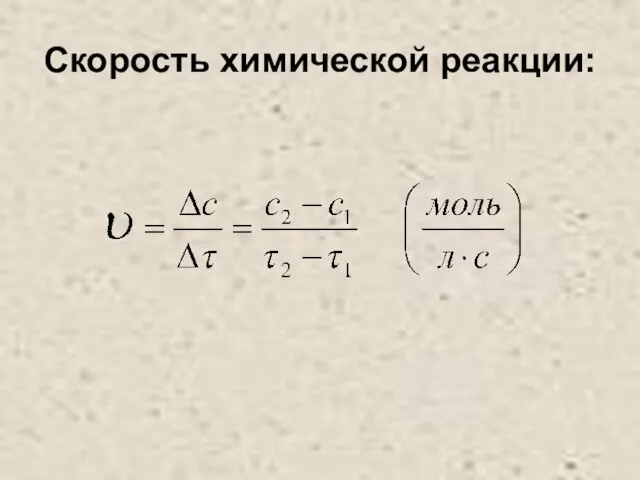
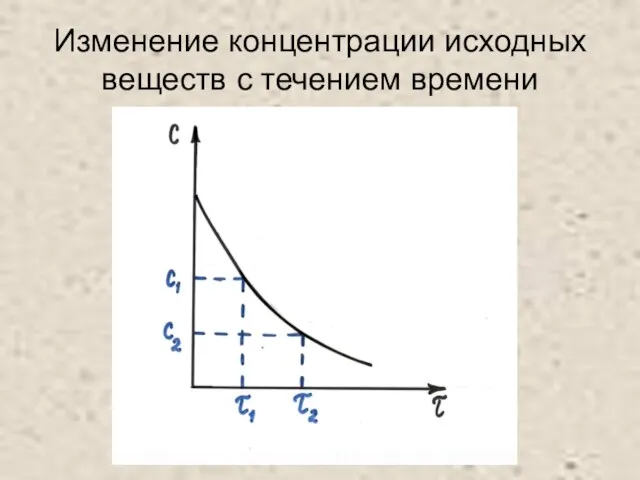
Слайд 4Изменение концентрации исходных веществ с течением времени
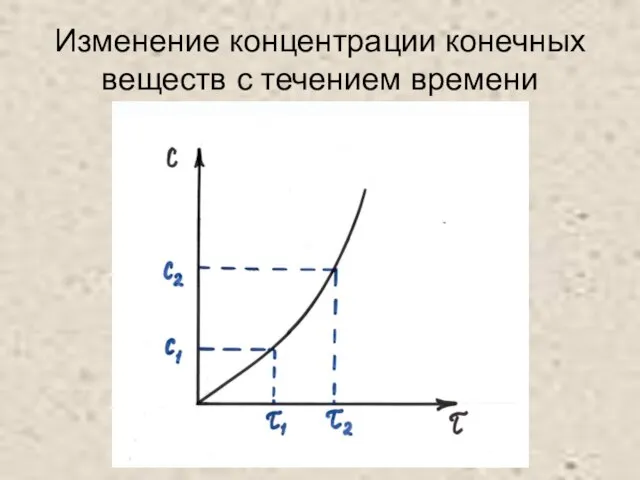
Слайд 5Изменение концентрации конечных веществ с течением времени
Слайд 6Скорость химической реакции в гомогенной системе:

Слайд 7Скорость химической реакции в гетерогенной системе:

Слайд 8Взаимодействие водорода с кислородом
2 моль H2 и 1 моль О2 при 25˚
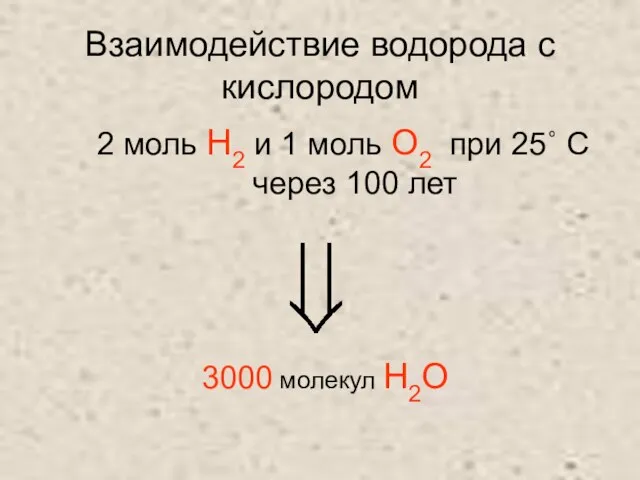
С
через 100 лет
3000 молекул H2О
Слайд 9Влияние на скорость реакции
различных факторов

Слайд 101) Природа реагирующих веществ
Zn + 2HCl = ZnCl2 + H2 ↑
Zn
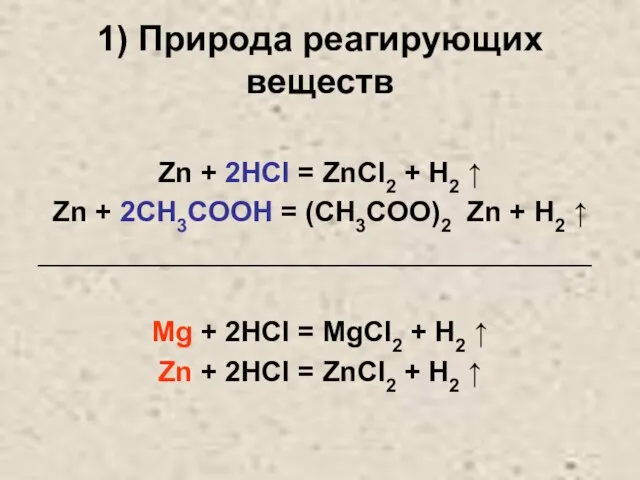
+ 2CH3COOH = (CH3COO)2 Zn + H2 ↑
___________________________________
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Слайд 112) Концентрация реагирующих веществ
Zn + 2HCl = ZnCl2 + H2 ↑
а) раствор

HCl
б) концентрированная HCl
Слайд 12Закон «действующих масс»:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.

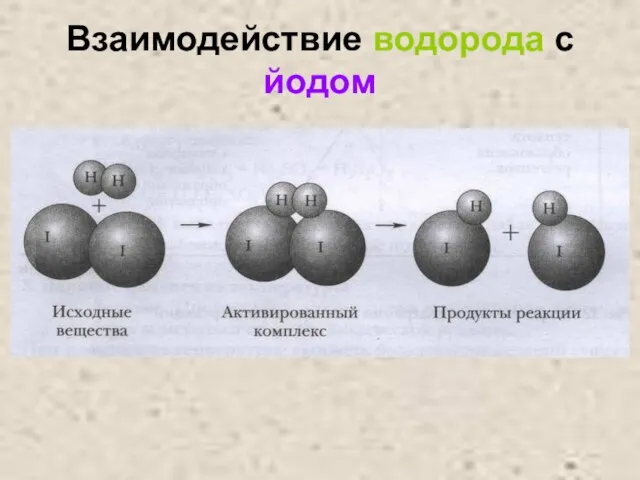
Слайд 13Взаимодействие водорода с азотом

Слайд 15
3) Величина поверхности соприкосновения реагирующих веществ
CaCO3 + 2HCl = CaCl2 + H2O

+ CO2 ↑
а) кусочек CaCO3
б) измельченный CaCO3
Слайд 164) Температура
Правило Вант-Гоффа:
При повышении температуры на каждые 100 C скорость большинства

реакций увеличивается в 2-4 раза.
Слайд 17Правило Вант-Гоффа:
Где - температурный коэффициент

Слайд 18Задача:
Во сколько раз увеличится скорость реакции?

Слайд 24Энергетическая диаграмма экзотермической реакции
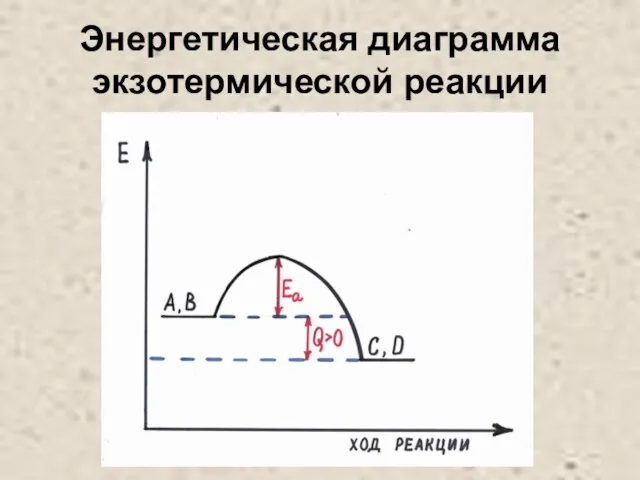
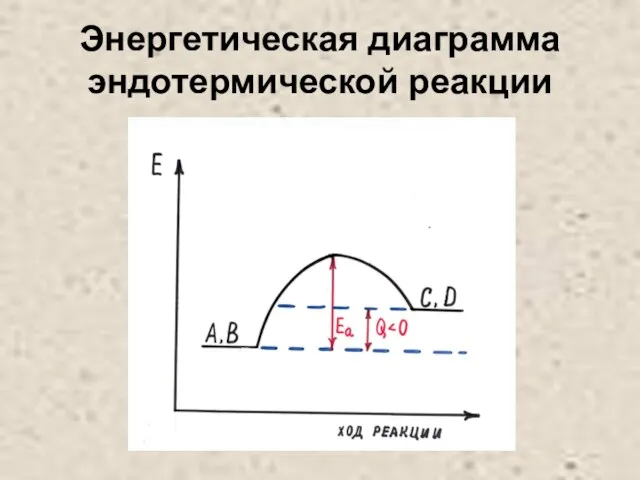
Слайд 25Энергетическая диаграмма эндотермической реакции
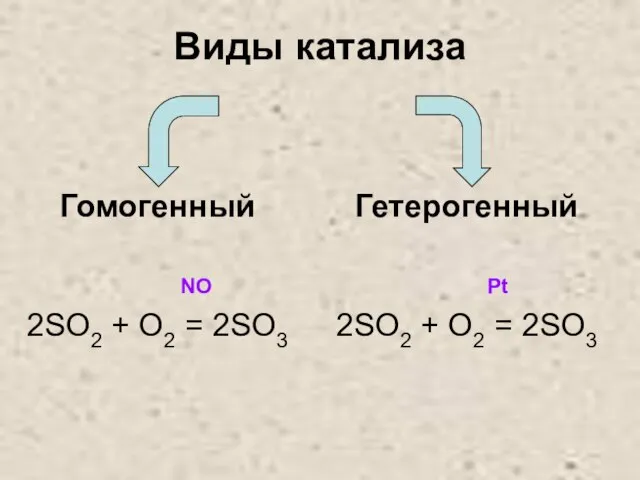
Слайд 26Виды катализа
Гомогенный
NO
2SO2 + O2 = 2SO3
Гетерогенный
Pt
2SO2 + O2 = 2SO3
Слайд 27Механизм действия катализаторов
Для гомогенного катализа:
K
A + B = AB
A + K

= [AK]
[AK] + B = AB + K
Слайд 28Окисление SO2 в SO3
NO
SO2 + ½ O2 = SO3
NO + ½

O2 = NO2
SO2 + NO2 = SO3 + NO
Слайд 29Разложение H2O2
раствор K2Cr2O7
2H2O2 = 2H2O + O2 ↑


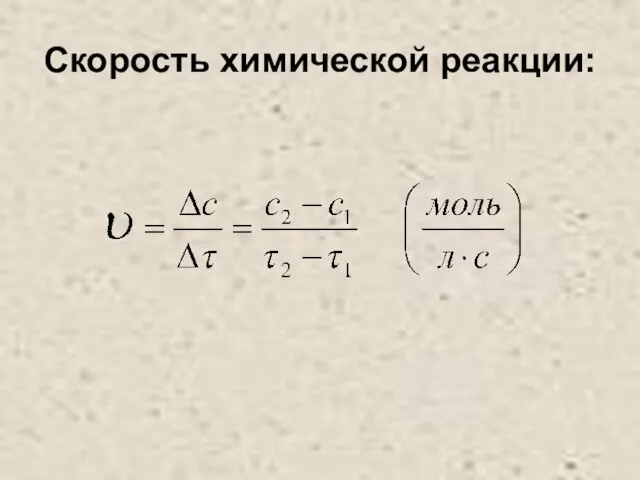























 Папа, мама, я – дружная, здоровая, спортивная семья! 2008 год
Папа, мама, я – дружная, здоровая, спортивная семья! 2008 год Сила упругости. Закон Гука. Физика
Сила упругости. Закон Гука. Физика Американська кінокомпнія 20th Century Fox
Американська кінокомпнія 20th Century Fox Құжаттардың кешенді жіктелуі
Құжаттардың кешенді жіктелуі Птицы леса
Птицы леса Презентация на тему Самопрезентация учителя начальных классов
Презентация на тему Самопрезентация учителя начальных классов Закон Божий. Глава 18
Закон Божий. Глава 18 03_PLOSKOST (1)
03_PLOSKOST (1) Колл-центр
Колл-центр Моя страна - моя Россия. Конкурс
Моя страна - моя Россия. Конкурс Интеграция платежей по картам стран СНГГенеральный Директор АзериКардЭльмар Садыхов
Интеграция платежей по картам стран СНГГенеральный Директор АзериКардЭльмар Садыхов Презентация на тему Многообразие птиц
Презентация на тему Многообразие птиц  Структура и содержание образовательной деятельности
Структура и содержание образовательной деятельности «Истории Священные страницы»
«Истории Священные страницы» lesson 2
lesson 2 Христофор колумб
Христофор колумб Сэкономьте свое время, оформите заказ с получением в МОБИЛЬНОМ ПУНКТЕ ВЫДАЧИ г. Красноярск 1. Разместите заказ: На сайте www.oriflame.ru
Сэкономьте свое время, оформите заказ с получением в МОБИЛЬНОМ ПУНКТЕ ВЫДАЧИ г. Красноярск 1. Разместите заказ: На сайте www.oriflame.ru  Social aspects of human ecology by sidda kanisha
Social aspects of human ecology by sidda kanisha KING OF COLD
KING OF COLD Конструирование юбки размер 40
Конструирование юбки размер 40 Миграция населения
Миграция населения Презентация на тему Отряд насекомоядные млекопитающие
Презентация на тему Отряд насекомоядные млекопитающие Законы Менделя
Законы Менделя Типология обществ (10 класс)
Типология обществ (10 класс) Сборка модели скорпиона и составление программы для её работы
Сборка модели скорпиона и составление программы для её работы Электронные библиотеки
Электронные библиотеки Курс «Основы религиозной культуры и светской этики»Модуль «Основы светской этики»
Курс «Основы религиозной культуры и светской этики»Модуль «Основы светской этики» Свет и его законы
Свет и его законы