Содержание
- 4. До начала работ по валидации процесса необходимо завершить квалификацию критического оборудования и вспомогательных систем. Квалификацию обычно
- 6. Технологический регламент – это нормативный документ, в котором изложены технологические методы, технические средства, нормы и нормативы
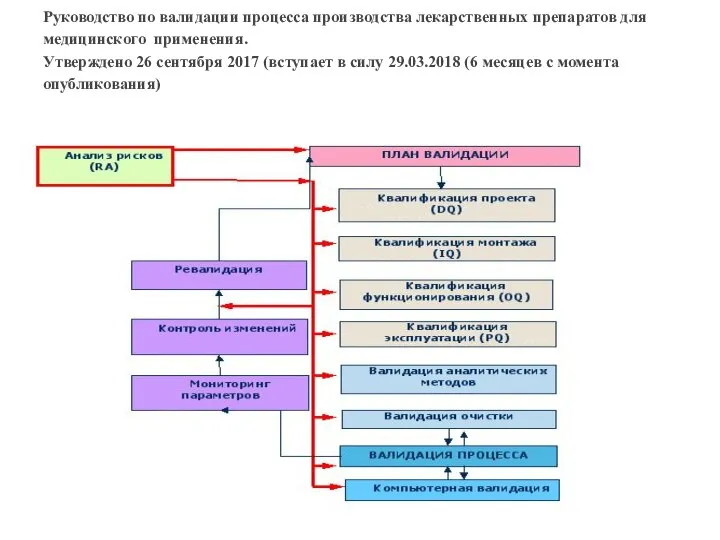
- 7. Руководство по валидации процесса производства лекарственных препаратов для медицинского применения. Утверждено 26 сентября 2017 (вступает в
- 8. По определению PIC/S, валидация это: «Действия, которые в соответствии с принципами GMP доказывают, что определенная методика,
- 9. ВАЛИДАЦИЯ ПРОЦЕССА Валидация процесса производства является документированным подтверждением того, что процесс в пределах установленных параметров может
- 10. процедура, дающая высокую степень уверенности в том, что конкретный процесс, метод или система будет последовательно приводить
- 11. Валидация необходима при: внедрении новых средств производства, контроля качества, систем обеспечения производства; внедрении новых лекарственных средств;
- 12. Общие положения Независимо от используемого при разработке лекарственного препарата подхода, традиционного или расширенного, до начала реализации
- 13. Валидация сама по себе не улучшает качества продукции. Ее результаты могут либо повысить степень гарантии качества,
- 14. Результаты валидации оформляются Отчетом о проведении валидации. Отчет оформляется отдельно для каждого конкретного вида продукта. Валидации
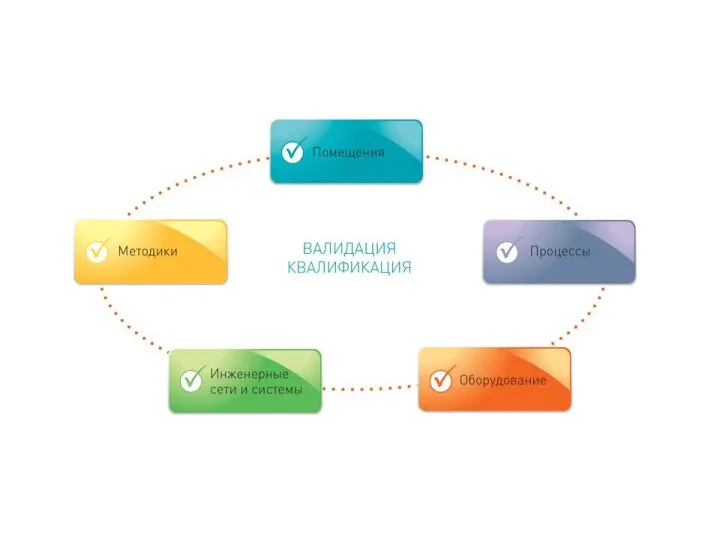
- 15. Квалификация (Qualification). Начальный этап валидации, который проводится для проверки и оценки проектной документации и условий производства
- 16. а) иногда работы по квалификации на стадиях OQ и PQ возможно и целесообразно проводить одновременно (например,
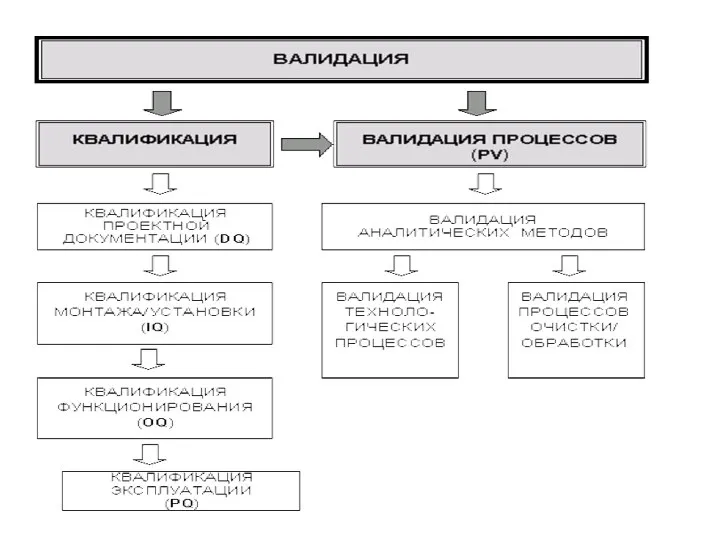
- 17. . Этапы валидации: 1. Квалификация (Qualification). 2. Валидация процессов (Process Validation - PV). Результаты всех стадий
- 18. . Виды валидации: Перспективная валидация. Проводится на вновь вводимом или реконструируемом производстве перед его пуском. При
- 19. Валидация оборудования Все производители оборудования указывают набор определенных характеристик своего продукта. Сюда относят: требуемые условия эксплуатации,
- 20. Валидация процесса Традиционная валидация процесса Традиционная валидация процесса, как правило, выполняется по завершении фармацевтической разработки и
- 21. Проведение полных валидационных исследований на опытно-промышленных сериях, в целом, считается нецелесообразным, поэтому для каждого лекарственного препарата
- 22. Должны быть представлены данные по валидации как минимум трех серий промышленного масштаба, если не обосновано иное
- 23. Для внедрения и поддержания непрерывной верификации процесса требуются знание и понимание процесса. Масштаб и степень применения
- 24. Непрерывная верификация процесса может быть введена на любом этапе жизненного цикла продукта. Этот подход может быть
- 25. Валидация процесса начинается уже на стадии его разработки. Полностью процесс валидируется при внедрении его в коммерческое
- 26. Разработка фармацевтического продукта и процесса его производства На первой стадии жизненного цикла производится сбор данных о
- 27. Технологическое пространство процесса содержит, с одной стороны, требования ко всем элементам технологического процесса, т.е. к сырью
- 28. Рекомендуется применять и различные инструменты анализа рисков, в частности, систему НАССР (Hazard Analysis and Critical Control
- 29. Квалификация эксплуатации (Performance Qualification – PQ). PQ- является вторым элементом стадии квалификации технологического процесса и проводится
- 30. Успешное выполнение PQ, показывает, что достигнут важный пункт в жизненном цикле продукции. Т.к. именно успешное выполнение
- 31. Протокол квалификация эксплуатации (Protocol PQ). Для этой стадии валидации процесса необходимо наличие письменного документа (протокола), который
- 32. Комбинированный подход Допускается использование также комбинированного подхода, заключающегося в применении традиционного подхода к валидации и непрерывной
- 33. Если не было показано что параметры, изученные при разработке проектного поля, масштабируются независимо от масштаба производства,
- 34. Масштабирование Во избежание повторения длительных и дорогостоящих испытаний необходимо должным образом организовать сбор информации и данных
- 35. Пострегистрационный контроль изменений Необходимо установить четкие процедуры для управления изменениями, предлагаемыми для производственного процесса. Такие процедуры
- 36. Общая схема проведения валидации на действующем производстве
- 37. Для планирования валидации используется документация 1. Проектная документация, разработанная в установленном порядке. 2. Приемно-сдаточная документация, подтверждающая
- 38. Примерное содержание валидационного плана (Рекомендуемое) Валидационный план включает в себя следующие положения, информацию, документы: 1. Цели
- 39. Схема валидации процесса в регистрационном досье должна содержать следующую информацию: краткое описание процесса с указанием критических
- 42. Скачать презентацию
Слайд 4До начала работ по валидации процесса необходимо завершить квалификацию критического оборудования и
До начала работ по валидации процесса необходимо завершить квалификацию критического оборудования и

квалификация проекта: документально оформленное подтверждение того, что предложенный проект производственных помещений, оборудования или систем является пригодным для применения по назначению.
квалификация монтажа: документально оформленное подтверждение того, что монтаж помещений, систем и оборудования (установленных или модифицированных) выполнен в соответствии с утвержденным проектом, рекомендациями изготовителя и (или) требованиями производителя лекарственных средств.
квалификация функционирования: документально оформленное подтверждение того, что помещения, системы и оборудование (установленные или модифицированные) функционируют в соответствии со своим предназначением во всех предусмотренных режимах работы.
квалификация эксплуатации: документально оформленное подтверждение того, что помещения, системы и оборудование при совместном использовании работают эффективно и с воспроизводимыми показателями в соответствии с установленными требованиями и характеристиками процесса.
Слайд 6Технологический регламент – это нормативный документ, в котором изложены технологические методы, технические
Технологический регламент – это нормативный документ, в котором изложены технологические методы, технические

Стадия производства – совокупность технологических операций, приводящих к получению промежуточного продукта (на конечной стадии – готового продукта). Например, процесс получения таблеток включает следующие производственные стадии: смешивание, гранулирование, прессование. Каждая стадия, в свою очередь, представляет собой сочетание ряда последовательных технологических операций.
Технологическая операция – часть технологического процесса, связанная с обслуживанием одного из основных видов оборудования. Например, в производстве таблеток такими операциями являются: измельчение ингредиентов, взвешивание, просеивание, увлажнение смеси, подлежащей гранулированию и т. д.
Технологическая схема производства должна наглядно (графически в виде блок-схемы) отображать последовательность выполнения работ в данном производстве с подразделением их по стадиям и операциям технологического процесса, указанием основных материальных и энергетических коммуникаций (поступление сырья, подача пара, воды, мест образования отходов, сточных вод, выбросов в атмосферу).
Слайд 7Руководство по валидации процесса производства лекарственных препаратов для медицинского применения.
Утверждено 26 сентября
Руководство по валидации процесса производства лекарственных препаратов для медицинского применения. Утверждено 26 сентября
Слайд 8По определению PIC/S, валидация это:
«Действия, которые в соответствии с принципами GMP доказывают,
По определению PIC/S, валидация это: «Действия, которые в соответствии с принципами GMP доказывают,

Валидация
Исследования по валидации должны способствовать надлежащей практике производства; их следует проводить в соответствии с установленными процедурами. Результаты и заключения должны быть оформлены протоколами.
Если вводят новую производственную рецептуру или новый способ изготовления, то должны быть предприняты действия, демонстрирующие их пригодность для серийного производства. Должно быть доказано, что установленный процесс при использовании специфицированных веществ и оборудования позволяет постоянно получать продукцию требуемого качества.
Существенные изменения производственного процесса, включая любое изменение оборудования или материалов, которое может повлиять на качество продукции и/или воспроизводимость процесса, должны пройти валидацию.
Процессы и процедуры следует подвергать периодической критической ревалидации, чтобы гарантировать, что они по-прежнему способны приводить к ожидаемым результатам.
Слайд 9ВАЛИДАЦИЯ ПРОЦЕССА
Валидация процесса производства является документированным подтверждением того, что процесс в пределах
ВАЛИДАЦИЯ ПРОЦЕССА
Валидация процесса производства является документированным подтверждением того, что процесс в пределах

Слайд 10процедура, дающая высокую степень уверенности в том, что конкретный процесс, метод или
процедура, дающая высокую степень уверенности в том, что конкретный процесс, метод или

Слайд 11Валидация необходима при:
внедрении новых средств производства, контроля качества, систем обеспечения производства;
Валидация необходима при:
внедрении новых средств производства, контроля качества, систем обеспечения производства;

внедрении новых лекарственных средств;
изменении в средствах производства, системах обеспечения, технологии, методиках;
периодической проверке функционирования
Слайд 12Общие положения
Независимо от используемого при разработке лекарственного препарата подхода, традиционного или
Общие положения
Независимо от используемого при разработке лекарственного препарата подхода, традиционного или

Валидация процесса должна подтвердить, что процесс правильно разработан и способен обеспечивать качество продукции.
Валидация должна охватывать все предназначенные для реализации дозировки и все производственные участки, используемые для производства товарного продукта.
Для различных дозировок, размеров серии и размеров упаковки может быть приемлем выбор крайних вариантов (брекетинг), тем не менее, валидация должна выполняться на всех предлагаемых производственных участках. Данные по валидации процесса должны подтверждать пригодность процесса для всех продуктов и на каждом производственном участке.
Валидация должна проводиться в соответствии с требованиями GMP, полученные данные должны быть собраны по месту производства и доступны для инспекции, если предоставление их в регистрационное досье не требуется (как это указано в разделе VIII настоящего Руководства).
Слайд 13Валидация сама по себе не улучшает качества продукции. Ее результаты могут либо
Валидация сама по себе не улучшает качества продукции. Ее результаты могут либо

Организация работ и ответственность определены разделом 7 Стандарта отрасли ОСТ 42-510 (GMP).
Каждое предприятие-производитель должно определить, какая работа по валидации необходима для доказательства того, что в его конкретном случае все критические условия/параметры, используемые при производстве лекарственных средств, находятся под контролем.
Валидации подлежат:
1. Технологические процессы.
2. Аналитические методы.
3. Процессы очистки оборудования, коммуникаций и др.
4. Процессы санитарной обработки помещений и др.
5. Технологическое и лабораторное оборудование.
6. Инженерные системы, непосредственно влияющие на качество полупродукта и готового продукта (обеспечение чистым воздухом, водой, паром, инертным газом, сжатым воздухом и др.).
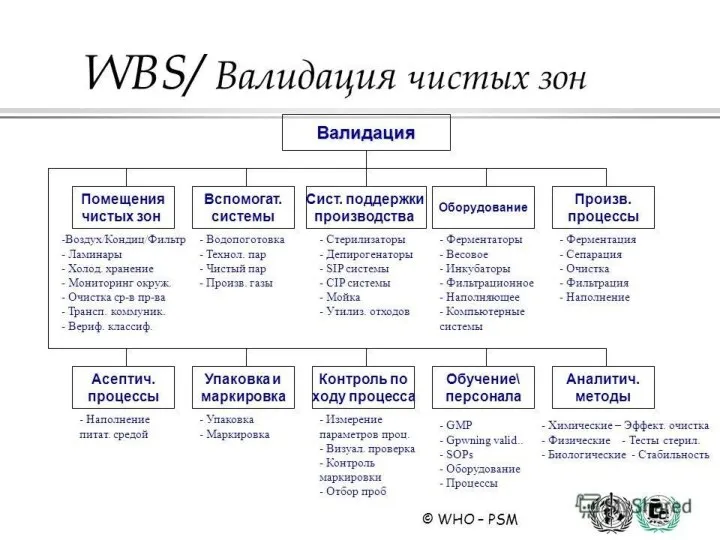
7. "Чистые" помещения и зоны, "холодные" комнаты и др.
8. Компьютерные системы, связанные с процессом и контролем
Слайд 14Результаты валидации оформляются Отчетом о проведении валидации. Отчет оформляется отдельно для каждого
Результаты валидации оформляются Отчетом о проведении валидации. Отчет оформляется отдельно для каждого

Валидации не подлежат:
1. Оборудование, не влияющее на качество полупродукта и/или готового продукта.
2. Инженерные системы, непосредственно не влияющие на качество продукта, но обеспечивающие устойчивость процесса производства (системы энергообеспечения, паро- и водоснабжения и др.).
3. Общие конструктивные элементы зданий и помещений.
4.Вспомогательные компьютерные системы, непосредственно не связанные с процессом производства.
Слайд 15Квалификация (Qualification).
Начальный этап валидации, который проводится для проверки и оценки проектной
Квалификация (Qualification).
Начальный этап валидации, который проводится для проверки и оценки проектной

Квалификация проводится в указанной последовательности по следующим стадиям:
Квалификация проектной документации (Design Qualification - DQ). Проводится проверка и оценка документации на соответствие требованиям Стандарта отрасли ОСТ 42-510 (GMP).
Квалификация монтажа (Installation Qualification - IQ). Проводится проверка и оценка качества монтажа/установки технологического и лабораторного оборудования, инженерных систем, (чистых помещений и др. Квалификация функционирования (Operational Qualification - OQ). Проводится проверка и оценка работоспособности технологического и лабораторного оборудования, инженерных систем, оснащенных чистых помещений и др.
Квалификация эксплуатации (Performance Qualification - PQ). Проводится проверка и оценка надежности и эффективности эксплуатационных параметров технологического оборудования, инженерных систем, функционирующих (чистых( помещений и др.
Слайд 16а) иногда работы по квалификации на стадиях OQ и PQ возможно и
а) иногда работы по квалификации на стадиях OQ и PQ возможно и

б) квалификация технологического оборудования на стадии OQ может проводиться как с использованием, так и без использования имитатора препарата;
в) квалификация технологического оборудования на стадии PQ проводится с использованием имитатора препарата или одной серии реального продукта (при необходимости и целесообразности) с целью завершения квалификации.
Валидация процессов (Process Validation - PV).
Завершающий этап валидации, который проводится после выполнения всех стадий квалификации условий производства (оборудование, инженерные системы, помещения и др.) в зависимости от вида валидации.
PV проводится раздельно по каждому процессу с использованием образцов не менее трех серий реального продукта.
Валидации подлежат как вновь создаваемые (реконструируемые), так и действующие производства (производственные участки, цеха и т.п.).
Слайд 17. Этапы валидации:
1. Квалификация (Qualification).
2. Валидация процессов (Process Validation -
. Этапы валидации:
1. Квалификация (Qualification).
2. Валидация процессов (Process Validation -

Результаты всех стадий квалификации (DQ,IQ,OQ,PQ) и валидации процессов (PV) оформляются (обязательно во время проведения работ) валидационными протоколами.
Слайд 18. Виды валидации:
Перспективная валидация. Проводится на вновь вводимом или реконструируемом производстве
. Виды валидации:
Перспективная валидация. Проводится на вновь вводимом или реконструируемом производстве

Сопутствующая валидация. Проводится аналогично перспективной во время серийного производства, если оно не было валидировано ранее. При сопутствующей валидации обязательно проведение всех стадий квалификации (DQ,IQ,OQ,PQ) и валидации процессов и аналитических методов.
Ретроспективная валидация. Валидация процессов и аналитических методов проводится во время серийного производства нестерильных лекарственных средств (если оно не было валидировано ранее) на основе анализа ранее полученных документально подтвержденных данных.
Повторная валидация (ревалидация).
а) Проводится в плановом порядке в сроки, устанавливаемые предприятием в Отчете о проведении валидации.
б) Проводится до возобновления производства в случаях изменения документации и/или условий производства, которые могут повлиять на качество полупродукта и готового продукта, Объем валидационных работ определяется предприятием исходя из внесенных изменений.
Слайд 19Валидация оборудования
Все производители оборудования указывают набор определенных характеристик своего продукта.
Сюда относят:
Валидация оборудования
Все производители оборудования указывают набор определенных характеристик своего продукта.
Сюда относят:

Для пользователей наибольший интерес представляют диапазон работы, точность и стабильность.
Последних два параметра наиболее часто исследуются в ходе валидации, как наиболее критичные для качества продукта. Валидация оборудования состоит в подтверждении соответствия параметров точности заявленной в спецификации. Таким образом, если оборудование было впервые установлено, следует провести его валидацию. Для некоторых типов оборудования валидацию следует проводить также после каждого перемещения
Слайд 20Валидация процесса
Традиционная валидация процесса
Традиционная валидация процесса, как правило, выполняется по завершении
Валидация процесса
Традиционная валидация процесса
Традиционная валидация процесса, как правило, выполняется по завершении

В рамках жизненного цикла процесса некоторые исследования по валидации могут быть выполнены на опытно-промышленных сериях до масштабирования процесса. Следует отметить, что размер опытно-промышленной серии должен соответствовать, по меньшей мере, 10 % от размера серии промышленного масштаба (то есть коэффициент масштабирования должен быть не более 10).
Для твердых пероральных лекарственных форм размер опытно-промышленной серии, как правило, должен быть не менее 10 % от максимального размера серии промышленного масштаба или 100 000 единиц в зависимости от того, что больше (при этом для ветеринарных препаратов при предоставлении обоснования минимальный размер опытно-промышленной серии может быть меньше, чем 100 000 единиц).
Если предполагаемый размер промышленной серии менее 100 000 единиц, прогностическое значение результатов валидации, полученных на опытно-промышленных сериях может быть ограничено, и использование такого подхода должно быть обосновано. Для других лекарственных форм размер опытно-промышленной серии должен быть обоснован с учетом риска для пациента, обусловленного несоответствием качества для данной лекарственной формы.
Слайд 21Проведение полных валидационных исследований на опытно-промышленных сериях, в целом, считается нецелесообразным, поэтому
Проведение полных валидационных исследований на опытно-промышленных сериях, в целом, считается нецелесообразным, поэтому

В таких случаях данные на ряд последовательных серий промышленного масштаба должны быть представлены до утверждения регистрационного досье. Количество серий должно быть обосновано, исходя из изменчивости процесса, сложности процесса (продукта), знаний о процессе, полученных в ходе разработки, подтверждающих
Слайд 22Должны быть представлены данные по валидации как минимум трех серий промышленного масштаба,
Должны быть представлены данные по валидации как минимум трех серий промышленного масштаба,

Валидационные исследования должны включать критические этапы процесса, включая, при необходимости, проведение дополнительных испытаний.
Непрерывная верификация процесса
В качестве альтернативы традиционной валидации процесса может быть использован подход непрерывной верификации процесса, при котором пригодность процесса постоянно контролируется и оценивается. Подход непрерывной верификации процесса может быть использован дополнительно к традиционной валидации процесса или заменять ее.
Подход непрерывной верификации процесса является научным и основанным на оценке рисков подходом для проверки и подтверждения в режиме реального времени того, что процесс, проводимый в рамках установленных параметров, по утвержденной документации, постоянно приводит к получению продукции, соответствующей всем критическим показателям качества (CQAs) и требованиям стратегии контроля.
15. Применение подхода непрерывной верификации процесса для производителя (заявителя) означает проведение обширного мониторинга процесса методами «в линии», «у линии» или «вне линии» 11 и контроль качества продукции и пригодности процесса для каждой серии. Должны быть собраны соответствующие данные по показателям качества исходных материалов или компонентов, промежуточных продуктов и готовой продукции. Также данные должны включать верификацию и оценку критических показателей качества и критических параметров процесса (СРР), в том числе оценку тенденций. В качестве инструментов для практической реализации непрерывной верификации процесса могут быть использованы процессно-аналитические технологии (PAT), такие как спектроскопия в ближней инфракрасной области спектра (например, для определения однородности при смешивании, площади поверхности гранул, однородности содержания для выборок большого размера) и многомерный статистический контроль процессов (SPC).
Слайд 23Для внедрения и поддержания непрерывной верификации процесса требуются знание и понимание процесса.
Для внедрения и поддержания непрерывной верификации процесса требуются знание и понимание процесса.

а) наличие предварительных знаний по разработке и производству для аналогичных продуктов и (или) процессов;
б) степень понимания процесса, полученная в ходе исследований при его разработке и в результате опыта коммерческого производства;
в) сложность продукта и (или) производственного процесса;
г) уровень автоматизации процессов и используемых аналитических технологий;
д) сведения (при необходимости), основанные на жизненном цикле продукта, устойчивости процесса и опыте коммерческого производства для существующих продуктов.
Обоснование пригодности и целесообразности подхода непрерывной верификации процесса должно быть включено в раздел «Фармацевтическая разработка» регистрационного досье лекарственного препарата и подтверждено данными по крайней мере лабораторных или опытно-промышленных серий. Описание системы непрерывной верификации процесса, включая подлежащие контролю параметры процесса и показатели материалов, применяемые для контроля аналитические методики, должно быть включено в регистрационное досье с перекрестной ссылкой на раздел «Валидация» (как это указано в приложении № 1 к настоящему Руководству). Фактические данные, получаемые в ходе непрерывной верификации процесса промышленного масштаба, должны быть доступны при проведении инспекции производственного участка. Заявитель должен определить и обосновать выбор критических стадий процесса и завершить валидационные исследования до начала реализации продукции. Должно быть представлено обоснование количества серий, которые будут использованы для валидации в зависимости от сложности и ожидаемой изменчивости процесса и имеющегося опыта производственного участка. Непрерывная верификация процесса считается наиболее подходящим методом валидации непрерывных процессов.
Слайд 24Непрерывная верификация процесса может быть введена на любом этапе жизненного цикла продукта.
Непрерывная верификация процесса может быть введена на любом этапе жизненного цикла продукта.

Выполнение непрерывной верификации процесса осуществляют с соблюдением принципов и требований правил надлежащей производственной практики Евразийского экономического союза. Фармацевтические системы качества (PQS) могут дополнять требования правил надлежащей производственной практики Евразийского экономического союза.
Тем не менее, вопросы, относящиеся к самой процедуре соблюдения правил надлежащей производственной практики Евразийского экономического союза и фармацевтической системы качества не должны включаться в регистрационное досье, поскольку оценка данных вопросов выполняется при инспектировании промышленного производства лекарственных препаратов на соответствие требованиям Правил надлежащей производственной практики Евразийского экономического союза.
Слайд 25Валидация процесса начинается уже на стадии его разработки. Полностью процесс валидируется при
Валидация процесса начинается уже на стадии его разработки. Полностью процесс валидируется при

С самого начала разработки процесса необходимо проводить анализ рисков, способных помешать выпуску продукции надлежащего качества. Систему управления процессом (контроль процесса) следует создавать с учетом выявленных рисков. При этом валидация процесса также проводится с учетом выявленных рисков, в том числе и для ситуаций относящихся к «наихудшему случаю».
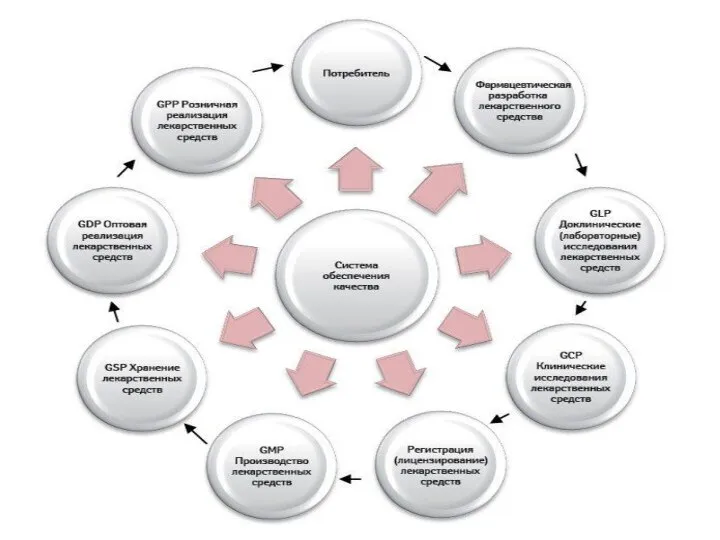
Согласно современному подходу к обеспечению качества лекарственных препаратов, каждый фармацевтический продукт проходит четыре последовательных стадии жизненного цикла
Разработка продукта и процесса его производства (Product and Process Design);
Внедрение продукта и процесса в коммерческое производство (Technology Transfer);
Коммерческое производство продукта (Manufacturing);
Снятие продукта с производства (Product Descontinuation).
Слайд 26Разработка фармацевтического продукта и процесса его производства
На первой стадии жизненного цикла
Разработка фармацевтического продукта и процесса его производства
На первой стадии жизненного цикла

Также определяется стратегия управления производственным процессом (Process Control), которая позволит эффективно и надежно поддерживать технологические параметры в заданной области значений.
Рекомендуется на этой стадии использовать такие инструменты, как анализ рисков, а также планирование эксперимента (Design of Experiments –DOE). С их помощью можно существенно сократить объем и продолжительность исследований, как в лабораторном, так и в полупромышленном (пилотном) масштабе. Более того, они позволяют эффективно выявить изменчивость и взаимозависимость технологических параметров, а также выработать эффективные меры контроля критических этапов процесса.
От разработчиков требуется предоставить многократно проверенные (статистически достоверные) доказательства того, что, несмотря на любые допустимые изменения сырья, материалов, технологических сред (вода, пар, сжатый воздух), качества производственной среды, технологических параметров, персонала и др., процесс будет гарантированно обеспечивать продукцию надлежащего качества. Для этого разработчику сначала требуется определить:
а) научно и экспериментально обоснованные количественные и качественные требования (диапазоны допустимых значений) ко всем элементам производственного процесса, соблюдение которых позволит гарантировать выпуск продукции надлежащего качества;
б) перечень контрольных мер (мер по управлению процессом), с помощью которых обеспечивается удержание всех элементов производственного процесса внутри их диапазонов допустимых значений, и, тем самым, гарантируется выпуск продукции надлежащего качества;
Именно эти две составляющих технологической разработки образуют, так называемое, технологическое пространство процесса (Design Space).
Слайд 27Технологическое пространство процесса содержит, с одной стороны, требования ко всем элементам технологического
Технологическое пространство процесса содержит, с одной стороны, требования ко всем элементам технологического

Самым тщательным образом следует отрабатывать именно контрольные функции. Для этого необходимо проводить испытания в искусственно создаваемых ситуациях (наихудший случай- Worst Case), которые соответствуют наихудшим (граничным) значениям допустимых диапазонов технологических параметров. Эффективность мер контроля (управления) технологическим процессом следует многократно проверять для получения надежного результата.
Чтобы свести к минимуму число повторных испытаний, уже на ранних стадиях в исследованиях и разработках рекомендуется применять планирование экспериментов (Design of Experiments – DOE). DOE позволяет получить статистически достоверную информацию о взаимной зависимости различных технологических параметров и значительно сократить объем и продолжительность работ. DOE также дает возможность кротчайшим путем выявить область оптимальных значений технологических параметров.
Слайд 28Рекомендуется применять и различные инструменты анализа рисков, в частности, систему НАССР (Hazard
Рекомендуется применять и различные инструменты анализа рисков, в частности, систему НАССР (Hazard

Весь процесс технологических исследований и разработок рекомендуется строго документировать в соответствии с надлежащей практикой документирования (Good Documentation Practice).
Слайд 29Квалификация эксплуатации
(Performance Qualification – PQ).
PQ- является вторым элементом стадии квалификации
Квалификация эксплуатации
(Performance Qualification – PQ).
PQ- является вторым элементом стадии квалификации

Успешное выполнение PQ должно подтвердить правильность определения технологического пространства процесса (Design Space) и продемонстрировать, что промышленный производственный процесс проводится так, как ожидалось.
Слайд 30Успешное выполнение PQ, показывает, что достигнут важный пункт в жизненном цикле продукции.
Успешное выполнение PQ, показывает, что достигнут важный пункт в жизненном цикле продукции.

Во многих случаях PQ предполагает использование большего объема отбора проб и проведения большего числа тестов, чем в обычном производстве. Уровни мониторинга процесса и проводимых испытаний должны быть такими, чтобы подтвердить однообразие качества продукта во всей партии. Предполагается, что таким более высоким уровнем тестирования следует сопровождать всю стадию квалификации процесса.
Обращается внимание на то, что если в процессе производства используются материалы с ограниченным сроком действия (например, фильтры или хроматографические сорбенты), то повторное их использование без потери качества продукта, может быть подтверждено соответствующими лабораторными исследованиями. Однако, при выполнении PQ в коммерческом производстве, следует подтвердить установленные сроки годности таких материалов.
Слайд 31Протокол квалификация эксплуатации (Protocol PQ).
Для этой стадии валидации процесса необходимо наличие письменного
Протокол квалификация эксплуатации (Protocol PQ).
Для этой стадии валидации процесса необходимо наличие письменного

- описание условий производства, включая технологические параметры, их предельные значения и требования к сырью и материалам.
- перечень данных, которые собираются при испытаниях, когда и как они оцениваются;
- перечень тестов, которые выполняются в процессе производства и критерии приемлемости для каждого значительного этапа производства;
- план отбора проб, включая точки отбора проб, число проб, частоту отбора проб для каждой операции. При этом необходимо, чтобы число проб было достаточным, чтобы получить статистически достоверную информацию о качестве продукции как внутри одной партии, так и сравнительную между партиями;
- критерий для принятия обоснованного заключения о том, что процесс обеспечивает производство продукции надлежащего качества (этот критерий должен включать описание статистических методов, используемых для оценки всех собранных данных, а также порядок учета и обработки данных о выявленных отклонениях);
- данные о проекте производственных помещений, о квалификации технологического оборудования и систем технологических сред, об обучении персонала и о проверке сырья и материалов;
- статус валидации аналитических методов, используемых при измерениях, выполняемых в процессе производства, контроле качества полупродуктов и готовой продукции;
- проверку и утверждение соответствующими службами предприятия и отделом контроля качества.
Выполнение работ по протоколу квалификации эксплуатации и составление отчета.
Работы по протоколу PQ не начинаются до проверки и утверждения протокола PQ соответствующими отделами и отделом контроля качества. Отклонения от протокола PQ, должны быть обоснованы, рассмотрены и утверждены всеми указанными отделами.
Производственный процесс должен выполняться в соответствии с условиями регламента. Партии продукции при PQ следует нарабатывать в нормальных условиях и с тем же производственным персоналом, который будет работать на всех участках производства при коммерческом выпуске продукта. Нормальные производственные условия, должны включать в себя технологические среды (такие как, например, сжатый воздух и вода фармацевтического качества), материалы, персонал, качество производственной среды и производственные процедуры.
После выполнения работ по протоколу PQ следует своевременно составить отчет о выполненных работах. В него необходимо включать:
- обсуждение и рассмотрение всех аспектов протокола;
- итоговый обзор и анализ собранных данных, как это предписывается протоколом;
- оценка любых неожиданных наблюдений и полученных дополнительных данных, которые не были указаны в протоколе;
- обзор и обсуждение всех несоответствий производственного процесса (таких как отклонения и расхождение результатов испытаний) или любой другой информации, способной поставить под сомнение валидированность процесса;
- детальное описание любых корректирующих действий или изменений, которые необходимо было предпринять в существующих технологических операциях и мерах контроля;
- ясное заключение о том, что полученные данные показывают, что процесс отвечает условиям, определенным в протоколе и, что процесс находится в соответствующем состоянии контроля. Это заключение необходимо делать, на основании документированных доказательств для того, чтобы получить разрешение на процесс и на реализацию партий продукции, выпущенной при PQ. Если это не достигнуто, то в отчете следует указать, что необходимо сделать, чтобы достичь такое состояние при повторном PQ.
- включать данные о проверке и утверждении отчета всеми обозначенными отделами и отделом контроля качества.
Слайд 32Комбинированный подход
Допускается использование также комбинированного подхода, заключающегося в применении традиционного подхода
Комбинированный подход
Допускается использование также комбинированного подхода, заключающегося в применении традиционного подхода

Проектное поле обычно разрабатывается на основе лабораторных или опытно-промышленных серий. При масштабировании коммерческий процесс, как правило, проводят и валидируют в определенной области проектного поля, которая определена как целевой интервал или нормальный рабочий диапазон. В течение жизненного цикла продукта изменение параметров и характеристик процесса в пределах проектного поля (то есть в пределах рабочих диапазонов процесса и показателей качества материалов) может привести к появлению более высоких или не выявленных при разработке неизвестных рисков. По этой причине, а также в зависимости от того, как изначально было определено проектное поле и валидирован процесс, может понадобиться подтверждение пригодности новой области в рамках проектного поля (путем предоставления доказательств того, что все показатели качества продукции все еще соответствуют установленным критериям), то есть «верификация проектного поля».
Слайд 33Если не было показано что параметры, изученные при разработке проектного поля, масштабируются
Если не было показано что параметры, изученные при разработке проектного поля, масштабируются

В зависимости от изменчивости параметров и характеристик процесса и их перемещения по проектному полю (то есть колебаний в пределах оптимальных рабочих параметров (валидированных диапазонов) или в новой области проектного поля с появлением более высокого или неизвестного риска) план верификации может включать показатели качества (QA) и параметры процессов (PP’s), не включенные в систему рутинного контроля процесса (например, мониторинг или испытания тех QA и PP’s, которые, как ожидается, будут зависеть от масштаба производства и, если применимо, от оборудования). Нет необходимости верифицировать все области проектного поля или допустимые пределы проектного поля.
В принципе, должно быть верифицировано более одной области проектного поля, но поэтапный подход для корректировки утвержденного проектного поля в течение жизненного цикла продукта также является приемлемым.
Слайд 34Масштабирование
Во избежание повторения длительных и дорогостоящих испытаний необходимо должным образом организовать
Масштабирование
Во избежание повторения длительных и дорогостоящих испытаний необходимо должным образом организовать

Если размеры серий предлагаются в определенных диапазонах, следует привести обоснование того, что изменение размера серии не окажет отрицательного влияния на критические показатели качества готовой продукции. Предполагается, что эти параметры, изложенные в плане валидации процесса при изменении размера серии будут проверены повторно, если не предоставлены доказательства того, что процесс независим от масштаба, или если не используется непрерывная верификация процесса.
Слайд 35Пострегистрационный контроль изменений
Необходимо установить четкие процедуры для управления изменениями, предлагаемыми для
Пострегистрационный контроль изменений
Необходимо установить четкие процедуры для управления изменениями, предлагаемыми для

Подробнее информация об изменениях, требующих внесения в регистрационное досье, приведена в приложениях №№ 19 и 20 к правилам регистраци
Слайд 36Общая схема проведения валидации на действующем производстве
Общая схема проведения валидации на действующем производстве

Слайд 37Для планирования валидации используется документация
1. Проектная документация, разработанная в установленном порядке.
2.
Для планирования валидации используется документация
1. Проектная документация, разработанная в установленном порядке. 2.

Слайд 38Примерное содержание валидационного плана
(Рекомендуемое)
Валидационный план включает в себя следующие положения, информацию,
Примерное содержание валидационного плана
(Рекомендуемое)
Валидационный план включает в себя следующие положения, информацию,

Слайд 39Схема валидации процесса в регистрационном досье должна
содержать следующую информацию:
краткое описание процесса
Схема валидации процесса в регистрационном досье должна
содержать следующую информацию:
краткое описание процесса

спецификацию на готовую продукцию;
подробные сведения о аналитические методы (ссылка на соответствующую часть регистрационного досье) контроль, предлагается в процессе производства, и критерии приемлемости;
дополнительные испытания, которые должны быть проведены (с предлагаемыми критериями приемлемости и сведениями с валидацией аналитических методик, при необходимости);
план отбора проб: где, когда и как отбирать пробы;
подробные сведения о способах протоколирования и оценки результатов;
график проведения.
 Useless Inventions
Useless Inventions  Моделирование объектов и систем
Моделирование объектов и систем Личное благовестие
Личное благовестие Презентация на тему: Работа классного руководителя с родителями
Презентация на тему: Работа классного руководителя с родителями 2_5325994725348481395
2_5325994725348481395 Организация туриндустрии. Комплекс услуг предприятий питания и его роль в туризме
Организация туриндустрии. Комплекс услуг предприятий питания и его роль в туризме Организация внеурочной деятельности при реализации федерального государственного образовательного стандарта начального общего
Организация внеурочной деятельности при реализации федерального государственного образовательного стандарта начального общего Презентация на тему Формы взаимодействия педагогов с семьей ребенка дошкольного возраста с особыми образовательными потребностя
Презентация на тему Формы взаимодействия педагогов с семьей ребенка дошкольного возраста с особыми образовательными потребностя К вопросу о цикличности развития диатомовых водорослей Байкала
К вопросу о цикличности развития диатомовых водорослей Байкала О мерах, направленных на снижение темпов роста потребительских цен
О мерах, направленных на снижение темпов роста потребительских цен «Своя игра»
«Своя игра» ГУО Туринский учебно-педагогический комплекс детский сад – базовая школа
ГУО Туринский учебно-педагогический комплекс детский сад – базовая школа Презентация на тему Удельный период русской истории (6 класс)
Презентация на тему Удельный период русской истории (6 класс) Красная книга Курганской области
Красная книга Курганской области Презентация на тему have to - must
Презентация на тему have to - must Что такое ДМС страхование? Полис(пластиковый, эл. вариант, бумажный)
Что такое ДМС страхование? Полис(пластиковый, эл. вариант, бумажный) Производство бумаги
Производство бумаги СДД как инструмент хеджирования ценовых рисков в РСВ
СДД как инструмент хеджирования ценовых рисков в РСВ Конкурс курсовых проектов (КМИП)
Конкурс курсовых проектов (КМИП) Менеджмент. Организация, мотивации, контроль, понятие регулирования и его место в системе управления (Часть 3)
Менеджмент. Организация, мотивации, контроль, понятие регулирования и его место в системе управления (Часть 3) Лаборатория 812 – это содружество людей, абсолютно разных, но уже состоявшихся в своих профессиональных сферах. Художники, психолог
Лаборатория 812 – это содружество людей, абсолютно разных, но уже состоявшихся в своих профессиональных сферах. Художники, психолог Должность и прием персонала
Должность и прием персонала Возникновение головных уборов
Возникновение головных уборов Почва – важнейшая часть экосистемы 3 класс
Почва – важнейшая часть экосистемы 3 класс Свойства и функции белков
Свойства и функции белков  Самопрезентация учителя начальных классов
Самопрезентация учителя начальных классов Демонстрационный эксперимент по геометрической оптике
Демонстрационный эксперимент по геометрической оптике Презентация на тему Предложения с вводными конструкциями (8 класс)
Презентация на тему Предложения с вводными конструкциями (8 класс)