Содержание
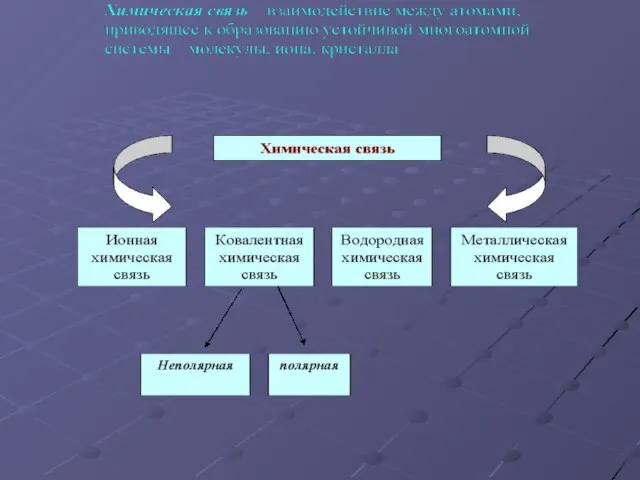
- 3. Ионная связь – это электростатическое притяжение между ионами; Возникает между атомами, имеющими большую разность электроотрицательности (более
- 4. Вещества с ионной связью при н.у. находятся в твердом агрегатном состоянии и образуют кристаллы с ионной
- 5. Ковалентная связь – это связь между атомами, возникающая за счет образования общих электронных пар. По обменному
- 6. Число общих электронных пар равно числу связей между двумя атомами, или кратности связи Простая (одинарная связь)
- 7. Параметры ковалентной связи: Длина связи – расстояние между центрами двух соседних атомов (зависит от радиуса атома
- 8. Вещества с ковалентной связью бывают при обычных условиях: газами жидкостями твердыми -- аморфные (расположение частиц в
- 9. При кристаллизации веществ с ковалентной связью образуется два типа кристаллических решеток: Атомная (в узлах находятся атомы,
- 10. Металлическая химическая связь осуществляется свободными электронами, общими для всего кристалла. Металлы образуют металлические кристаллические решетки, в
- 11. Водородная химическая связь – это электростатическое притяжение между положительно поляризованными атомами водорода одной молекулы и отрицательно
- 13. Скачать презентацию









 Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха
Предложение по перспективному развитию военного городка отдельного медико-санитарного батальона г. Балашиха Язык современной Интернет - субкультуры
Язык современной Интернет - субкультуры Отцовская доблесть. Семья Канчуриных
Отцовская доблесть. Семья Канчуриных Кто хочет стать миллионером (разовая игра 15 вопросов)
Кто хочет стать миллионером (разовая игра 15 вопросов) Публичный отчет МОУ СОШ №18 г. Пензы (декабрь 2009 г.)
Публичный отчет МОУ СОШ №18 г. Пензы (декабрь 2009 г.) Презентация на тему Декартовы координаты
Презентация на тему Декартовы координаты  Кулинарные традиции семьи
Кулинарные традиции семьи Аксонометрия. Прямоугольные и косоугольные аксонометрические проекции
Аксонометрия. Прямоугольные и косоугольные аксонометрические проекции Технические средства измерения массы груза
Технические средства измерения массы груза Мой любимый продукт
Мой любимый продукт Гамма-стерилизация
Гамма-стерилизация Химическое оружие. Виды
Химическое оружие. Виды ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ В ПОЛЬШЕ
ОРГАНИЗАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ В ПОЛЬШЕ Служба в органах уголовно-исполнительной системы как вид государственной службы
Служба в органах уголовно-исполнительной системы как вид государственной службы Путевая бюрократия или все о вагонной документации
Путевая бюрократия или все о вагонной документации Ecological problems
Ecological problems Продам 2 комнатную квартиру по приятной цене
Продам 2 комнатную квартиру по приятной цене Возрастная психология
Возрастная психология Правила vs Нормы
Правила vs Нормы Психолог-юзабилист О новой профессии в мире высоких технологий (для студентов-психологов)
Психолог-юзабилист О новой профессии в мире высоких технологий (для студентов-психологов) Управления рисками в банке
Управления рисками в банке Презентация на тему Мировые религии
Презентация на тему Мировые религии Ядерная сделка с Ираном
Ядерная сделка с Ираном Lean Startup «Бережливый стартап» Как делать игры, нужные людям
Lean Startup «Бережливый стартап» Как делать игры, нужные людям Презентация на тему Первые летательные аппараты
Презентация на тему Первые летательные аппараты Документирование среды программирования для операционной системы L4Ka(Documenting the programmer environment for L4ka)
Документирование среды программирования для операционной системы L4Ka(Documenting the programmer environment for L4ka) Правописание частицы НЕ с глаголами
Правописание частицы НЕ с глаголами Пьеса для театра А.Н.Островского "Снегурочка"
Пьеса для театра А.Н.Островского "Снегурочка"