Слайд 2Содержание
Актуальность
Цель работы
Объекты исследований
Результаты
Выводы

Слайд 3Актуальность
Растения являются уникальными источниками многих биологически активных соединений. Несмотря на успехи

в области применения синтетических лекарств, препараты природного происхождения приобретают все больший вес в практической медицине. Их несомненными преимуществами является широкий спектр биологической активности и экологическая безопасность изготовления, что особенно важно в наше время. Однако в связи с увеличивающимся дефицитом и стоимостью лекарственного растительного сырья, получаемого, как правило, из экзотических, редких и исчезающих видов диких и плантационных растений, на сегодняшний день не представляется возможным полностью обеспечить потребности фармакологической, косметической, а также пищевой промышленности в биологически активных соединениях растительного происхождения.
Поэтому в условиях, когда необходимо постоянно увеличивать долю лекарственных субстанций отечественного производства, представляется важным развивать технологии, создающие надежную сырьевую базу для выработки отечественных препаратов.
Слайд 4 В связи с этим большой практический интерес представляют приемы получения фитомассы,

основанные на культивировании в искусственных условиях на питательных средах растительных клеток. Обладая рядом преимуществ, этот метод составляет альтернативу природным источникам ценных соединений:
Это радикальное решение проблемы дефицита исходного сырья, возможность получения целевого продукта в течение всего года, полная независимость от климата, погоды, почвенных условий, вредителей, а также значительная экономия площадей, занимаемых культивируемыми растениями.
Использование вместо интактных растений их клеточных культур значительно расширяет возможности управления процессом биосинтеза целевых продуктов.
В результате оптимизации и стандартизации условий культивирования, содержание ценных метаболитов в растительных клетках in vitro и их качественный состав могут превышать таковые в интактных растениях.
Слайд 5Цель работы
Исследование характера влияния иммобилизации и физических условий культивирования (температуры, света,

слабого электрического тока) на прирост биомассы и содержание гидроксикоричных кислот в клеточных культурах эхинацеи пурпурной
Слайд 6Объекты исследований
каллусная и суспензионная культуры эхинацеи пурпурной

Слайд 7Результаты
Рис. 1. Кривые роста каллусной (А) и суспензионной культуры (Б) эхинацеи
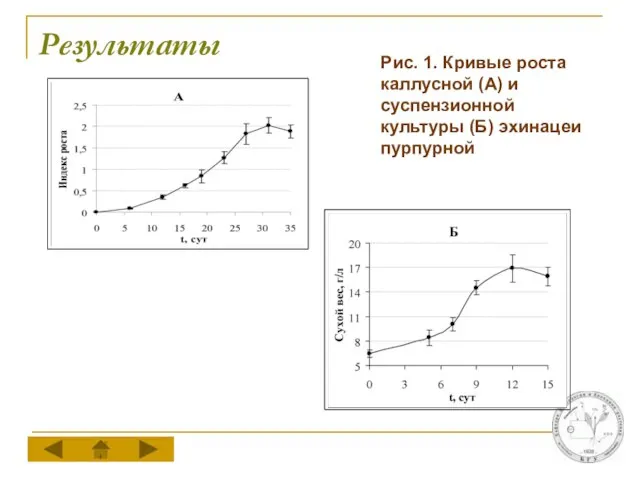
пурпурной
Слайд 8 Рис. 2. Динамика изменения сухого веса (А) свободных и иммобилизованных клеток
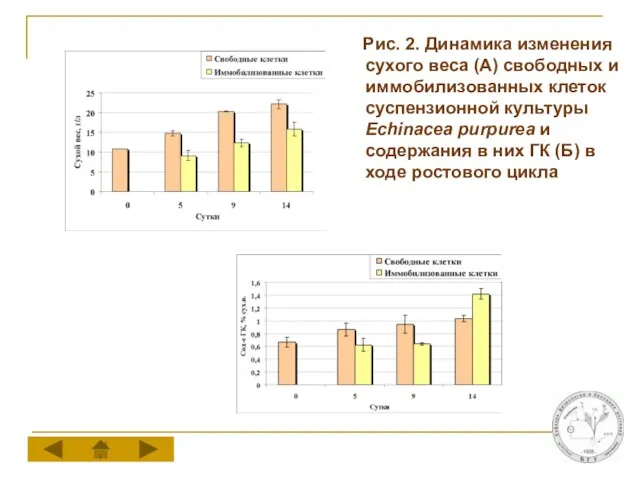
суспензионной культуры Echinacea purpurea и содержания в них ГК (Б) в ходе ростового цикла
Слайд 9Рис. 3. Влияние иммобилизации на суммарное содержание ГК (%) в клетках Echinacea
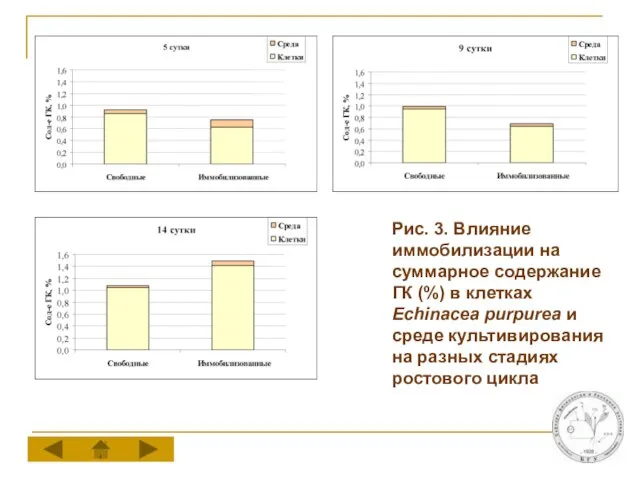
purpurea и среде культивирования на разных стадиях ростового цикла
Слайд 10Рис. 4. Динамика прироста биомассы каллусов Echinacea purpurea, культивируемых при разных температурах
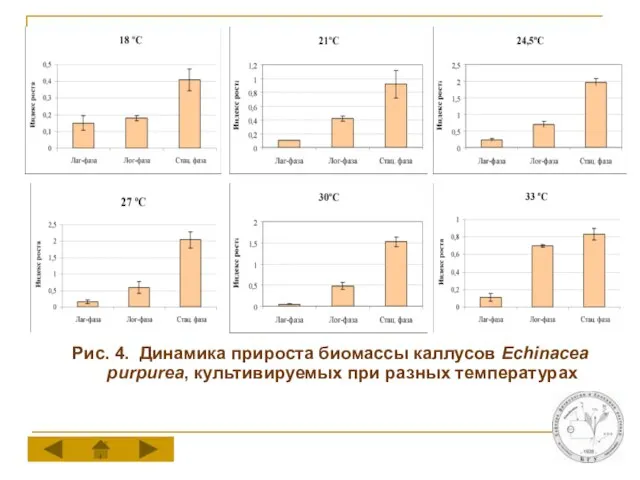
Слайд 11 Рис. 5. Влияние температуры на показатели прироста биомассы каллусов Echinacea purpurea
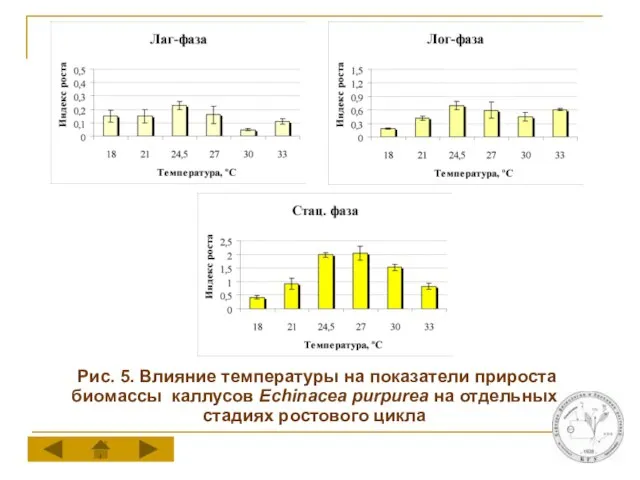
на отдельных стадиях ростового цикла
Слайд 12
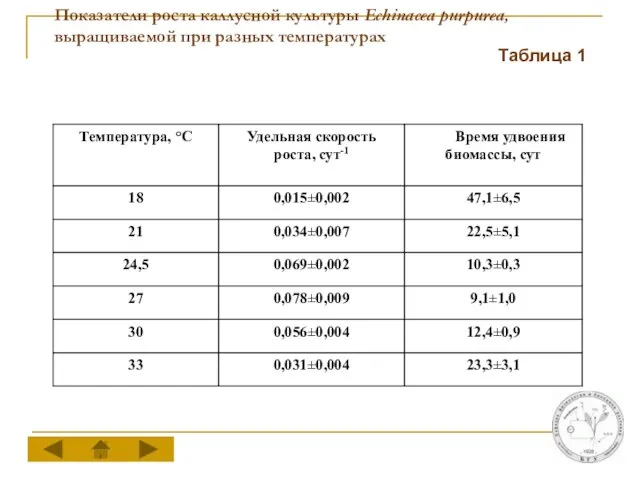
Показатели роста каллусной культуры Echinacea purpurea, выращиваемой при разных температурах
Таблица 1
Слайд 13 Рис. 6. Динамика изменения содержания ГК в каллусах Echinacea purpurea, культивируемых
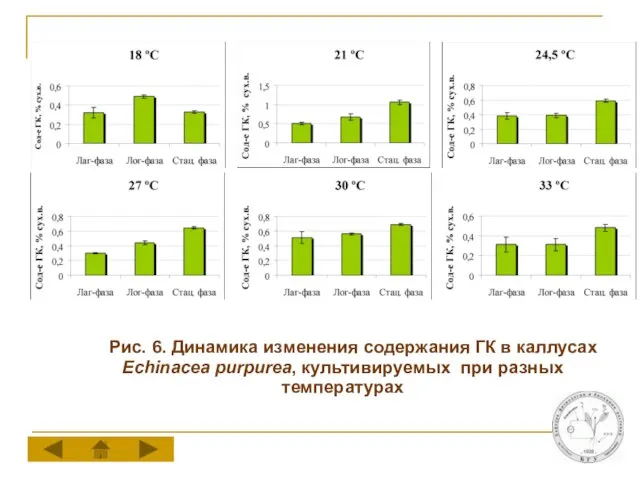
при разных температурах
Слайд 14 Рис. 7. Содержание ГК в каллусах Echinacea purpurea на отдельных стадиях
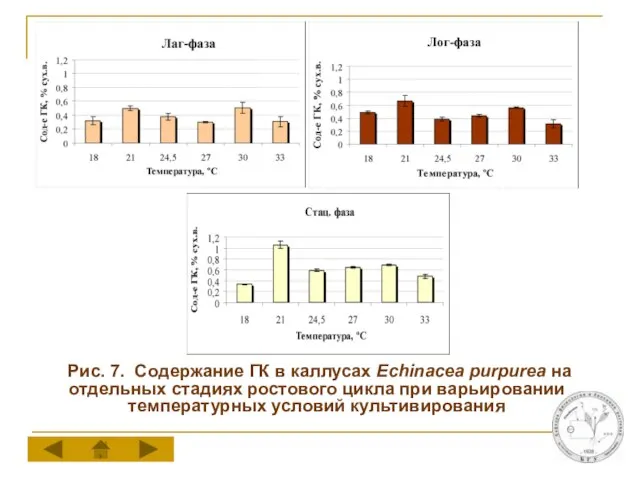
ростового цикла при варьировании температурных условий культивирования
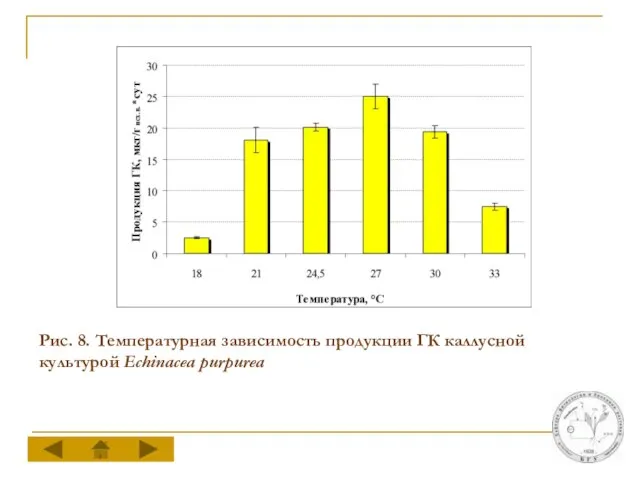
Слайд 15Рис. 8. Температурная зависимость продукции ГК каллусной культурой Echinacea purpurea
Слайд 16Рис. 9. Влияние условий освещения на индекс роста каллусов Echinacea purpurea (А)
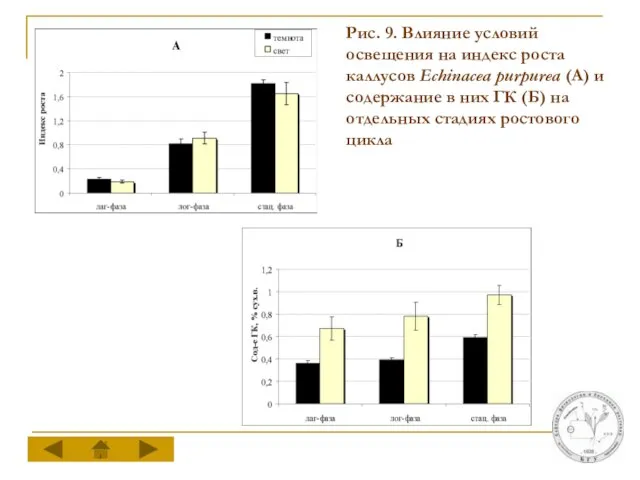
и содержание в них ГК (Б) на отдельных стадиях ростового цикла
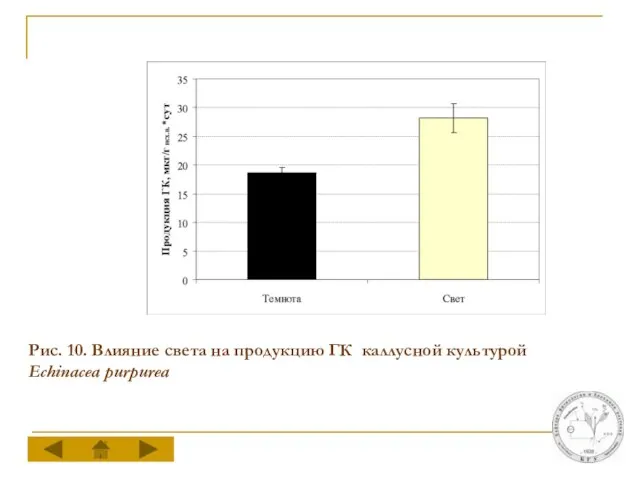
Слайд 17Рис. 10. Влияние света на продукцию ГК каллусной культурой Echinacea purpurea
Слайд 18Рис. 11. Динамика изменения содержания фотосинтетических пигментов в каллусной культуре Echinacea purpurea
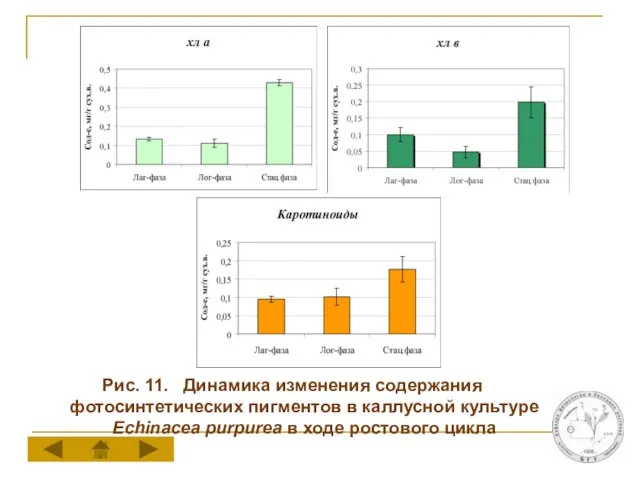
в ходе ростового цикла
Слайд 19Рис. 12. Влияние слабого электрического тока (1,5 мкА) на содержание ГК в
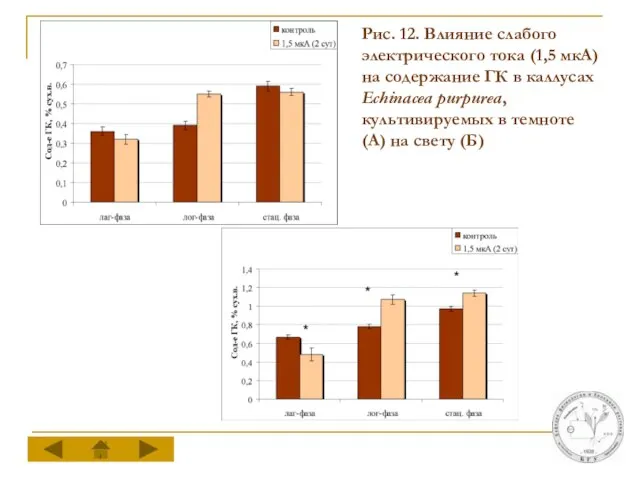
каллусах Echinacea purpurea, культивируемых в темноте (А) на свету (Б)
Слайд 20Выводы
Включение клеток суспензионной культуры эхинацеи пурпурной в полисахаридный носитель (Са-альгинатый гель) вызывает

стимуляцию накопления ГК только при переходе к стационарной фазе ростового цикла. Количество экскретируемых ГК на всех стадиях ростового цикла выше у иммобилизованных в Са-альгинатном геле клеток суспензионной культуры Echinacea purpurea по сравнению со свободными клетками.
Температуры оптимальные для роста и накопления ГК в каллусной культуре эхинацеи различаются между собой. Максимальный прирост биомассы каллусов отмечается при 24,5-27°С, тогда как для накопления ГК в стационарную фазу ростового цикла оптимальной является температура 21°С.
Слайд 21Высокая скорость прироста биомассы клеток при температуре 27°С компенсирует более низкие уровни

накопления ГК, и максимальная продукция анализируемых вторичных метаболитов каллусной культурой эхинацеи достигается при 27°С, т.е. при температуре, оптимальной для ростовых процессов. Использование пониженной температуры (21°С) для стимуляции накопления ГК культурой клеток эхинацеи пурпурной может быть оправданным только при двустадийном культивировании.
Культивирование каллусов эхинацеи на свету не оказывает достоверного влияния на величины прироста их биомассы на всех стадиях ростового цикла. Свет стимулирует образование ГК в каллусах эхинацеи, в результате чего общая продукция ГК каллусной культурой возрастает в 1,6 раза по сравнению с каллусами, инкубируемыми в темноте.
Действие слабого электрического тока (1,5 мкА) на каллусы эхинацеи, культивируемые в темноте, приводит к достоверному увеличению содержания ГК только в холе лог-фазы цикла выращивания. Для каллусов, культивируемых на свету, стимулирующий эффект наблюдается в ходе лог-фазы и стационарной фазы ростового цикла.




















 Госзакупки. С чего начать
Госзакупки. С чего начать Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов.
Социальные деньги и платежи в социальных сетях.Способы монетизации игрового трафика и премиум сервисов. Всього одна чарка
Всього одна чарка ИЗУЧАЕМ EXCEL
ИЗУЧАЕМ EXCEL Институт кураторов — копия
Институт кураторов — копия Богатыри - герои былин
Богатыри - герои былин Острые респираторные заболевания и их профилактика
Острые респираторные заболевания и их профилактика Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га
Работа Эйвазова Фарида Школа-лицей 264,8d. Любое вещество может находиться в трёх агрегатных состояниях, таких как: Жидкое Твёрдое Га Геометрия в моде
Геометрия в моде Презентация на тему Аллея героев Первой мировой войны
Презентация на тему Аллея героев Первой мировой войны Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз
Публичный отчёт по основным направлениям развития 17.02.2011 Муниципальное автономное образовательное учреждение средняя общеобраз CHOOSING A PROFESSION
CHOOSING A PROFESSION внутреннее строение насекомых
внутреннее строение насекомых 984967 (3)
984967 (3) Условие не превышения границы области допустимых состояний конструкции
Условие не превышения границы области допустимых состояний конструкции Положение об общественном совете муниципального образования
Положение об общественном совете муниципального образования Традиции модернизма в искусстве 2-й пол. ХХ века
Традиции модернизма в искусстве 2-й пол. ХХ века Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус
Лакомства для домашних питомцев из рога и субпродуктов ТМ Живкус Полные квадратные уравнения
Полные квадратные уравнения Сегментация изображений
Сегментация изображений Конституция Республики Молдова
Конституция Республики Молдова Методическая работа школы
Методическая работа школы Набор в секции. Отделение сложно-координационных видов
Набор в секции. Отделение сложно-координационных видов Виктор Федорович Боков
Виктор Федорович Боков Chapter-8. Learning goals
Chapter-8. Learning goals Методи цитологічних досліджень
Методи цитологічних досліджень Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра
Реальная государственная поддержка сельского хозяйства! Миссия Корпорации – участие в реализации государственной политики агра Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force
Использование XSLT для разработки сайтов (на ASP.NET) Андрей Майоров, BYTE-force