Содержание
- 2. Организационные вопросы
- 3. Назначение курса Курс «Методы моделирования пространственной структуры протеинов» посвящен двум основным задачам, имеющим важнейшее значение для
- 4. Содержание курса Базовые понятия о химических связях, функция и синтезе белков. Понятие аминокислоты, образование пептидной связи.
- 5. Содержание курса Современные инструменты для предсказания третичной структуры белка. AlphaFold. Боковые цепочки (радикалы) белка, их влияние
- 6. Содержание курса Оценка предсказания белковой геометрии. Белковые потенциалы. Плюсы и минусы, структура. Статистический потенциал. Крупноблочные модели
- 7. Формула оценки
- 8. Введение и основные понятия
- 9. Проблема фолдинга Белок задается последовательностью входящих в него аминокислот. Функция белка определяется не только химическим составом,
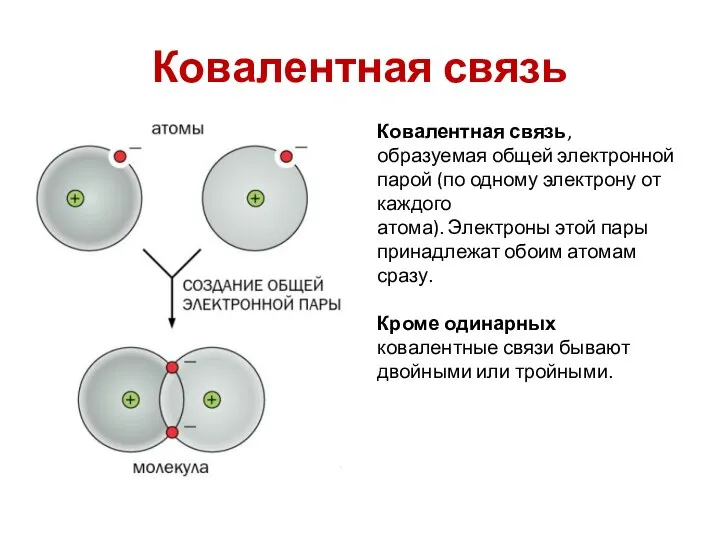
- 10. Ковалентная связь Ковалентная связь, образуемая общей электронной парой (по одному электрону от каждого атома). Электроны этой
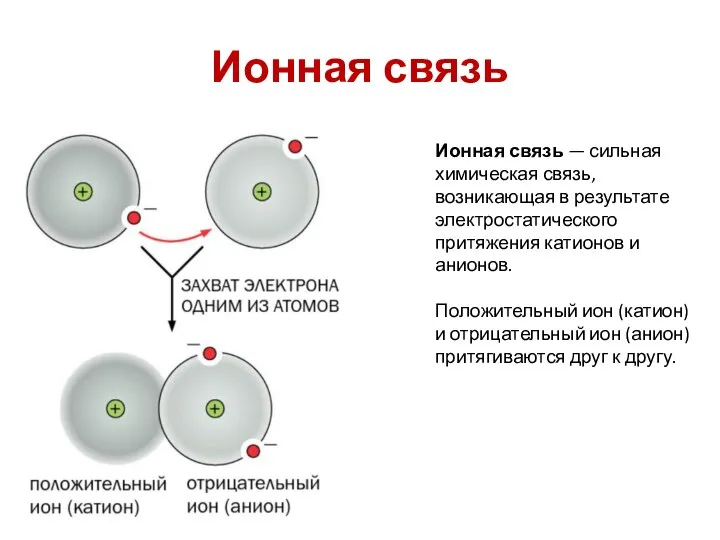
- 11. Ионная связь Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов.
- 12. Полярные и неполярные ковалентные связи Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях
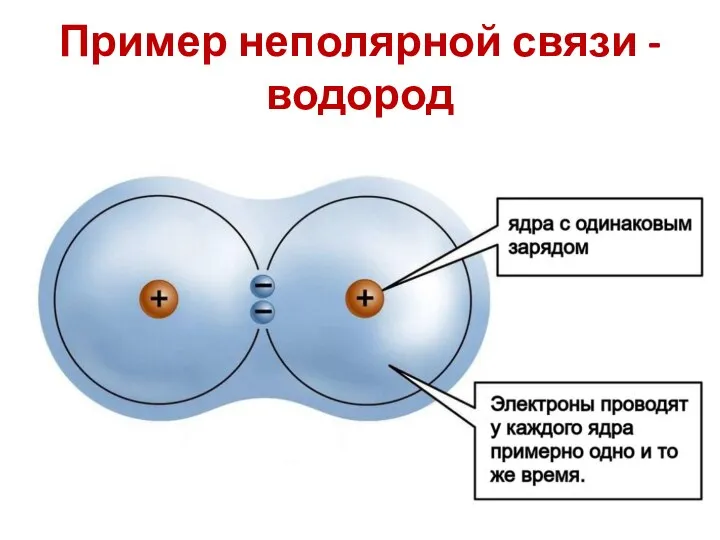
- 13. Пример неполярной связи - водород
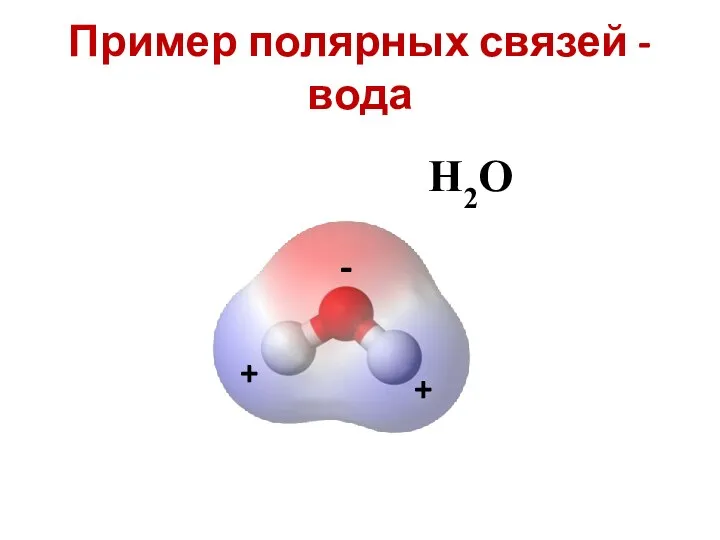
- 14. Пример полярных связей - вода H2O + + -
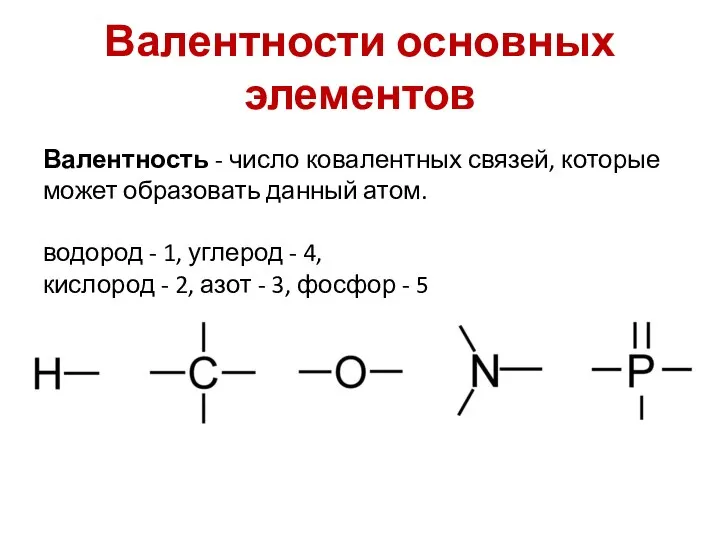
- 15. Валентности основных элементов Валентность - число ковалентных связей, которые может образовать данный атом. водород - 1,
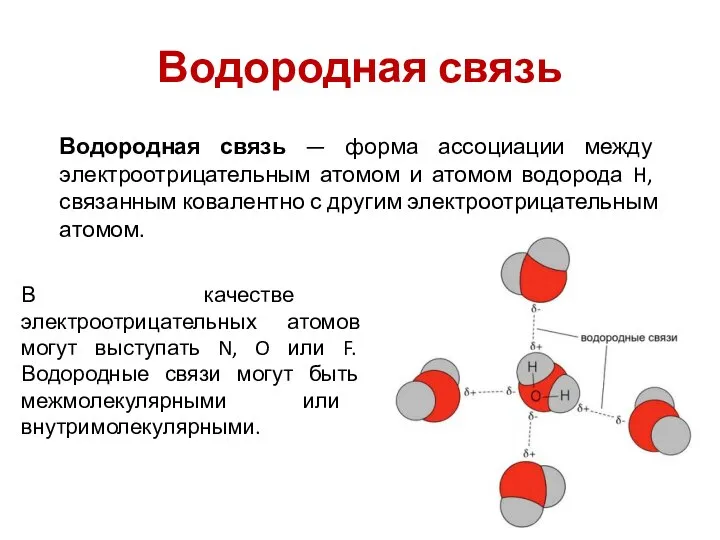
- 16. Водородная связь Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно
- 17. Растворение в воде В природе белки существуют в растворе (приближенно можно считать водным раствором). Любые заряженные
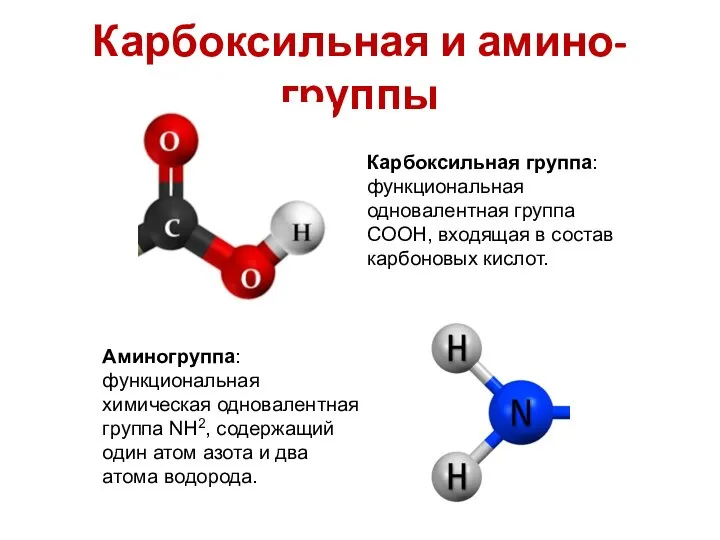
- 18. Карбоксильная и амино- группы Карбоксильная группа: функциональная одновалентная группа COOH, входящая в состав карбоновых кислот. Аминогруппа:
- 19. Белок Белок представляет собой последовательность аминокислот, соединенных пептидными связями. В белки входят 20 основных аминокислот. Функции
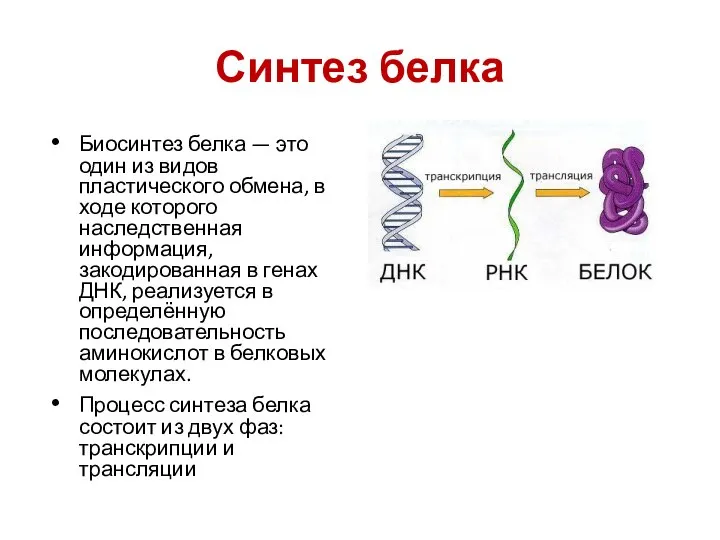
- 20. Синтез белка Биосинтез белка — это один из видов пластического обмена, в ходе которого наследственная информация,
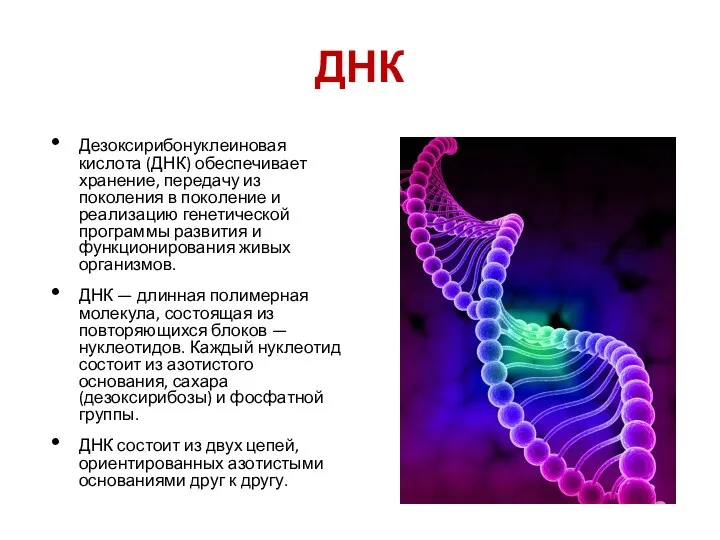
- 21. ДНК Дезоксирибонуклеиновая кислота (ДНК) обеспечивает хранение, передачу из поколения в поколение и реализацию генетической программы развития
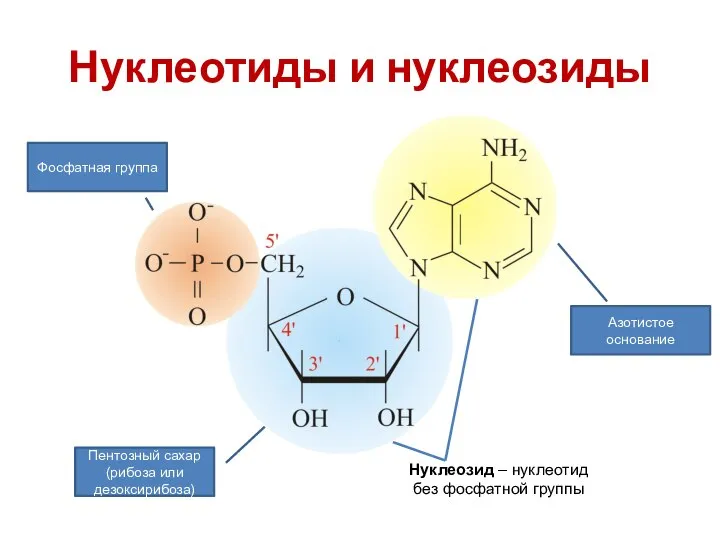
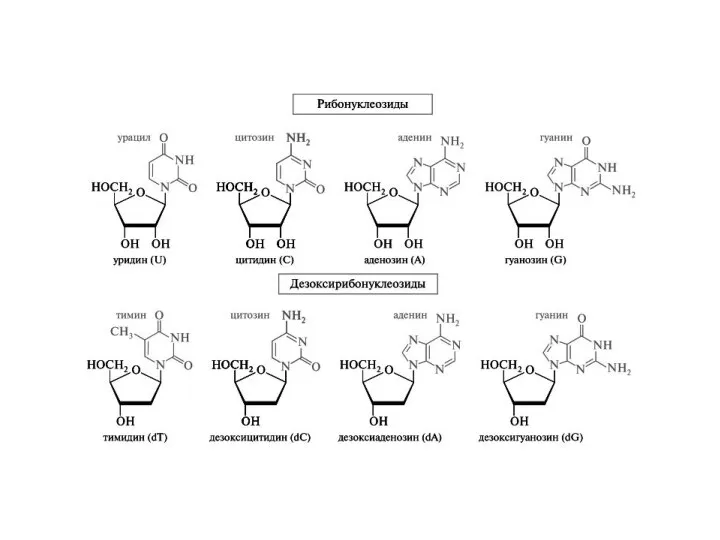
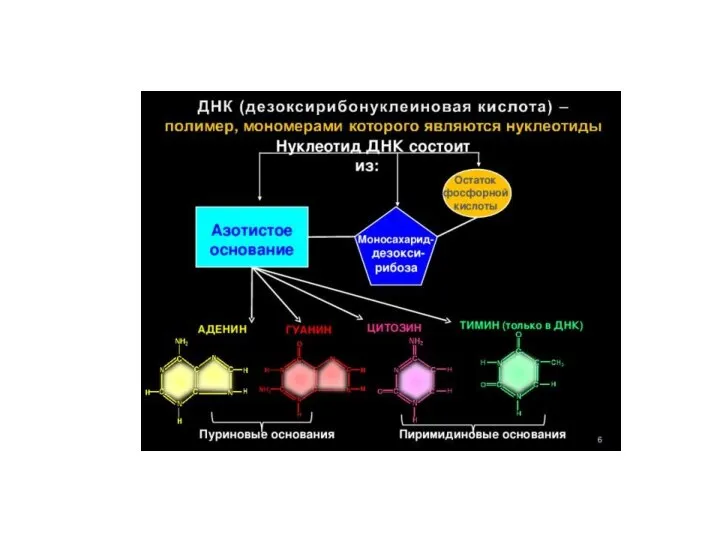
- 22. Нуклеотиды и нуклеозиды Азотистое основание Пентозный сахар (рибоза или дезоксирибоза) Фосфатная группа Нуклеозид – нуклеотид без
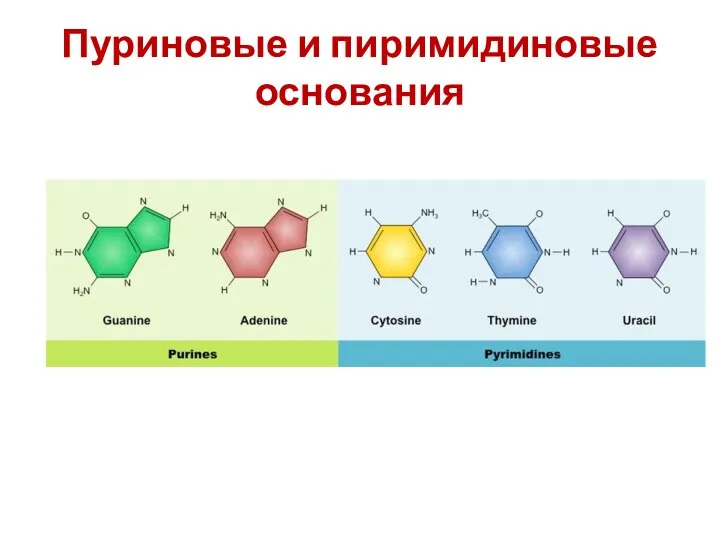
- 24. Пуриновые и пиримидиновые основания
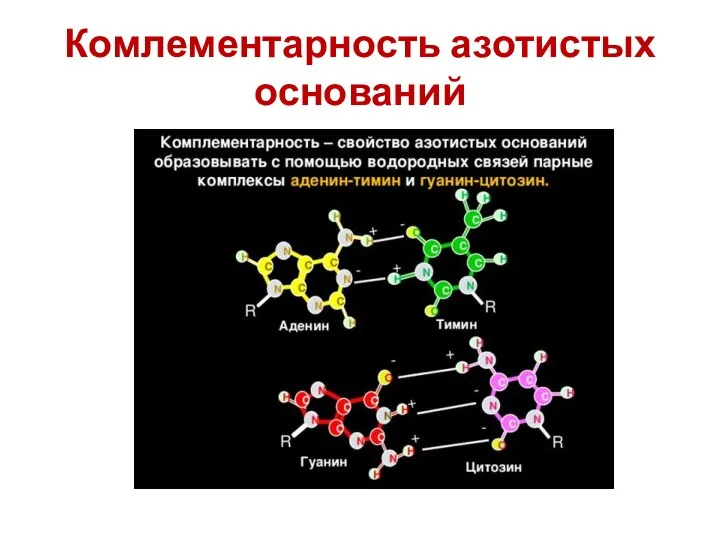
- 26. Комлементарность азотистых оснований
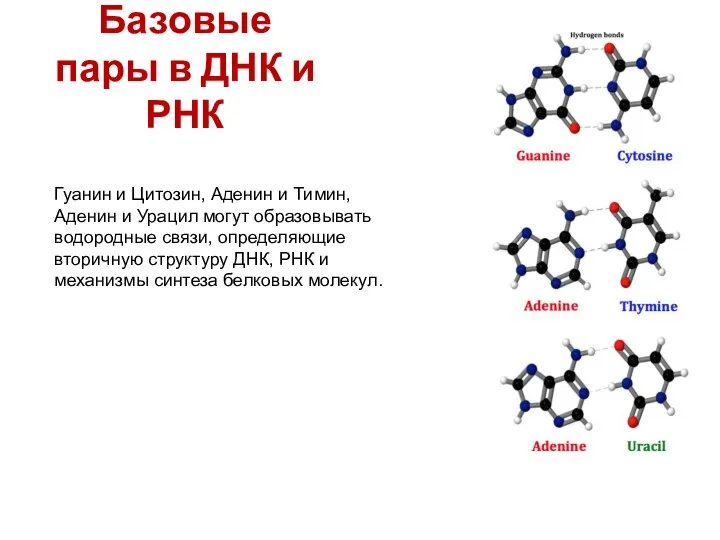
- 27. Базовые пары в ДНК и РНК Гуанин и Цитозин, Аденин и Тимин, Аденин и Урацил могут
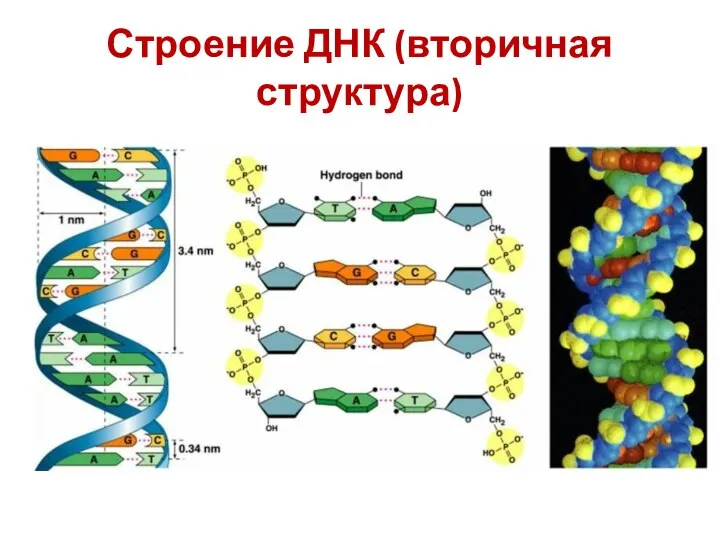
- 28. Строение ДНК (вторичная структура)
- 29. РНК - биополимер, мономером которого является нуклеотид. Состоит РНК из одной цепочки (в отличие от ДНК,
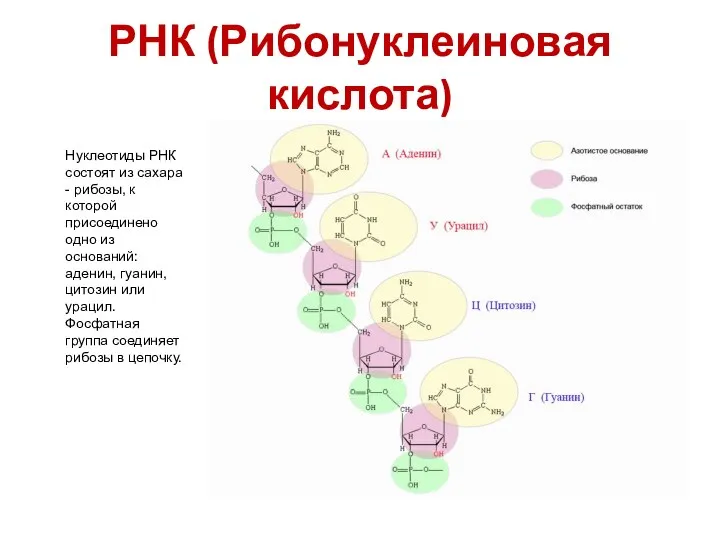
- 30. РНК (Рибонуклеиновая кислота) Нуклеотиды РНК состоят из сахара - рибозы, к которой присоединено одно из оснований:
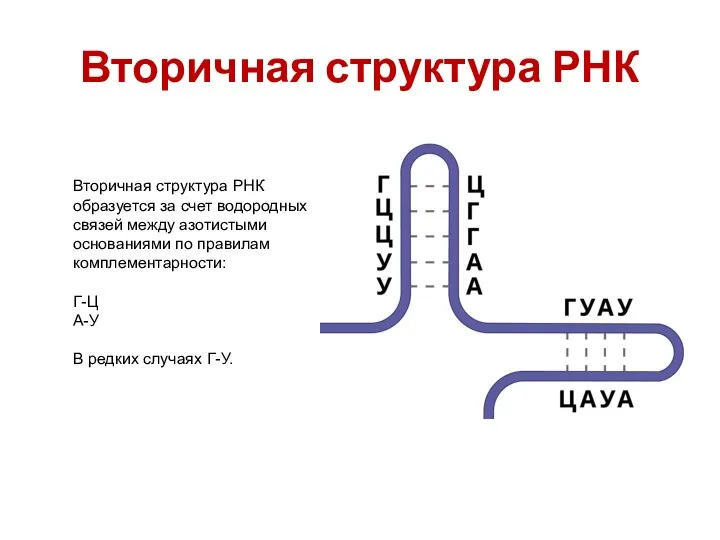
- 31. Вторичная структура РНК Вторичная структура РНК образуется за счет водородных связей между азотистыми основаниями по правилам
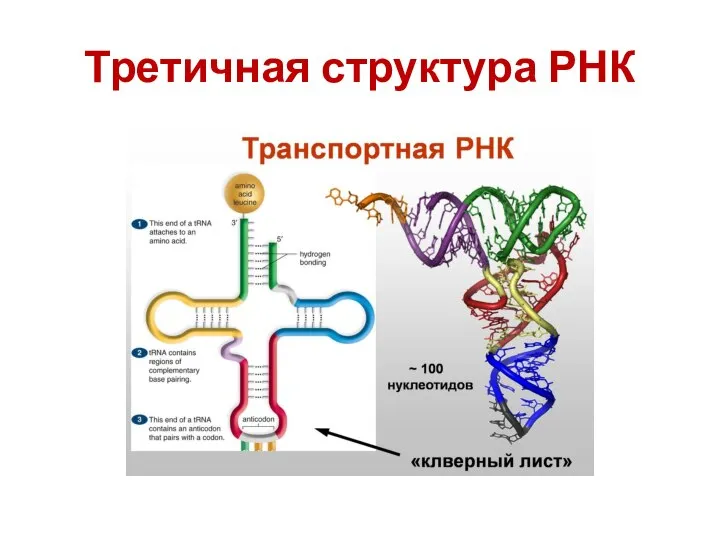
- 32. Третичная структура РНК
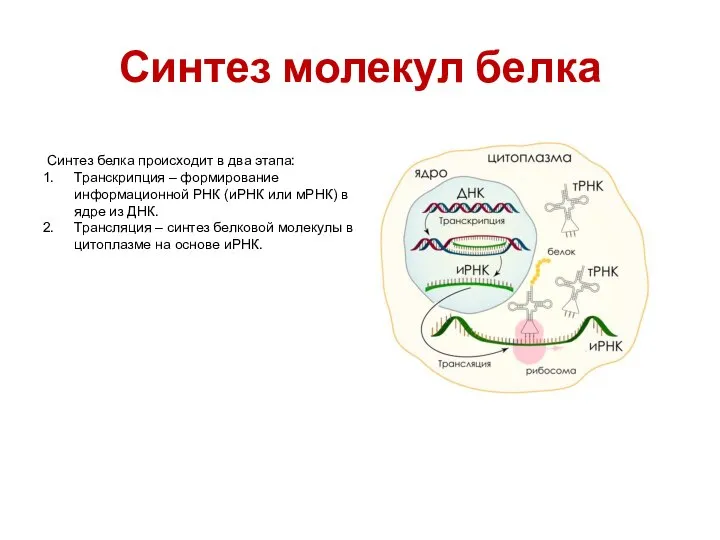
- 33. Синтез молекул белка Синтез белка происходит в два этапа: Транскрипция – формирование информационной РНК (иРНК или
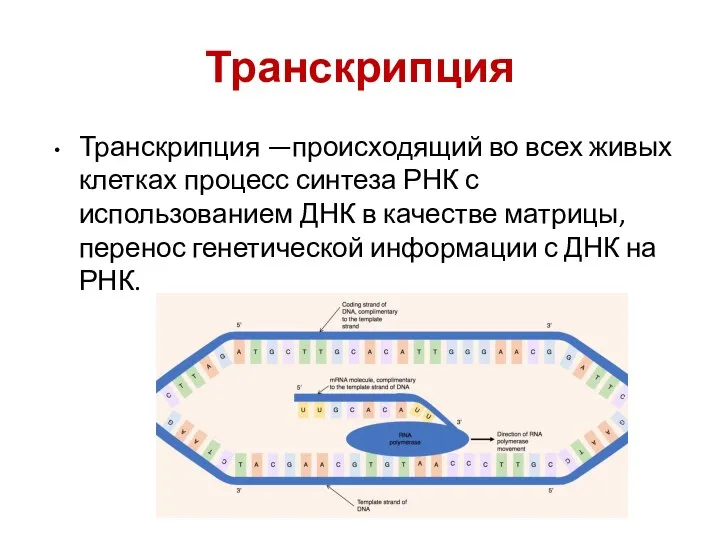
- 34. Транскрипция Транскрипция —происходящий во всех живых клетках процесс синтеза РНК с использованием ДНК в качестве матрицы,
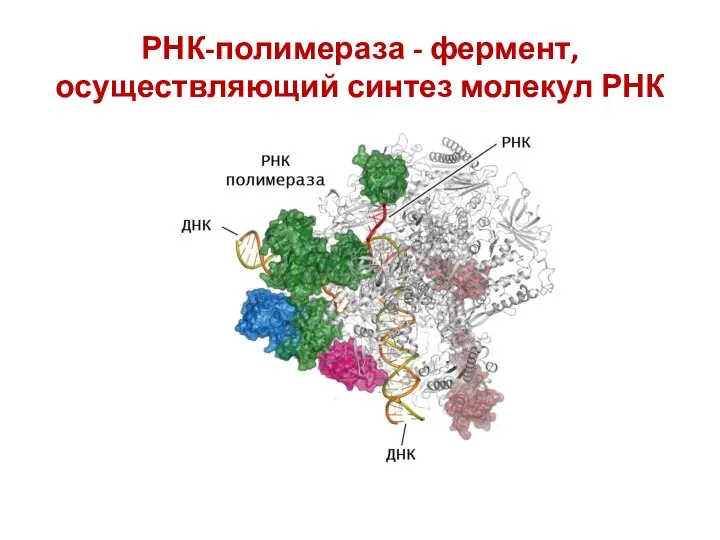
- 35. РНК-полимераза - фермент, осуществляющий синтез молекул РНК
- 36. Правила комплементарности В ДНК встречается четыре вида азотистых оснований (аденин (A), гуанин (G), тимин (T) и
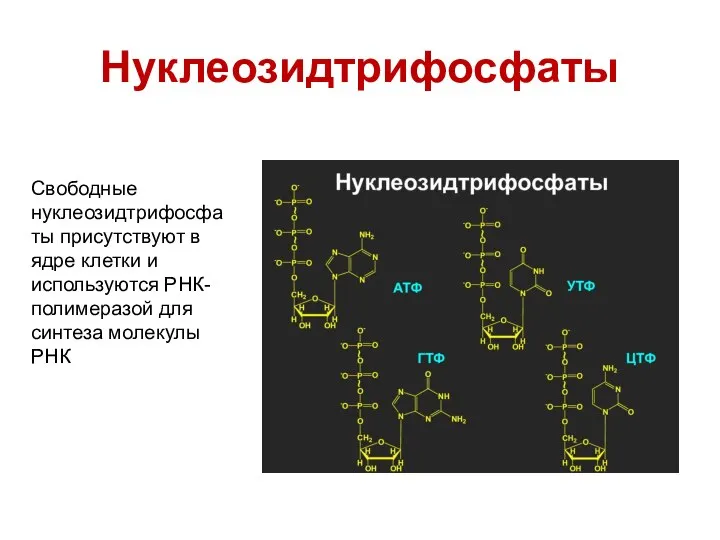
- 37. Нуклеозидтрифосфаты Свободные нуклеозидтрифосфаты присутствуют в ядре клетки и используются РНК-полимеразой для синтеза молекулы РНК
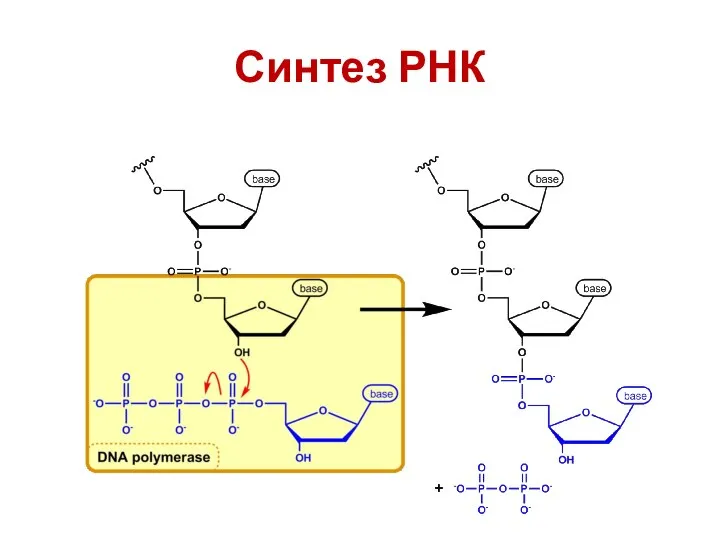
- 38. Синтез РНК
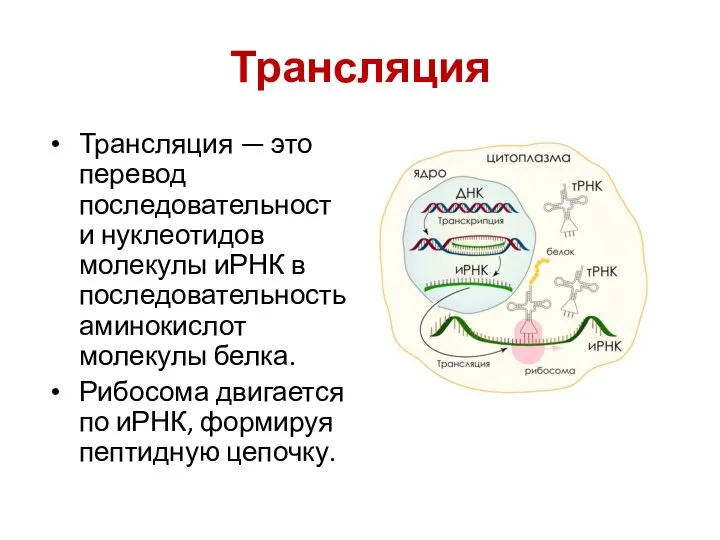
- 39. Трансляция Трансляция — это перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка. Рибосома двигается
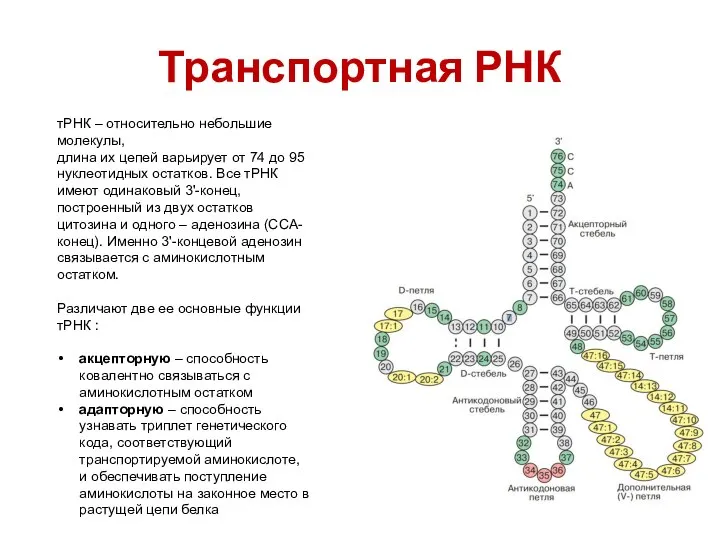
- 40. Транспортная РНК тРНК – относительно небольшие молекулы, длина их цепей варьирует от 74 до 95 нуклеотидных
- 41. Трансляция Рибосома движется вдоль иРНК, задерживаясь на каждом триплете приблизительно 0,2 секунды. Молекула тРНК, антикодон которой
- 42. Кодоны Три подряд идущих азотистых основания составляют кодон Кодонов всего 64, три из которых – т.н.
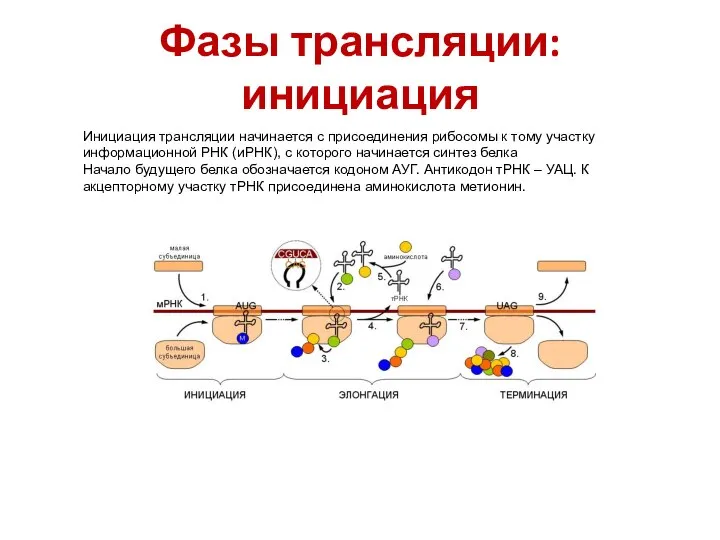
- 43. Фазы трансляции: инициация Инициация трансляции начинается с присоединения рибосомы к тому участку информационной РНК (иРНК), с
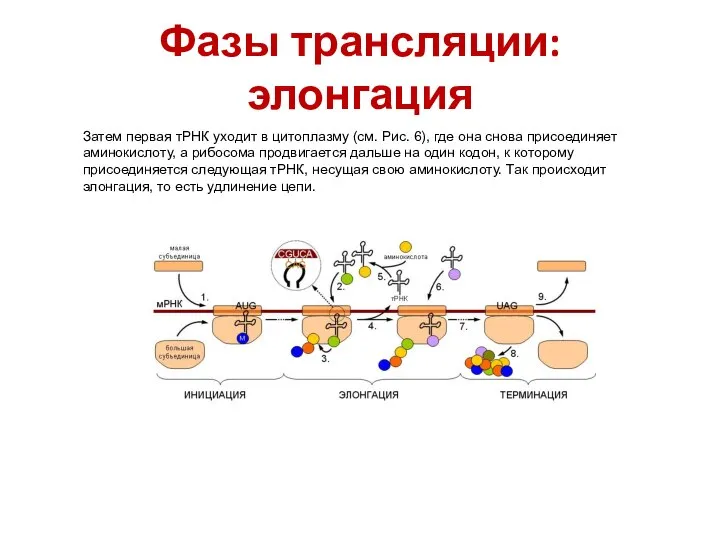
- 44. Фазы трансляции: элонгация Затем первая тРНК уходит в цитоплазму (см. Рис. 6), где она снова присоединяет
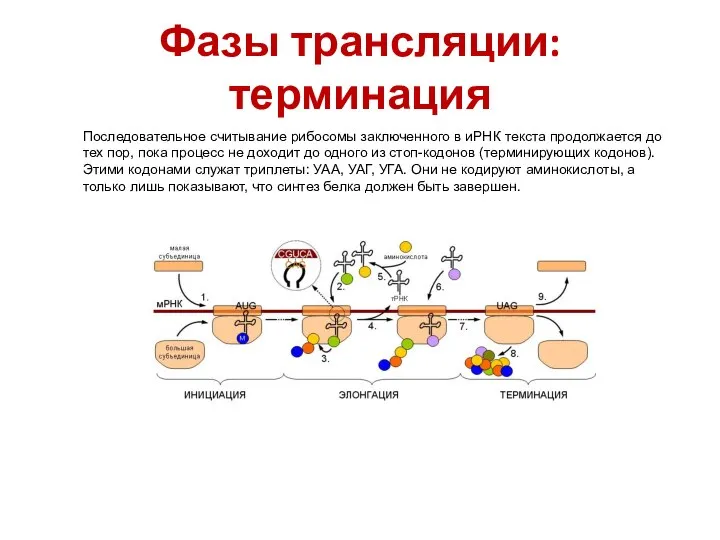
- 45. Фазы трансляции: терминация Последовательное считывание рибосомы заключенного в иРНК текста продолжается до тех пор, пока процесс
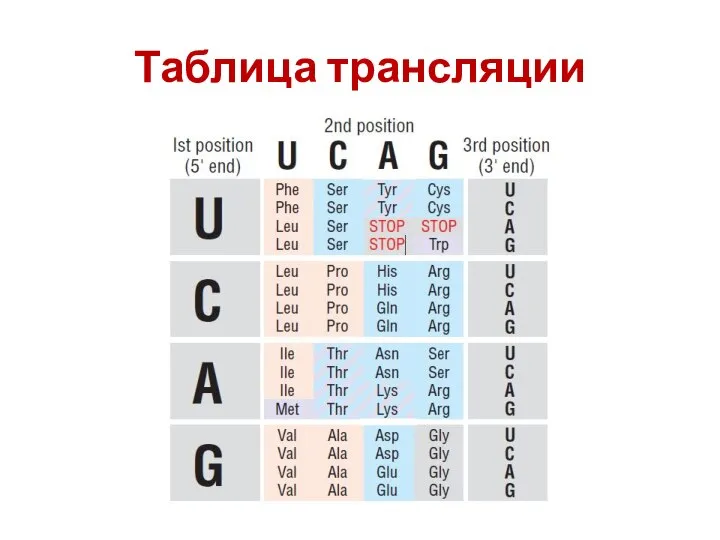
- 46. Таблица трансляции
- 47. Таблица трансляции
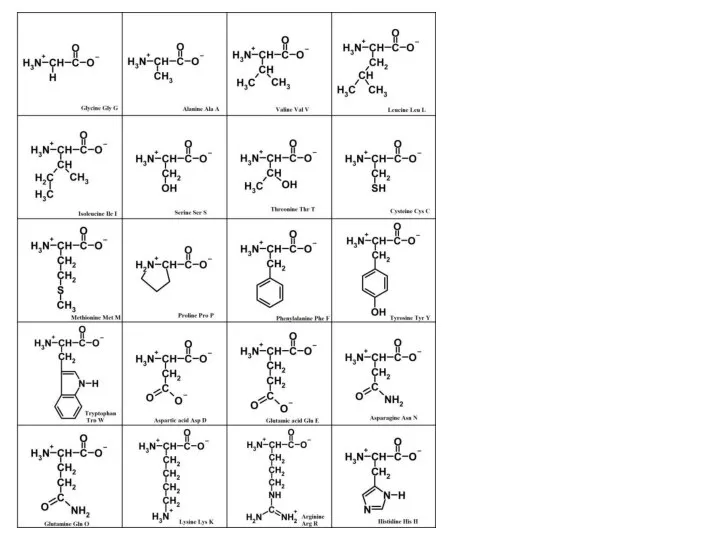
- 48. Аминокислота Аминогруппа Карбоксильная группа Радикал Соединение, в котором одновременно есть карбоксильная группа и аминогруппа, называется аминокислотой.
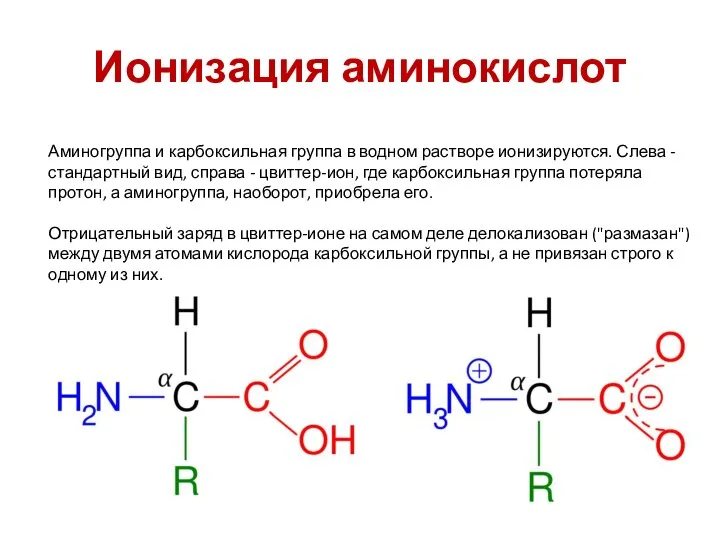
- 49. Ионизация аминокислот Аминогруппа и карбоксильная группа в водном растворе ионизируются. Слева - стандартный вид, справа -
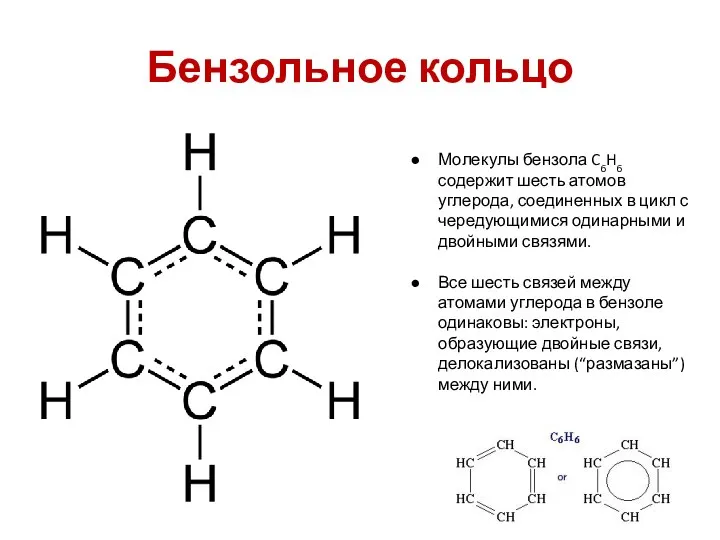
- 51. Бензольное кольцо Молекулы бензола C6H6 содержит шесть атомов углерода, соединенных в цикл с чередующимися одинарными и
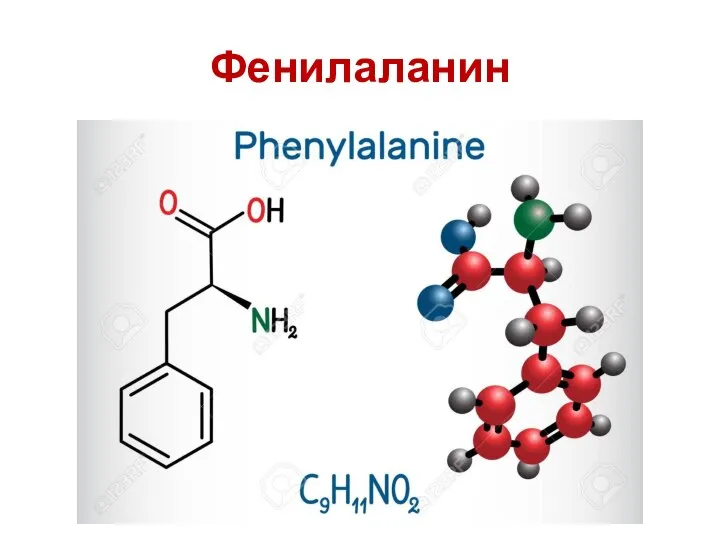
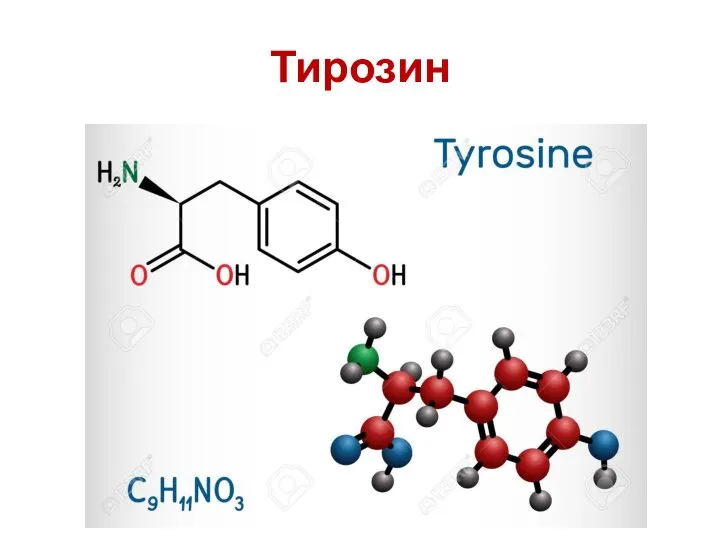
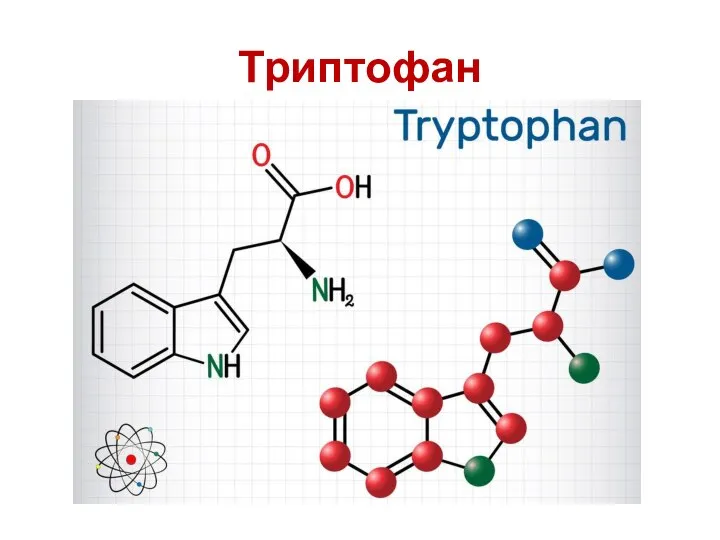
- 52. Ароматические аминокислоты Ароматическая аминокислота ( ААА ) представляет собой аминокислоту , которая включает в себя ароматическое
- 53. Фенилаланин
- 54. Тирозин
- 55. Триптофан
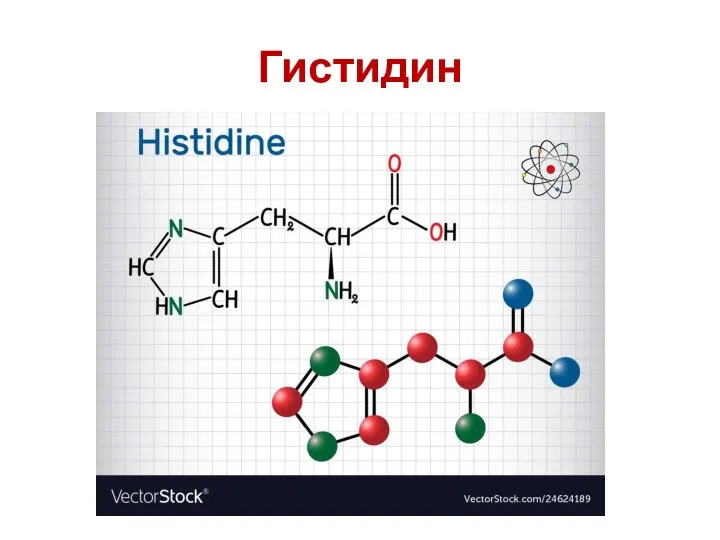
- 56. Гистидин
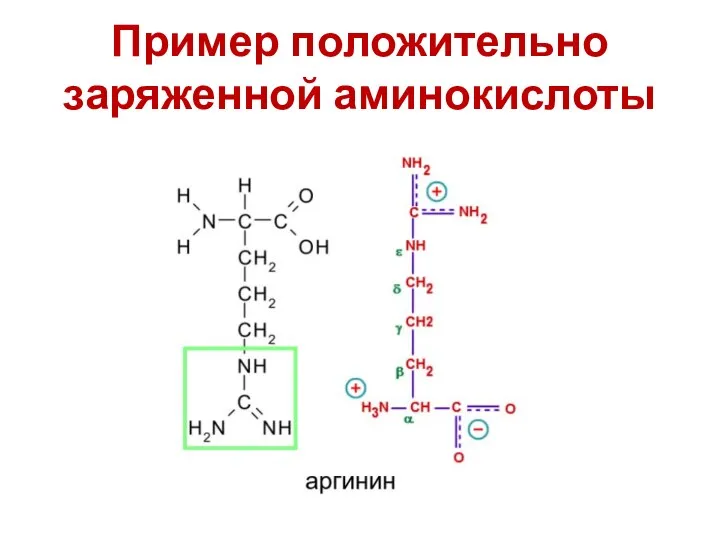
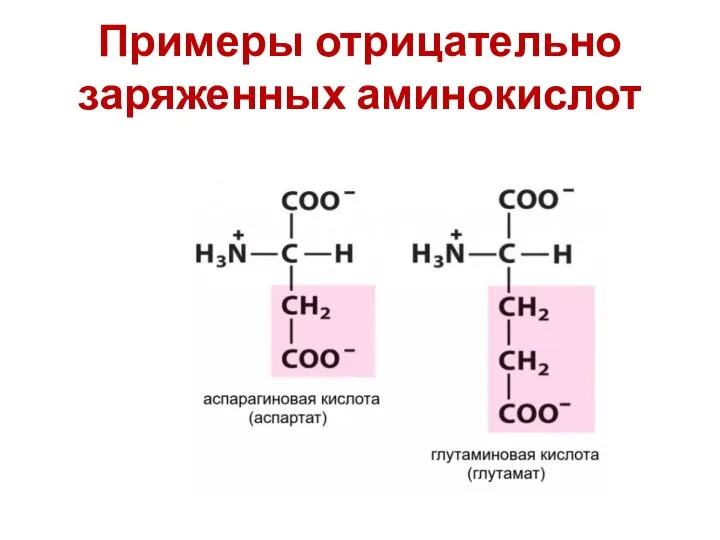
- 57. Заряд аминокислоты Можно разделить известные нам аминокислоты на четыре группы по типам радикалов: Нейтральные гидрофобные (аланин,
- 58. Пример положительно заряженной аминокислоты
- 59. Примеры отрицательно заряженных аминокислот
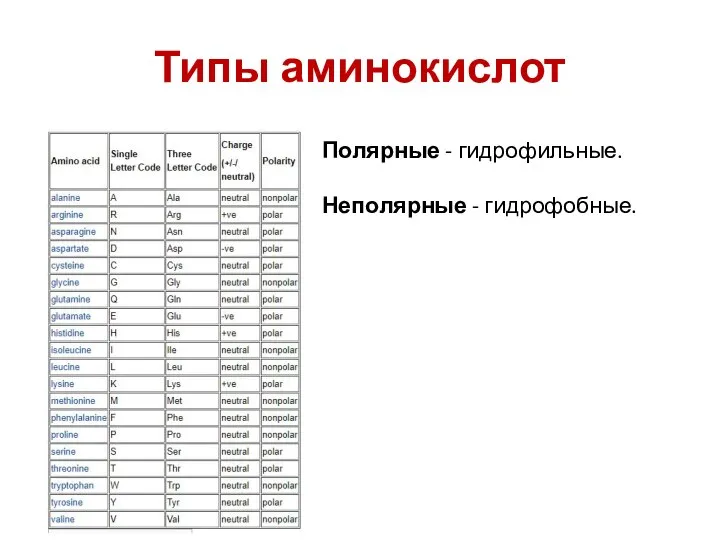
- 60. Типы аминокислот Полярные - гидрофильные. Неполярные - гидрофобные.
- 62. Скачать презентацию



















 Технология приготовления Таджикской Чакка
Технология приготовления Таджикской Чакка Центробежные насосы, современные конструкции центробежных насосов
Центробежные насосы, современные конструкции центробежных насосов Логистика распределения и сбыта
Логистика распределения и сбыта Экономика спрос предложение и равновесная цена
Экономика спрос предложение и равновесная цена Презентация на тему Класс Паукообразные
Презентация на тему Класс Паукообразные  Регистрация на портале Gosuslugi.ru
Регистрация на портале Gosuslugi.ru «Донорство в Озинском районе»
«Донорство в Озинском районе» Автоматизация общего анализа кровиГематологические анализаторы Diatron (Австрия)
Автоматизация общего анализа кровиГематологические анализаторы Diatron (Австрия) УЛЬТРАЗВУКОВАЯ ИДЕНТИФИКАЦИЯ
УЛЬТРАЗВУКОВАЯ ИДЕНТИФИКАЦИЯ Концепция институционализма
Концепция институционализма КУЛЬТУРА РОССИИ В XVI в Выполнила Тарасова Е.В.
КУЛЬТУРА РОССИИ В XVI в Выполнила Тарасова Е.В. Старинные меры длины и веса
Старинные меры длины и веса Khimicheskoe_oruzhie_xA_Vidy_posledstvia_deystvie_na_cheloveka
Khimicheskoe_oruzhie_xA_Vidy_posledstvia_deystvie_na_cheloveka Оформление и защита проекта
Оформление и защита проекта Чистоговорки на уроках литературного чтения
Чистоговорки на уроках литературного чтения Схемы
Схемы Тема урока
Тема урока Суицид. О мерах профилактики среди детей и подростков
Суицид. О мерах профилактики среди детей и подростков Презентация "Орфей и Эвридика" - скачать презентации по МХК
Презентация "Орфей и Эвридика" - скачать презентации по МХК Девиантное поведение школьников как фактор социальной опасности и его профилактика
Девиантное поведение школьников как фактор социальной опасности и его профилактика Композиционное, стилевое и цветовое единство в изделиях народных промыслов. Искусство Гжели
Композиционное, стилевое и цветовое единство в изделиях народных промыслов. Искусство Гжели Безопасностьобразовательного учреждения
Безопасностьобразовательного учреждения Вопросы взаимодействия учреждений здравоохранения и Регионального отделения Фонда социального страхования Российской Федерац
Вопросы взаимодействия учреждений здравоохранения и Регионального отделения Фонда социального страхования Российской Федерац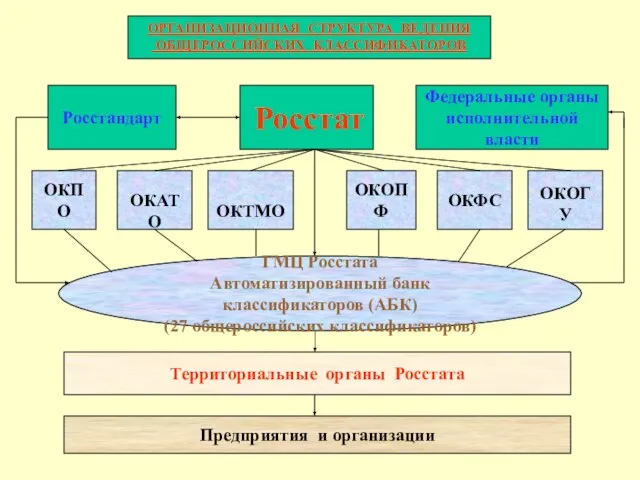 Росстат
Росстат Преемственность в подходах к реализации основных образовательных программ ДОУ и НОО. Требования к результатам освоения ООП НОО в
Преемственность в подходах к реализации основных образовательных программ ДОУ и НОО. Требования к результатам освоения ООП НОО в 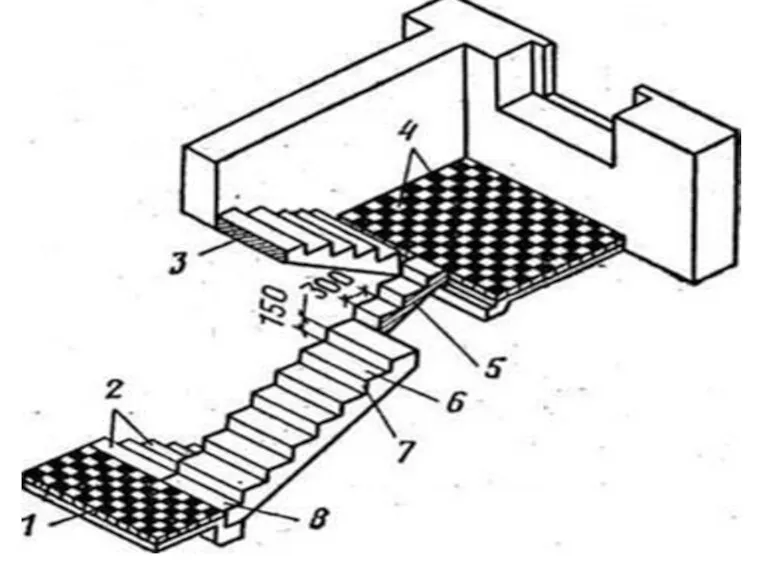 Лестница. Элементы лестницы
Лестница. Элементы лестницы МОУ ДОД «Детско-юношеский центр»
МОУ ДОД «Детско-юношеский центр» Планирование и проектирование организации
Планирование и проектирование организации