Содержание
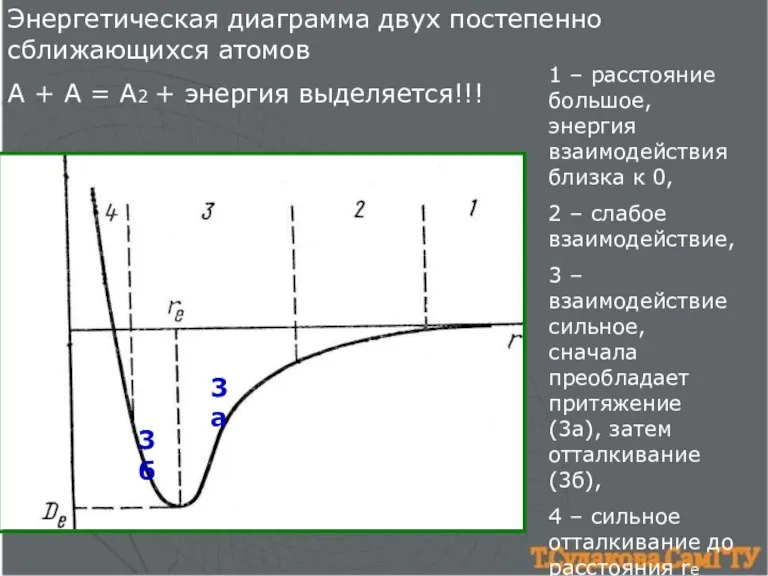
- 2. Энергетическая диаграмма двух постепенно сближающихся атомов А + А = А2 + энергия выделяется!!! 1 –
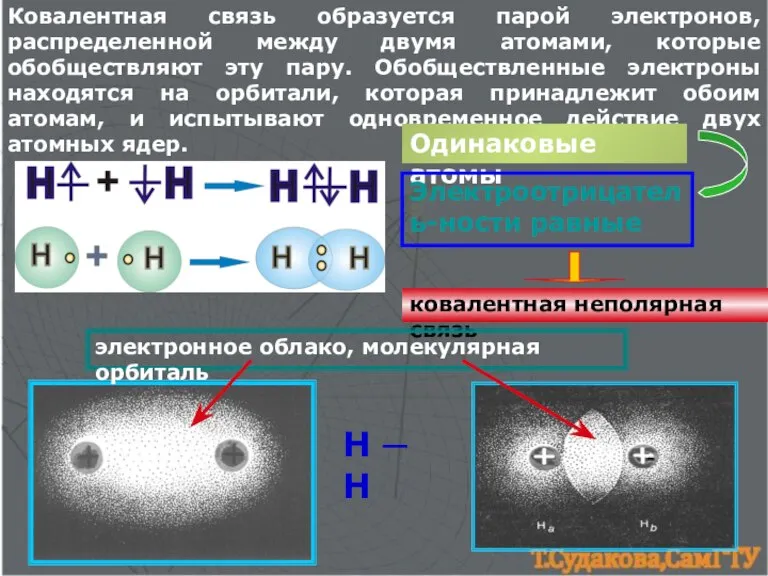
- 3. Ковалентная связь образуется парой электронов, распределенной между двумя атомами, которые обобществляют эту пару. Обобществленные электроны находятся
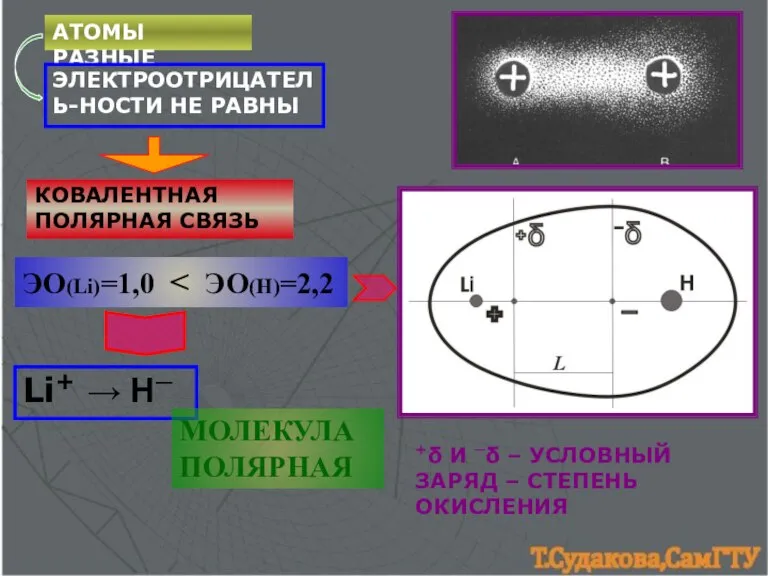
- 4. АТОМЫ РАЗНЫЕ ЭЛЕКТРООТРИЦАТЕЛЬ-НОСТИ НЕ РАВНЫ КОВАЛЕНТНАЯ ПОЛЯРНАЯ СВЯЗЬ +δ И ─δ – УСЛОВНЫЙ ЗАРЯД – СТЕПЕНЬ
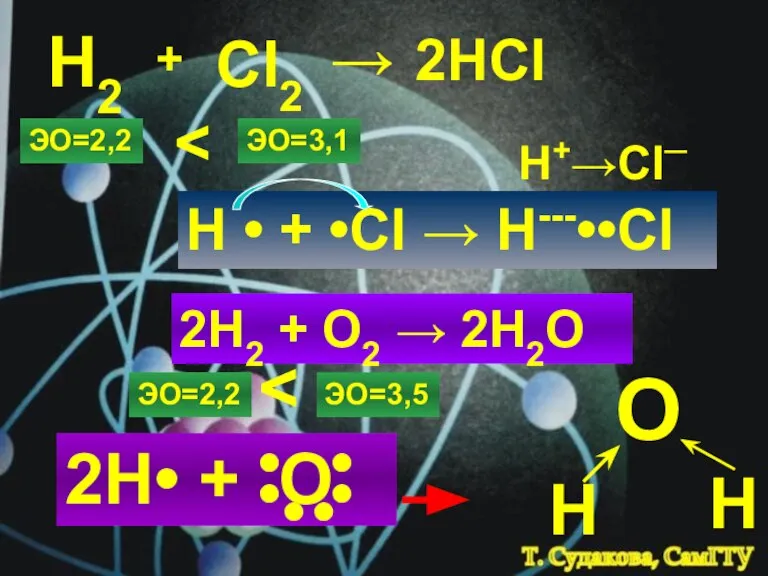
- 5. Н2 + Cl2 → 2HCl ЭО=2,2 ЭО=3,1 H • + •Cl → H---••Cl H+→Cl─ 2H2 +
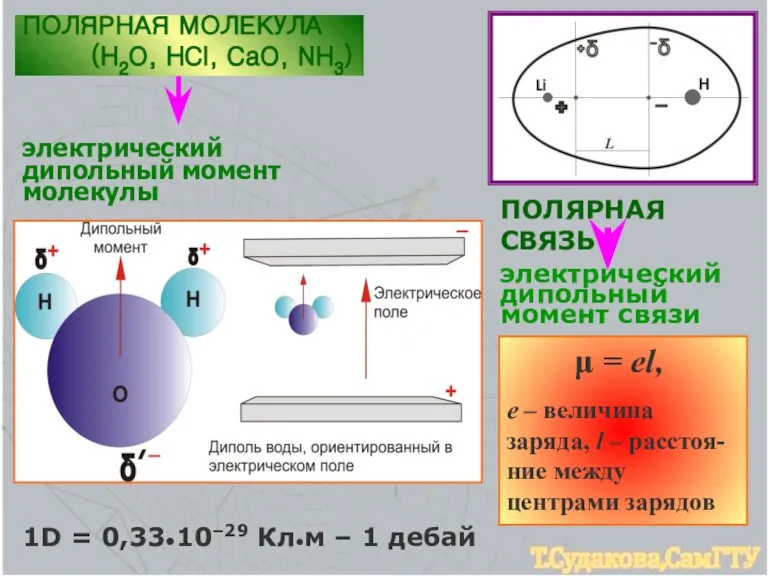
- 6. ПОЛЯРНАЯ СВЯЗЬ электрический дипольный момент связи μ = еl, е – величина заряда, l – расстоя-ние
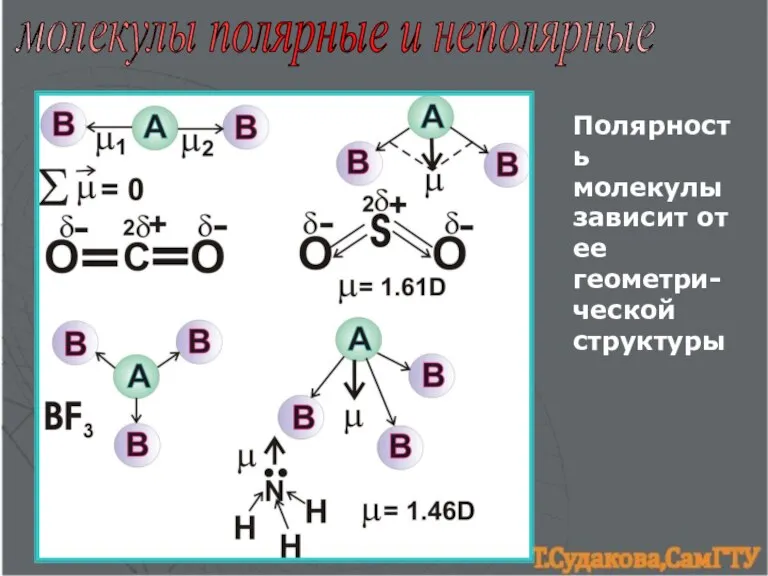
- 7. молекулы полярные и неполярные Полярность молекулы зависит от ее геометри-ческой структуры
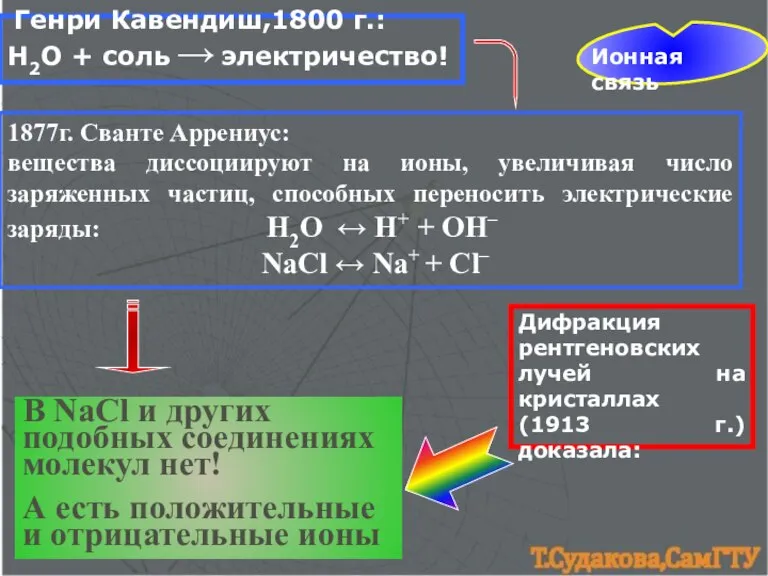
- 8. Ионная связь Генри Кавендиш,1800 г.: Н2О + соль → электричество! 1877г. Сванте Аррениус: вещества диссоциируют на
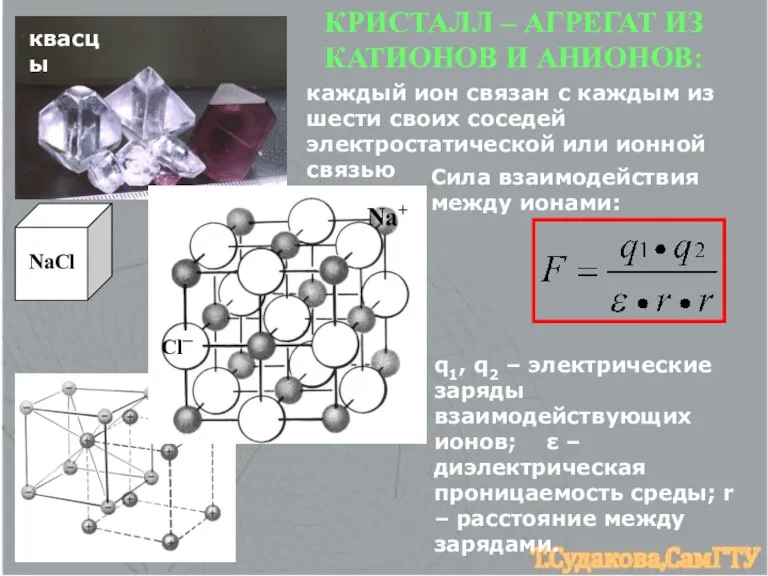
- 9. квасцы NaCl Cl─ Na+ КРИСТАЛЛ – АГРЕГАТ ИЗ КАТИОНОВ И АНИОНОВ: каждый ион связан с каждым
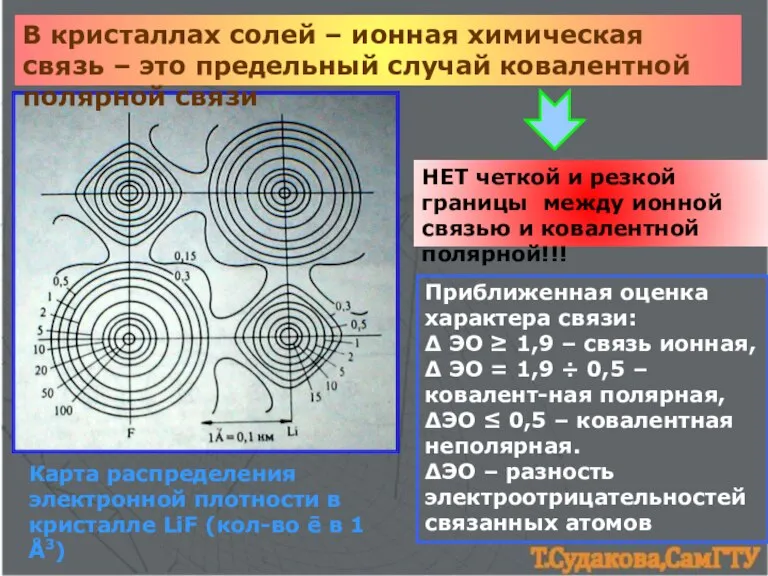
- 10. В кристаллах солей – ионная химическая связь – это предельный случай ковалентной полярной связи НЕТ четкой
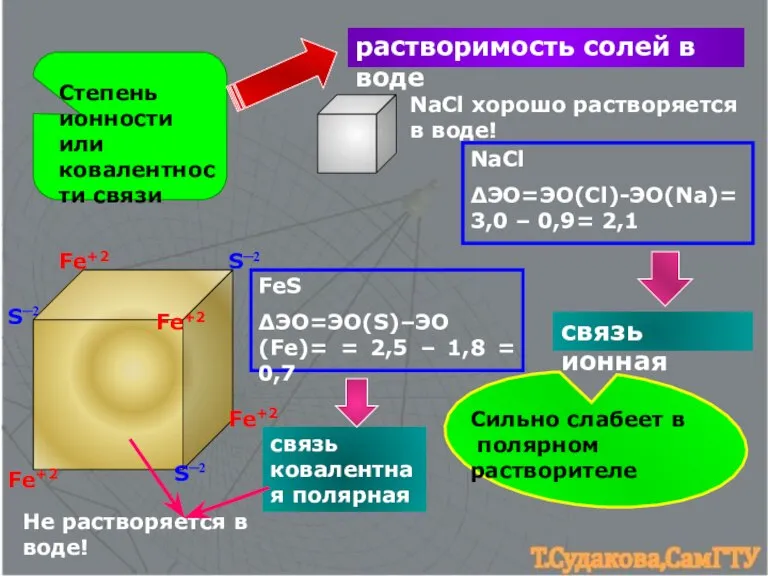
- 11. Степень ионности или ковалентности связи растворимость солей в воде Fe+2 Fe+2 Fe+2 Fe+2 S─2 S─2 S─2
- 12. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ КОВАЛЕНТНОЙ СВЯЗИ NH3 + H-OH = [NH4]OH вакантная АО неподелен-ная пара ē комплек-сный ион
- 13. комплексные ионы Катионы [NH4]+, [Zn(NH3)4]2+ Анионы [Al(OH)4]─, [CuCl4]2─ структура комплексного иона [Zn+2(NH3)04]2+ [Cu+2Cl─4]2─ ион-комплексообразователь лиганды координаци-онное
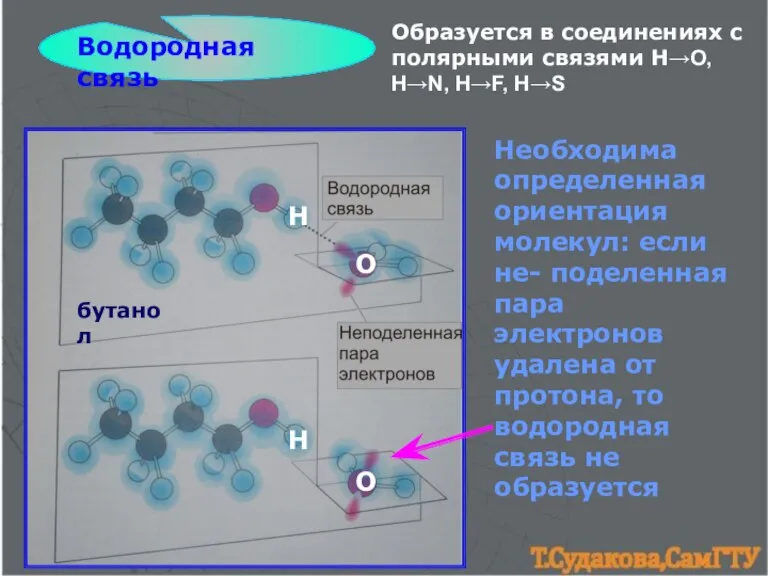
- 14. Водородная связь Образуется в соединениях с полярными связями H→O, H→N, H→F, H→S Н О Н О
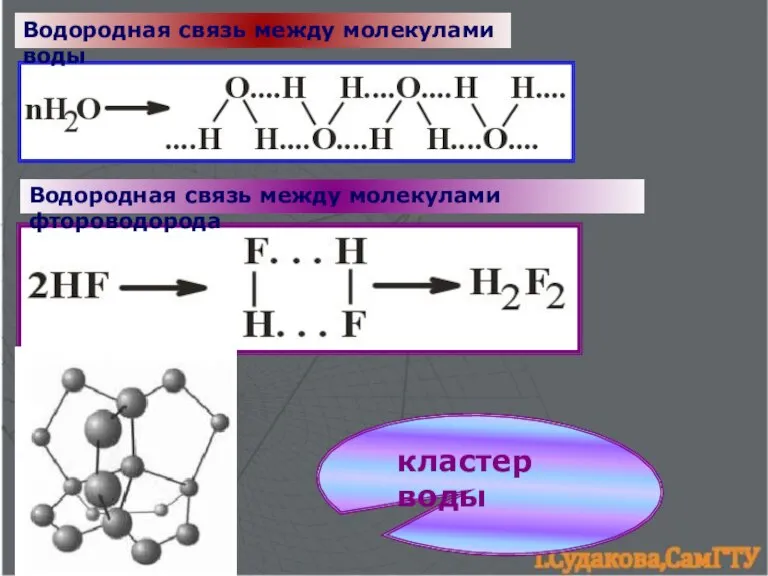
- 15. Водородная связь между молекулами воды Водородная связь между молекулами фтороводорода кластер воды
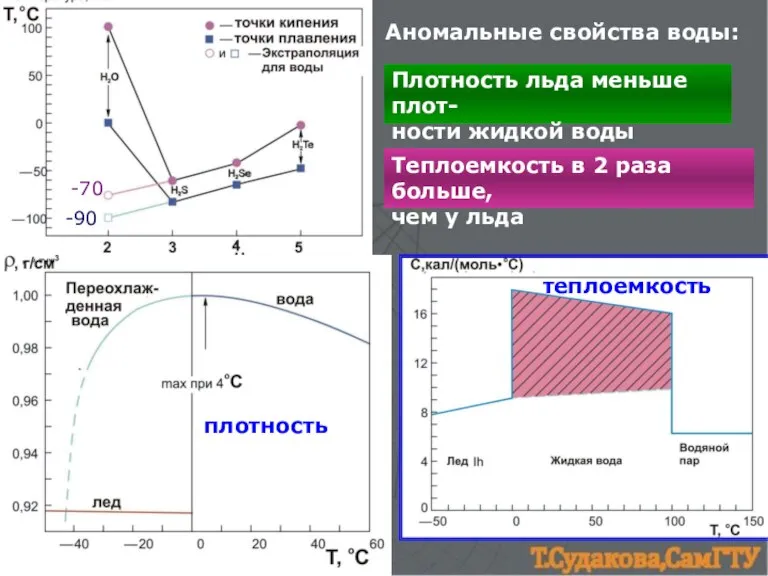
- 16. -90 -70 плотность теплоемкость Аномальные свойства воды: Плотность льда меньше плот- ности жидкой воды Теплоемкость в
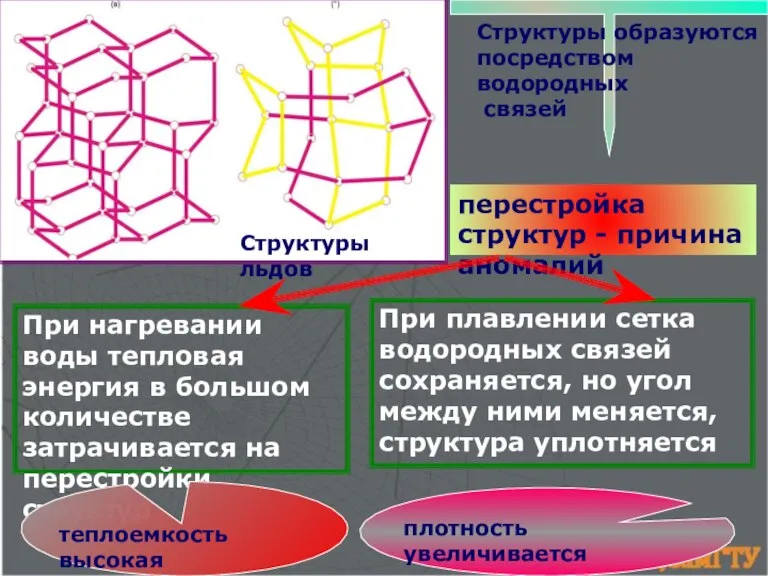
- 17. перестройка структур - причина аномалий Структуры образуются посредством водородных связей Структуры льдов При плавлении сетка водородных
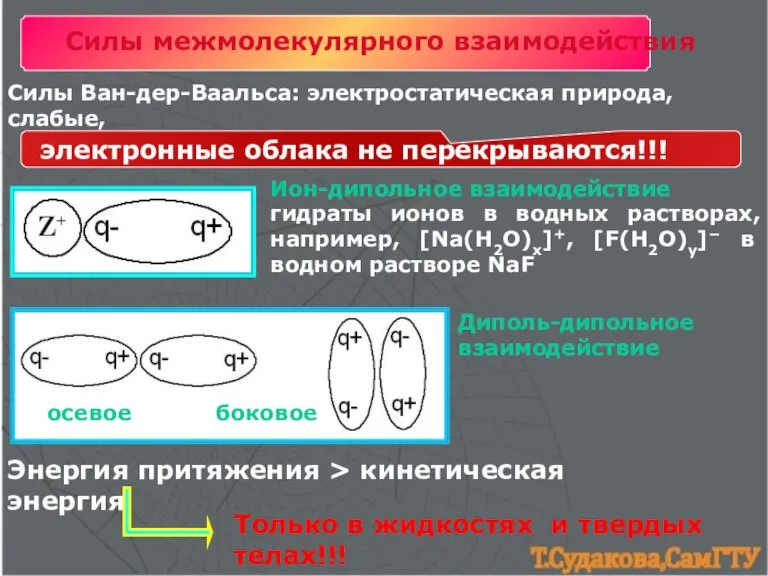
- 18. Силы межмолекулярного взаимодействия Силы Ван-дер-Ваальса: электростатическая природа, слабые, Ион-дипольное взаимодействие гидраты ионов в водных растворах, например,
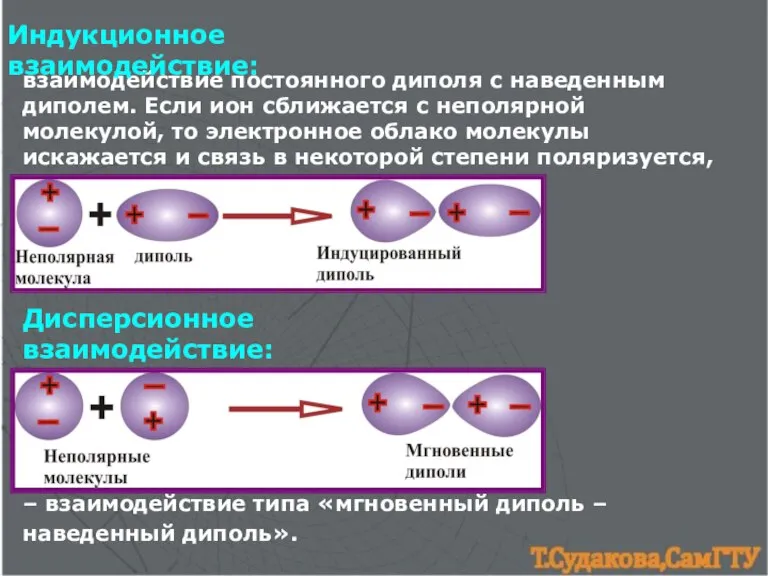
- 19. взаимодействие постоянного диполя с наведенным диполем. Если ион сближается с неполярной молекулой, то электронное облако молекулы
- 20. обусловлено отталкиванием атомных ядер разных молекул (касается только малых по размерам молекул, например, Н2) или, в
- 21. Относительная величина межмолекулярных взаимодействий чем сильнее взаимодействие, тем выше Ткип Вещество Дипольный момент Температура кипения H2
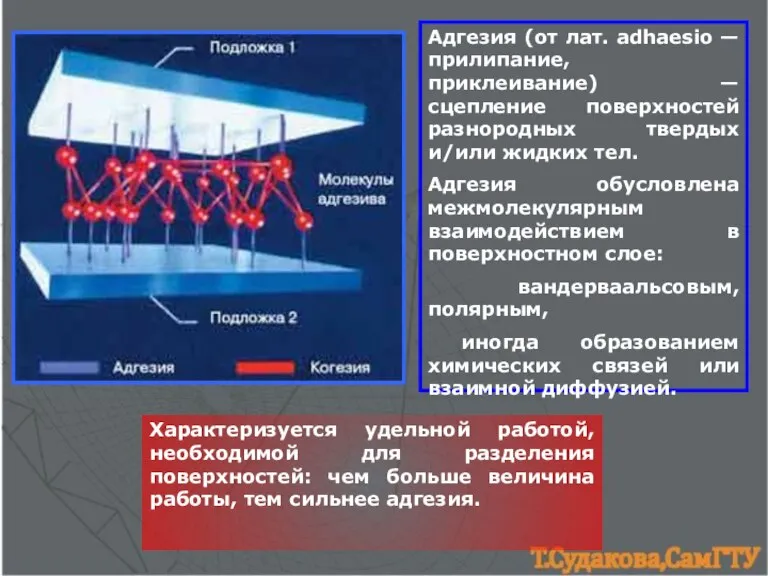
- 22. Адгeзия (от лат. adhaesio — прилипание, приклеивание) — сцепление поверхностей разнородных твердых и/или жидких тел. Адгезия
- 23. Кто это?
- 24. Геккон – безобидная красивая ящерка, обладающая уникальной способностью лазать где угодно и как угодно. Гекконы не
- 25. Инженеры Стэнфордского университета создали робота-геккона, способного передвигаться по гладким вертикальным поверхностям за счет специальной резины на
- 27. Скачать презентацию
![ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ КОВАЛЕНТНОЙ СВЯЗИ NH3 + H-OH = [NH4]OH вакантная АО неподелен-ная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336330/slide-11.jpg)
![комплексные ионы Катионы [NH4]+, [Zn(NH3)4]2+ Анионы [Al(OH)4]─, [CuCl4]2─ структура комплексного иона [Zn+2(NH3)04]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336330/slide-12.jpg)





 Презентация Урок мужества «крепость на волге.сталинградская битва»
Презентация Урок мужества «крепость на волге.сталинградская битва» Разработка сверхэкономичной светодиодной лампы
Разработка сверхэкономичной светодиодной лампы Как написать продающий пост
Как написать продающий пост Проект «Школа логики»
Проект «Школа логики» Моя будущая специальность. Технология освоения специальности
Моя будущая специальность. Технология освоения специальности Курсовой проект по дисциплине Современные проблемы аграрной экономики и менеджмента
Курсовой проект по дисциплине Современные проблемы аграрной экономики и менеджмента Юбилей школы №32. Встреча одноклассников
Юбилей школы №32. Встреча одноклассников Минутка чистописания Словарь-эстафета Исследование 1.
Минутка чистописания Словарь-эстафета Исследование 1. История психопатологии за рубежом
История психопатологии за рубежом Школьный краеведческий музей МОУ «Медведская основная общеобразовательная школа»
Школьный краеведческий музей МОУ «Медведская основная общеобразовательная школа» Стартапы и СМИ. - презентация
Стартапы и СМИ. - презентация Экзистенциализм
Экзистенциализм Бумага и картон
Бумага и картон Библиотечный урок
Библиотечный урок Презентация услуг ООО “Охранное агентство “Бейлиф”
Презентация услуг ООО “Охранное агентство “Бейлиф” Краткий курс по подготовке выступления на Science Slam
Краткий курс по подготовке выступления на Science Slam Презентация для учеников 8-11 классов «Стань заметным!»
Презентация для учеников 8-11 классов «Стань заметным!» Презентация по КНЯ по теме “флора и фауна ямала”
Презентация по КНЯ по теме “флора и фауна ямала” У истоков российской государственности Виртуальная книжная выставка
У истоков российской государственности Виртуальная книжная выставка Риск банков, эндогенный для выбора стратегического управления Мантос Д. Делис, Ифтехар Хасан, Эфтимиос Г. Ционас
Риск банков, эндогенный для выбора стратегического управления Мантос Д. Делис, Ифтехар Хасан, Эфтимиос Г. Ционас оформление реферата
оформление реферата Управление рисками проекта
Управление рисками проекта Новые экономические механизмы
Новые экономические механизмы Углерод.
Углерод. Международные и национальные стандарты в области свободы выражения мнений и доступа к информации Вячеслав Абрамов, Международный
Международные и национальные стандарты в области свободы выражения мнений и доступа к информации Вячеслав Абрамов, Международный Учитель технологии Мелкумян Сергей Рубенович
Учитель технологии Мелкумян Сергей Рубенович ПЛАВУЧАЯ ЛАБОРАТОРИЯ ДЛЯ ИЗУЧЕНИЯ ХИМИЧЕСКИХ И ФИЗИЧЕСКИХ ПАРАМЕТРОВ ВОДЫ.
ПЛАВУЧАЯ ЛАБОРАТОРИЯ ДЛЯ ИЗУЧЕНИЯ ХИМИЧЕСКИХ И ФИЗИЧЕСКИХ ПАРАМЕТРОВ ВОДЫ. Времена года. Saisons
Времена года. Saisons