Содержание
- 3. Общая характеристика элементов VIB подгруппы Эл. cтроение rат, нм СО Cr [Ar] 3d54s1 0,126 II, III,
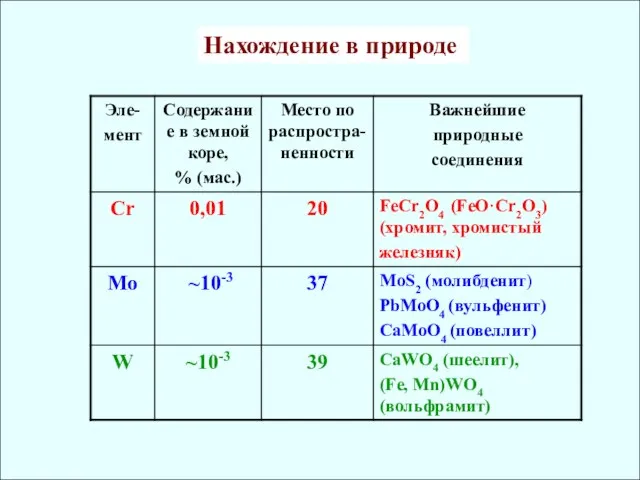
- 4. Нахождение в природе
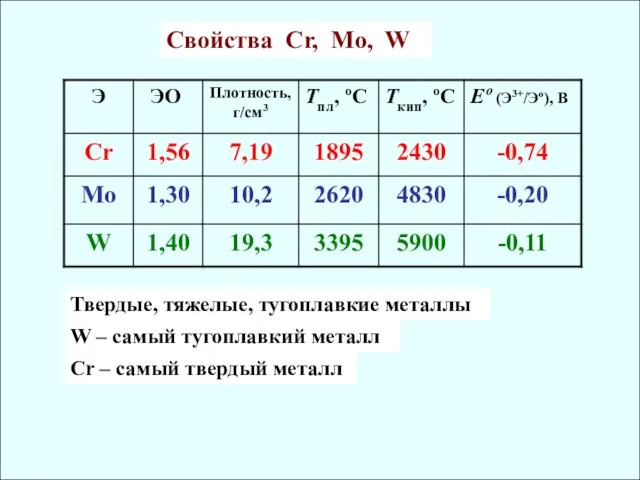
- 5. Cвойства Cr, Mo, W Твердые, тяжелые, тугоплавкие металлы W – самый тугоплавкий металл Сr – самый
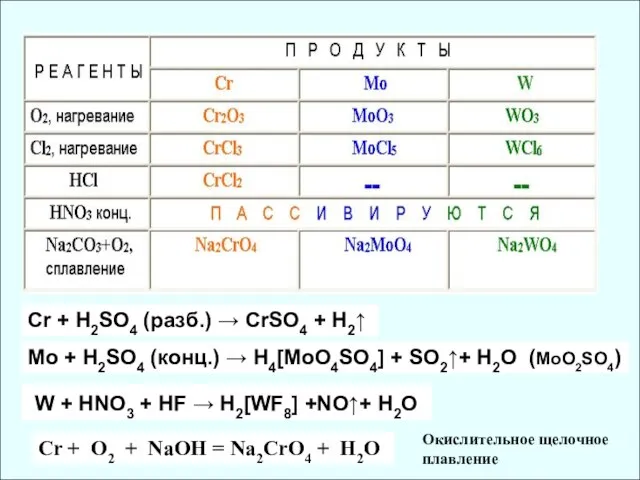
- 6. Cr + H2SO4 (разб.) → СrSO4 + H2↑ Mo + H2SO4 (конц.) → H4[MoO4SO4] + SO2↑+
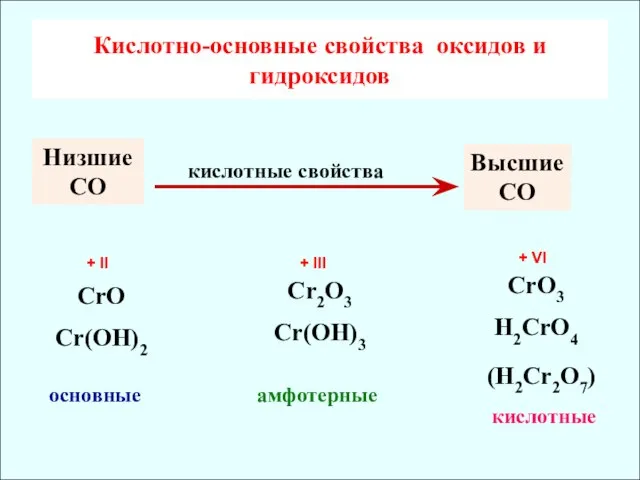
- 7. Кислотно-основные свойcтва оксидов и гидроксидов CrO Cr(OH)2 основные Cr2O3 Cr(OH)3 CrO3 H2CrO4 амфотерные кислотные Низшие СО
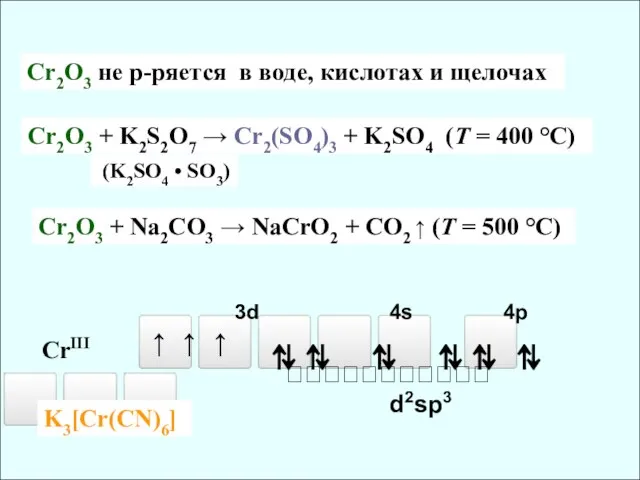
- 8. Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4] тетрагидроксохромит натрия Cr2O3 +
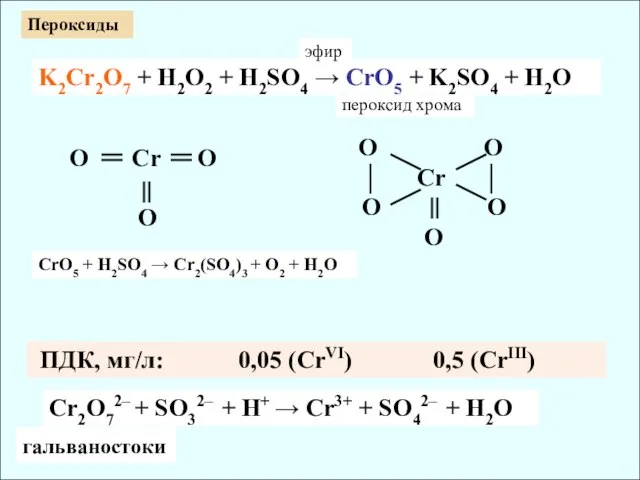
- 9. Соединения Cr, Mo, W +VI K2Cr2O7 + H2SO4 (конц.) → CrO3↓ + K2SO4 + H2O CrO3
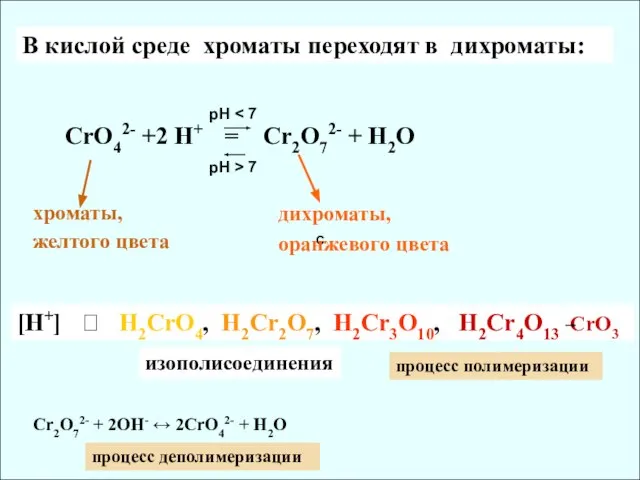
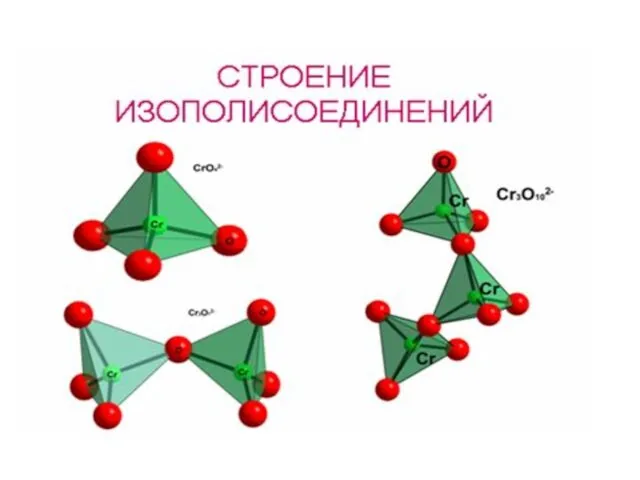
- 10. C В кислой среде хроматы переходят в дихроматы: СrO42- +2 H+ = Cr2O72- + H2O хроматы,
- 12. K2Cr2O7 + HCl (конц.) → СrCl3 + Cl2↑+ KCl + H2O ☞ Самостоятельно закончите данное уравнение,
- 13. Cr2O72– + SO32– + H+ → Cr3+ + SO42– + H2O ПДК, мг/л: 0,05 (CrVI) 0,5
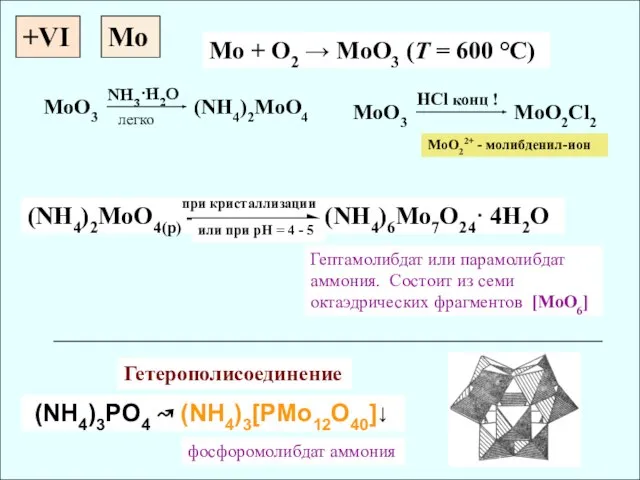
- 14. +VI Mo + O2 → MoO3 (T = 600 °C) (NH4)2MoO4(p) (NH4)6Mo7O24· 4H2O (NH4)3PO4 ↝ (NH4)3[PMo12O40]↓
- 15. Вольфрам. Изополисоединения. [H2W12O42]10- - паравольфрамат Б-ион; [H2W12O40]6- - метавольфрамат-ион [W7O24]6- - паравольфрамат А-ион Na2MoO4 —→ 3MoO3
- 16. +III (NH4)2Cr2O7 → Cr2O3 + N2 ↑ + H2O ↑ (T = 180 °C) лабораторный способ
- 17. CrIII ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑ ↑ ↑
- 18. [Cr(H2O)6]3+ [Cr(H2O)5OH]2+ …… [Cr(H2O)3(OH)3]0 [Cr(H2O)2(OH)4]– …… [Cr(OH)6]3– Cr3+ CrOH2+ Cr(OH)3 ↓ [Cr(OH)4]– [Cr(OH)6]3– Условно: pH
- 19. Сr(OH)3 HCl KOH ⭩ ⭨ CrCl3 K[Cr(OH)4] K3[Cr(OH)6] S2– H2S Cr3+ + CO32– + H2O →
- 20. CrIII CrVI Cr3+ [Cr(OH)6]3- Cr2O72- CrO42- H+ H+ OH- OH- Схема переходов CrIII в CrVI в
- 21. +II Cr + HCl → CrCl2 + H2 ↑ CrCl3 + Zn → CrCl2 + ZnCl2
- 22. t CrO3 + Al Cr + Al2O3 Получение хрома из оксида осуществляют методом алюмотермического восстановления Основная
- 23. Дополнительный материал к лекции № 12 Хром, молибден, вольфрам* *Производство вольфрама описано в дополнительных материалах к
- 24. Хром В металлургии для получения легированных сталей более выгодно использовать не чистый металл (Cr), а его
- 25. Получение феррохрома Для выплавки феррохрома применяют хромовую руду – хромистый железняк (FeO · Cr2O3), в котором
- 26. Содержание углерода в феррохроме может достигать 8 % - это так называемый высокоуглеродистый феррохром. В процессе
- 27. Одновременно протекают реакции восстановления карбидов хрома и железа: (Cr, Fe)хСу + хSi = х(Cr, Fe) Si
- 28. Получение хрома Получение металлического хрома из природного хромистого железняка осуществляют в несколько стадий. Первая стадия– окислительное
- 29. Металлический хром получают электролизом растворов солей хрома (III) или алюмотермическим восстановлением Cr2O3. Cr2O3 + 2Al =
- 30. Молибден Молибденит (MoS2) – наиболее распространенный и промышленно важный минерал молибдена. После обогащения молибденовых руд концентрат
- 31. 3. Выщелачивание. Огарок выщелачивают раствором аммиака. Выщелачивание проводят в стальных реакторах, на холоду или при температуре
- 33. Скачать презентацию
![Общая характеристика элементов VIB подгруппы Эл. cтроение rат, нм СО Cr [Ar]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361861/slide-2.jpg)
![Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2O Cr(OH)3 + NaOH = Na[Cr(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361861/slide-7.jpg)


![Вольфрам. Изополисоединения. [H2W12O42]10- - паравольфрамат Б-ион; [H2W12O40]6- - метавольфрамат-ион [W7O24]6- - паравольфрамат](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361861/slide-14.jpg)

![[Cr(H2O)6]3+ [Cr(H2O)5OH]2+ …… [Cr(H2O)3(OH)3]0 [Cr(H2O)2(OH)4]– …… [Cr(OH)6]3– Cr3+ CrOH2+ Cr(OH)3 ↓ [Cr(OH)4]– [Cr(OH)6]3– Условно: pH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361861/slide-17.jpg)
![Сr(OH)3 HCl KOH ⭩ ⭨ CrCl3 K[Cr(OH)4] K3[Cr(OH)6] S2– H2S Cr3+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361861/slide-18.jpg)
![CrIII CrVI Cr3+ [Cr(OH)6]3- Cr2O72- CrO42- H+ H+ OH- OH- Схема переходов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361861/slide-19.jpg)











 Площадка для проведения массовых и культурных мероприятий “АРСЕНАЛ” от компании “NEXT LEVEL”
Площадка для проведения массовых и культурных мероприятий “АРСЕНАЛ” от компании “NEXT LEVEL” Классификатор печатных СМИ – от хаоса к структурированному рынку
Классификатор печатных СМИ – от хаоса к структурированному рынку Неминучість інновацій в ЗСО ХХІ ст
Неминучість інновацій в ЗСО ХХІ ст Табір "Світанок"
Табір "Світанок" mnozhestva_chisel (1)
mnozhestva_chisel (1) Автоматизация звука Щ в словах и предложениях
Автоматизация звука Щ в словах и предложениях спбгу
спбгу Расчёт напряженно-деформированного состояния лопатки компрессора авиационного двигателя
Расчёт напряженно-деформированного состояния лопатки компрессора авиационного двигателя Англоязычные страны
Англоязычные страны Команда Молодежка
Команда Молодежка Отряд Блохи
Отряд Блохи Я живу в Мордовии!
Я живу в Мордовии! Естествознание 6 класс 6.1B Вселенная. Земля. Человек. Сферы Земли и их составляющие Презентация (1)
Естествознание 6 класс 6.1B Вселенная. Земля. Человек. Сферы Земли и их составляющие Презентация (1) Слайд только для инструкторов *** Не демонстрировать во время презентации
Слайд только для инструкторов *** Не демонстрировать во время презентации Презентацию выполнила: Мажуга Евгения, гр. МЭ081
Презентацию выполнила: Мажуга Евгения, гр. МЭ081 АССЕССМЕНТ ЦЕНТР применение модели компетенций
АССЕССМЕНТ ЦЕНТР применение модели компетенций Создание сети базовых центров системного проектирования радиоэлектронной промышленности в 2010 году
Создание сети базовых центров системного проектирования радиоэлектронной промышленности в 2010 году Правописание безударной гласной в словах
Правописание безударной гласной в словах Лето. Загадки про явления в природе летом
Лето. Загадки про явления в природе летом Презентация на тему Праздники и формы работы с детьми
Презентация на тему Праздники и формы работы с детьми РОССИЙСКИЙ ЭКОНОМИЧЕСКИЙ И ФИНАНСОВЫЙ ФОРУМ В ФИНЛЯНДИИ
РОССИЙСКИЙ ЭКОНОМИЧЕСКИЙ И ФИНАНСОВЫЙ ФОРУМ В ФИНЛЯНДИИ "Мир профессий"
"Мир профессий" Информация и информационные процессы в технике
Информация и информационные процессы в технике Покрытосеменные растения (6 класс)
Покрытосеменные растения (6 класс) Понятие, признаки и виды вспомогательных репродуктивных технологий. Нормативно-правовое регулирование
Понятие, признаки и виды вспомогательных репродуктивных технологий. Нормативно-правовое регулирование Семь чудес Казахстана
Семь чудес Казахстана накопления и финансы
накопления и финансы Что в имени тебе моём?
Что в имени тебе моём?