Содержание
- 2. Растворы Растворы – однородные системы переменного состава. Дисперсные системы Взвеси r>100нм Коллоидные растворы 1 Истинные Растворы
- 3. Растворы в результате: ΔНразр.св. NaOH, CaSO4 экзо: H2SO4 1. 2. ΔHразр.св. ~ ΔHгидрат. ΔHm ~ 0
- 4. Растворитель. Растворенное вещество моль/л (М) моль/л (N) моль/кг (б.р.,%) Состав растворов
- 5. Состав растворов (б.р.,%) (г/л; г/мл) (моль/л); Молярность р-ра (М) (ρ(Р) в г/л) kst = mB, растворяющаяся
- 6. Растворимость CaSO4 H2O T = const CaSO4(P) CaSO4(T) [Ca2+(P)+SO42-(P)]
- 7. Растворимость Насыщенным назыв. раствор, находящийся в подвижном гетерогенном равновесии с растворяемым веществом. B(T) B(р); B(г) В(р)
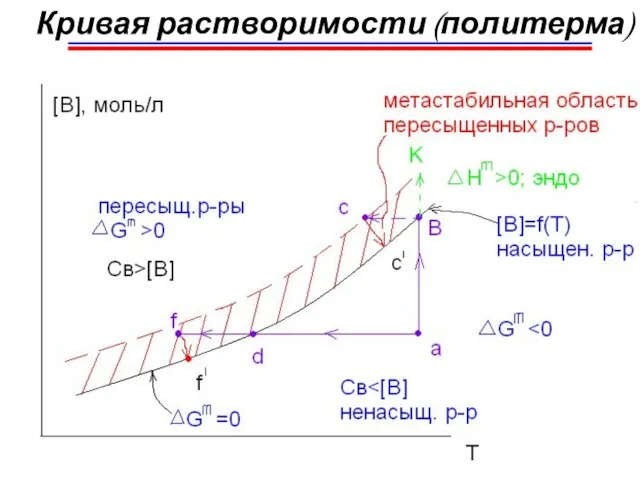
- 8. Кривая растворимости (политерма)
- 9. I. Из ненасыщенного р-ра → в пересыщен. р-р 1) Т↓ (а → f) 2) испарение растворителя
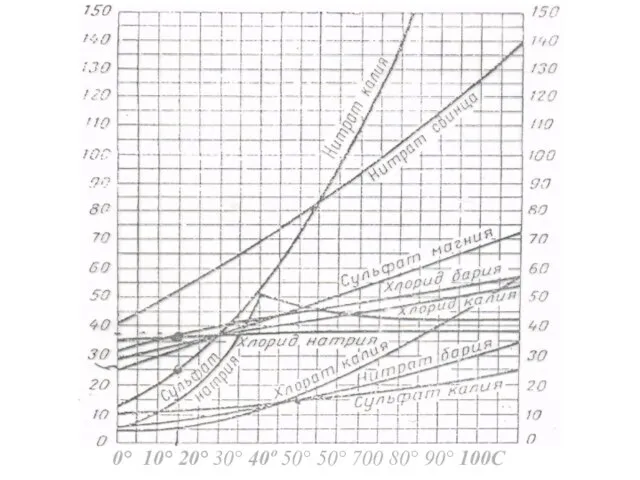
- 10. 0° 10° 20° 30° 40º 50° 50° 700 80° 90° 100С
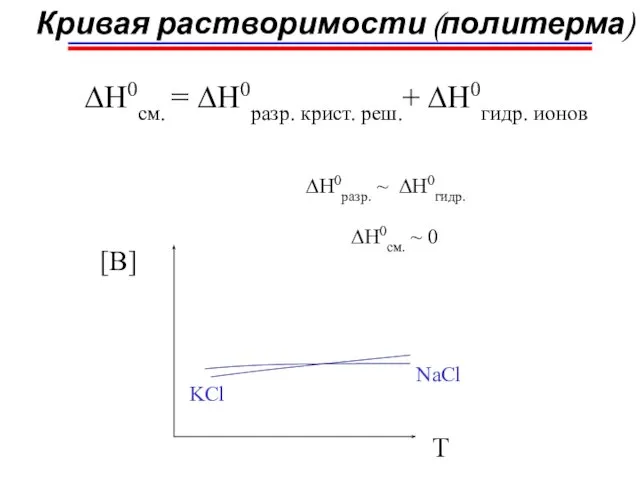
- 11. Кривая растворимости (политерма) ∆H0см. = ∆H0разр. крист. реш.+ ∆H0гидр. ионов ∆H0разр. ∆H0см. (экзотерм.) [B] ∆H0см. газы,
- 12. Кривая растворимости (политерма) ∆H0см. = ∆H0разр. крист. реш.+ ∆H0гидр. ионов ∆H0разр. > ∆H0гидр. ∆H0см. > 0
- 13. ∆H0разр. ~ ∆H0гидр. ∆H0см. ~ 0 Кривая растворимости (политерма) ∆H0см. = ∆H0разр. крист. реш.+ ∆H0гидр. ионов
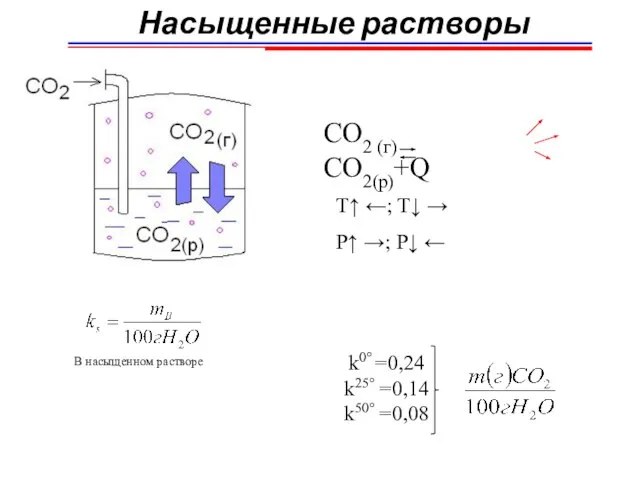
- 14. Насыщенные растворы СO2 (г) CO2(р)+Q Т↑ ←; T↓ → P↑ →; P↓ ← В насыщенном растворе
- 15. Насыщенные растворы сахар(т) сахар(р)-Q эндо ∆Hm > 0 T↑ →; T↓ ← P↑ или P↓ ≠
- 16. Электролитическая диссоциация
- 17. 1. По отношению к электрическому току вещества бывают: проводящие электрический ток (электролиты) не проводящие электрический ток
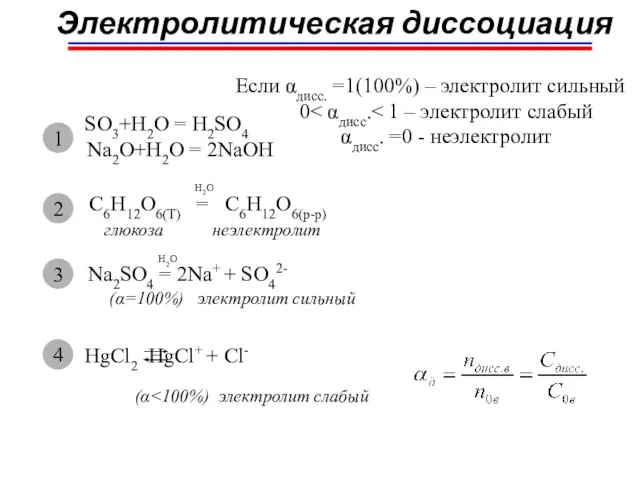
- 18. Электролитическая диссоциация Степень диссоциации – отношение числа диссоциированных молекул к общему числу растворенных молекул = f(T,
- 19. Электролитическая диссоциация закон разбавления Оствальда если α тогда Кдисс.~ α2С0; (Kдисс ≤ 10-3) 1. T↑ →;αд↑
- 20. SO3+H2O = H2SO4 Na2O+H2O = 2NaOH Электролитическая диссоциация 1 C6H12O6(T) = C6H12O6(p-p) H2O глюкоза неэлектролит 2
- 21. Слабые электролиты Гидроксиды: NH3.H2O NH4++OH- Be(OH)2 BeOH++OH- Fe(OH)2 FeOH++OH- Zn(OH)2 ZnOH++OH- Zn(OH)+ Zn2++OH- и гидроксокомплексы [Al(OH)4]-
- 22. B = N2, O2 CO, CH4 B(г) В(р) Слабые электролиты ΔH0см. = ΔH0разр.+ ΔH0гидрат.(сольватации) > 0
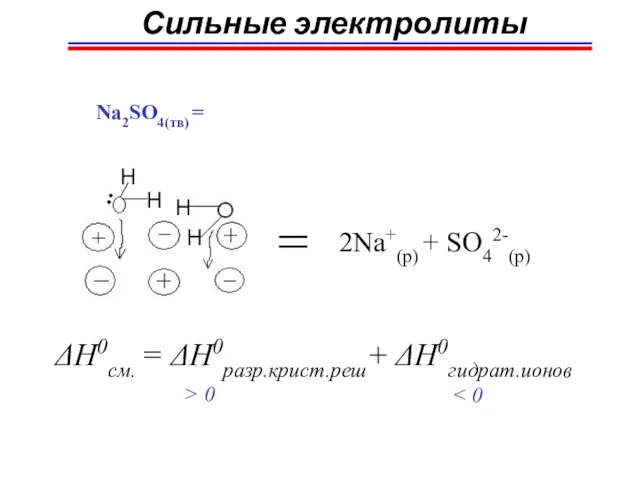
- 23. Сильные электролиты Na2SO4(тв) = 2Na+(p) + SO42-(p) ΔH0см. = ΔH0разр.крист.реш+ ΔH0гидрат.ионов > 0
- 24. Произведение растворимости Произведение растворимости (ПР) - произведение равновесных концентраций ионов сильных малорастворимых электролитов в их насыщенном
- 25. Произведение растворимости [S2-] 1∙10-18 8∙10-18 9∙10-13 моль/л CuS Ag2S Sb2S3 ПР 10-36 10-52 10-60 СuS(T) Cu2+(p)+S2-(p)
- 26. Произведение растворимости S2- Ag2CO3 Ag2S CO32- ПРВ 10-13 10-52 С2Аg+.CS2-≥ПРAg2S Ag2CO3(T) 2Ag+(p)+CO32-(p) 4L2.L=ПРAg2CO3=4L3 L Ag2CO3= САg+=
- 27. Смещение ионных равновесий малорастворимых веществ PbCl2(T) Pb2+(p)+2Cl-(p) ПРPbCl2=1,7.10-5 (250C) [Pb2+][Cl-]2=1,7.10-5 (250C)
- 28. Влияние одноименных ионов 1.) NaCl = Na+(p) + Cl-(p) CCl- ; CPb2+ L =[Pb2+]’ Новое равновесие
- 29. PbCl2(T) Pb2+(p) + 2Cl-(p) Влияние одноименных ионов 2.) Введем S2- - ионы (Na2S) ПРPbS=8,7.10-29 Pb2++ S2-
- 30. Условие выпадения осадка nAm+(p) + mBn-(p) AnBm(T) Cn(Am+)∙ Cm(Bn-) > ПРAnBm (↓) Ca(NO3)2 = Ca2+(p) +
- 31. Условие выпадения осадка Ag2SO4↓ = ? a) C Ag+ = 10-2 моль/л C SO42- = 10-3
- 32. Предсказать возможные направления превращений BaCrO4 SrCrO4(T) CaCrO4(T) +Sr2+ +Ca2+ +Ba2+ +Sr2+ ??? ПР 1,1∙10-10 2,7∙10-5 (ks=13,2
- 33. Электролитическая диссоциация Идеальные растворы – растворы, образованные данным веществом, находящимся в одном и том же с
- 34. Протолитические равновесия Кислота – источник (донор) протонов Основание – приемник (акцептор) протонов Протолиз – перенос протонов
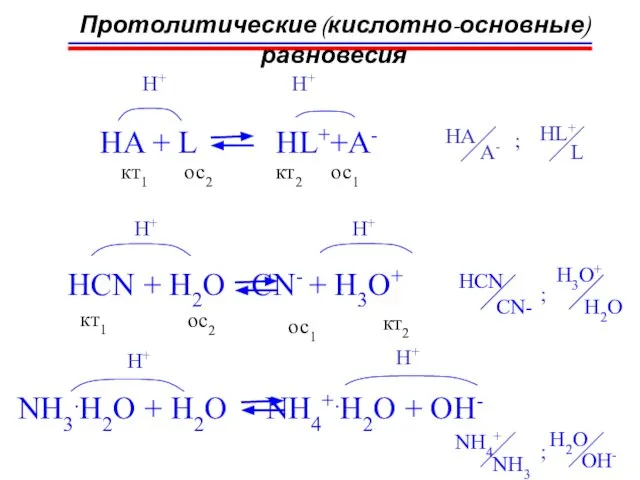
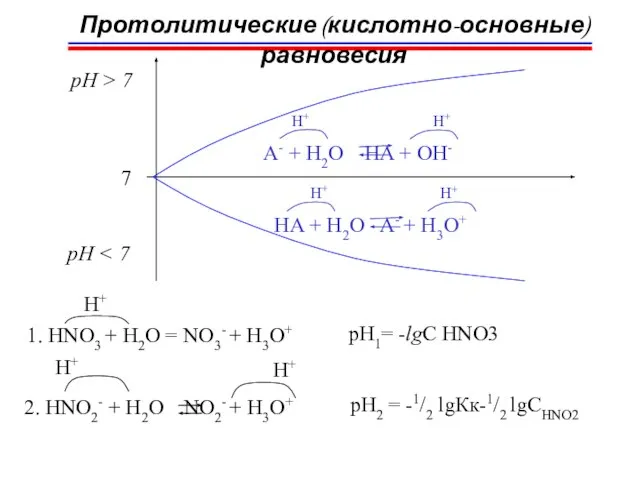
- 35. Протолитические (кислотно-основные) равновесия HA + L HL++A- H+ кт1 ос2 ос1 кт2 ; HA A- HL+
- 36. H2O + H2O OH- + H3O+ H+ H+ кт1 ос2 ос1 кт2 Протолитические (кислотно-основные) равновесия ;
- 37. Протолитические (кислотно-основные) равновесия C2H5OH + C2H5OH C2H5O- + C2H5OH2+ H+ H+ кт1 ос2 ос1 кт2 константа
- 38. Протолитические (кислотно-основные) равновесия H2O + H2O OH- + H3O+ H+ H+ ионное произведение воды Кв t,
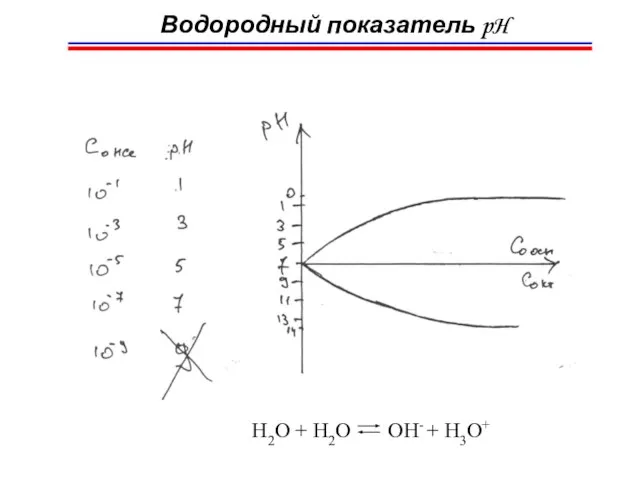
- 39. Водородный показатель pH pH = -lg[H3O+] pOH = -lg[OH-] pH= 1 ÷ 13 т.к. KB =
- 40. Водородный показатель pH Кислые растворы: [H3O+] > 10-7 : 10-6 ÷ 10-1 моль/л pH = 1
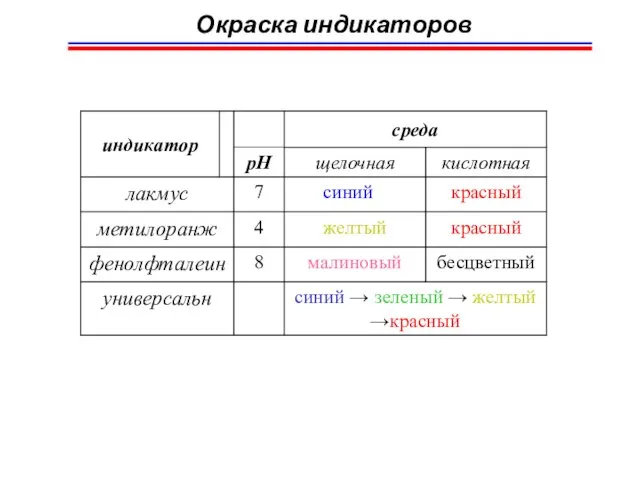
- 41. Окраска индикаторов
- 42. Протолитические (кислотно-основные) равновесия H2O + H2O OH- + H3O+ H3O+ KB=[H3O+][OH-] [H3O+] > 10-7 [OH-] Сильные
- 43. Водородный показатель pH Правило Полинга HnЭOm (m-n) ≥ 2 кислота сильная HClO4, HNO3… (m-n) = 1
- 44. Водородный показатель pH I. Сильные кислоты HCl + H2O = Cl- + H3O+ H+ Дано: pH
- 45. Кислоты H2SO4 + 2H2O = SO42- + 2H3O+ 2H+ [H3O+] = 2C0H2SO4 pH = -lg[H3O+] =
- 46. Протолитические (кислотно-основные) равновесия HA + H2O A- + H3O+ H+ H+ Для слабых кислот НА ;
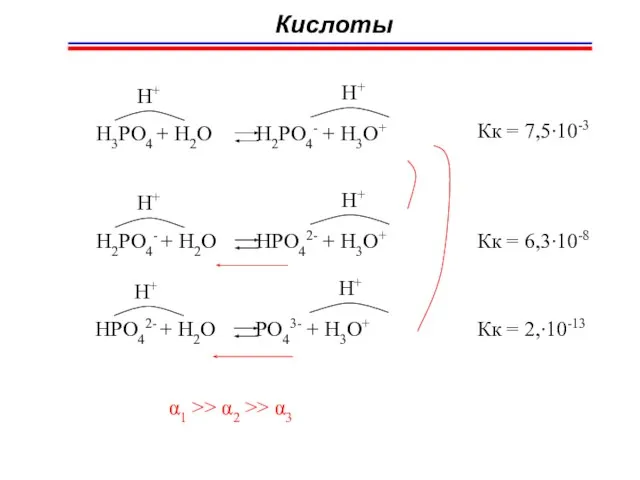
- 47. Кислоты H3PO4 + H2O H2PO4- + H3O+ H+ H+ Кк = 7,5∙10-3 H2PO4- + H2O HPO42-
- 48. Кислоты [Al(H2O)6]3+ + H2O [Al(H2O)5(OH)]2+ + H3O+ .. H+ H+ (Al∙H2O)3+ + H2O (AlOH)2+ + H3O+
- 49. Основания NaOH = Na+ + OH- pOH = -lg[OH-] =-lgC0NaOH pH = 14 – pOH =
- 50. H2O+NH3∙H2O OH-+ (NH4∙H2O)+ H+ H+ Основания Ко= [OH-]= pOH=-lg[OH-] = -lg
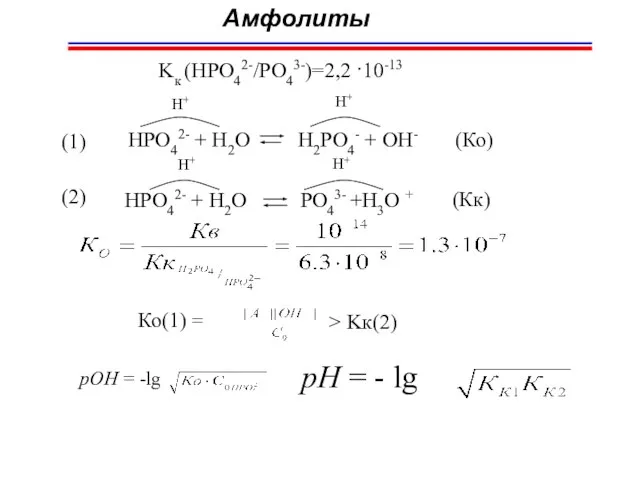
- 51. HPO42- + H2O PO43- +H3O + H+ H+ Амфолиты Ко(1) = pOH = -lg pH =
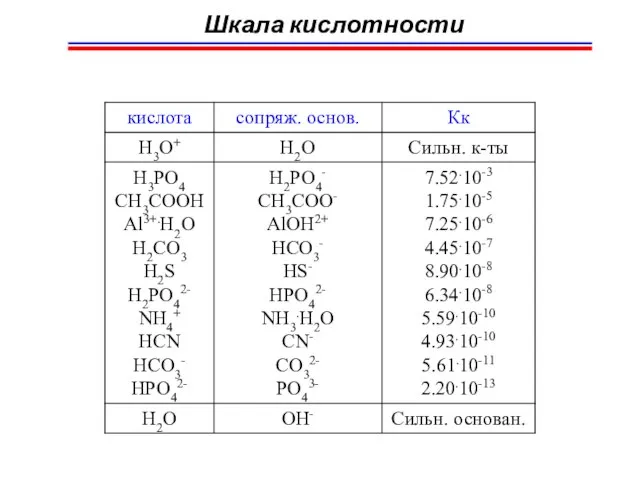
- 52. Шкала кислотности
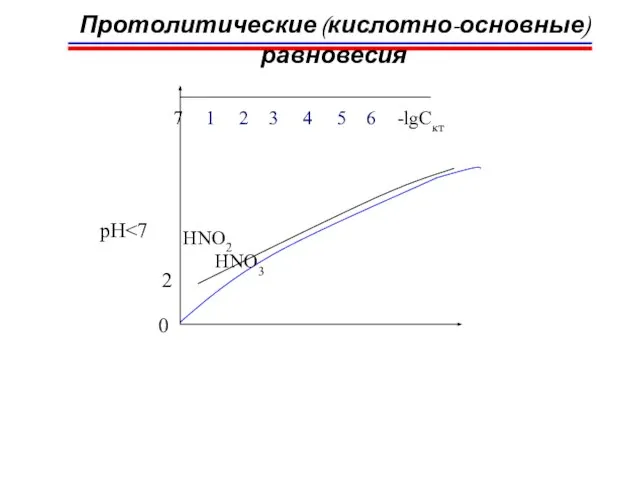
- 53. Протолитические (кислотно-основные) равновесия Рост степени протолиза анионов (ряд основности) F- α = 1 ÷ 2% α
- 54. Протолитические (кислотно-основные) равновесия αHA при разбавлении HCN + H2O CN -+ H3O+ H+ H+ Кк HCN
- 55. Протолитические (кислотно-основные) равновесия Для слабых оснований А- A- + H2O HA + OH- H+ H+ константа
- 56. СH3COOH + H2O CH3COO- + H3O+ H+ H+ Протолитические (кислотно-основные) равновесия Дано: С0 СH3COOH = 10-1моль/л
- 57. Водородный показатель pH H2O + H2O OH- + H3O+
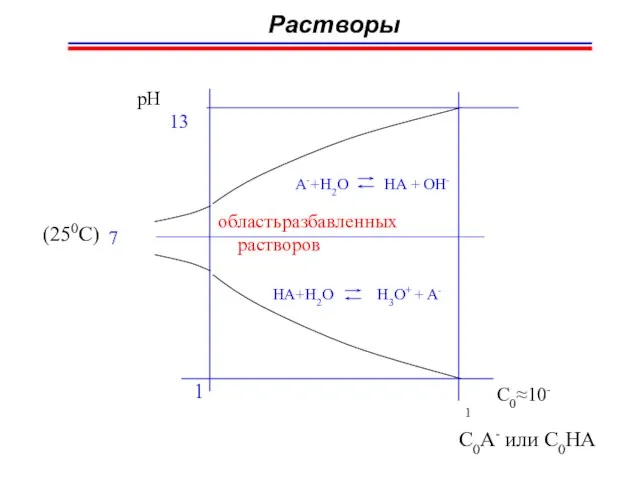
- 58. Протолитические (кислотно-основные) равновесия 7 pH > 7 pH A- + H2O HA + OH- H+ H+
- 59. Протолитические (кислотно-основные) равновесия
- 60. Растворы Сольволиз – хим. реакция вещества с протонсодержащим растворителем, приводящая к изменению концентрации ионов растворителя Гидролиз
- 61. Растворы 13 pH A-+H2O HA + OH- 7 область разбавленных растворов HA+H2O H3O+ + A- C0≈10-1
- 62. Сольволиз и гидролиз I. необратимый галогениды неметаллов SiCl4, NF3, PBr5, PCl3O и металлов d-элементов TiCl4, WCl6
- 63. Сольволиз и гидролиз карбиды, фосфиды и нитриды s- элементов CaC2, Li3N, Mg3N2, Mg3P2 Б) Mg3N2+8H2O =
- 64. Сольволиз и гидролиз Mg3P2+6H2O = 2PH3↑ +3Mg(OH)2(T) Mg(OH)2(T) Mg2+(p)+2OH-(p) x/2 x [Mg2+][OH-]2 ≈ 10-12 =ПР Mg(OH)2
- 65. Сольволиз и гидролиз В) некоторые соли: Al2S3, Al2(CO3)3 и т.д. 2Al + 3S = Al2S3 Al2S3
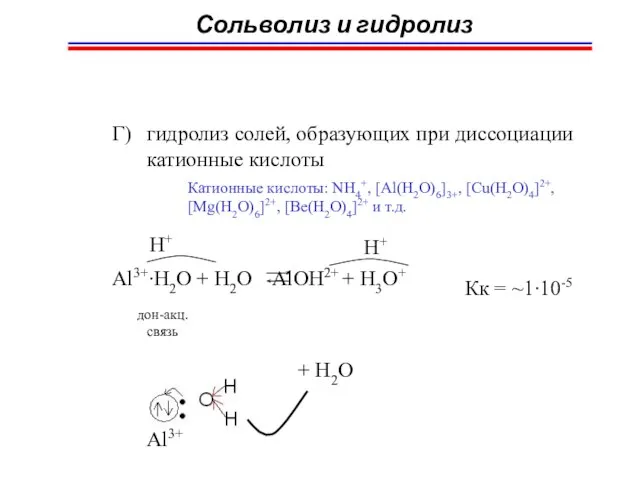
- 66. Сольволиз и гидролиз Г) гидролиз солей, образующих при диссоциации катионные кислоты Катионные кислоты: NH4+, [Al(H2O)6]3+, [Cu(H2O)4]2+,
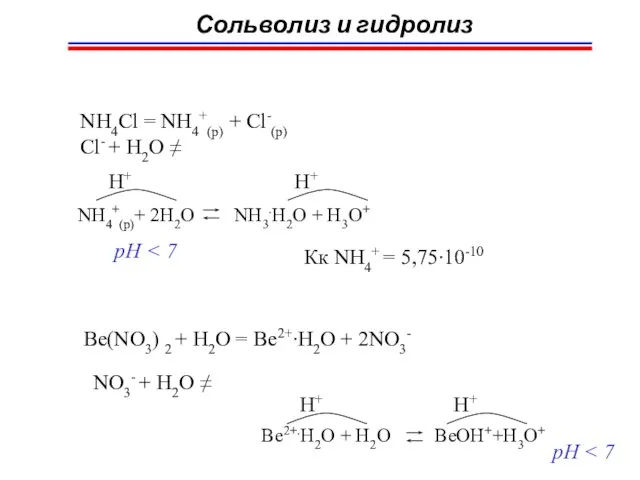
- 67. Сольволиз и гидролиз NH4Cl = NH4+(p) + Cl-(p) Cl- + H2O ≠ NH4+(p)+ 2H2O NH3.H2O +
- 68. Сольволиз и гидролиз II. обратимый KNO2 = K+(p) + NO2-(p) K+(p) + H2O ≠ H2O +
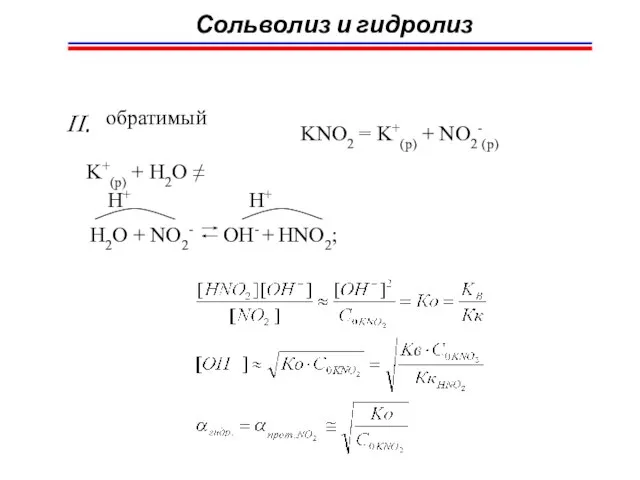
- 69. Сольволиз и гидролиз NaCl = Na+(p) + Cl-(p) Na+(p) + H2O ≠ Cl-(p) + H2O ≠
- 70. Сольволиз и гидролиз II. гидролиз солей, которые при диссоциации образуют ионы-амфолиты (которые могут проявлять свойства и
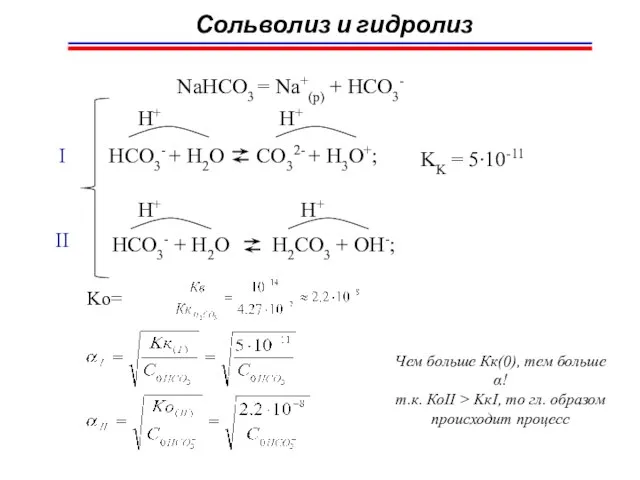
- 71. Сольволиз и гидролиз NaHCO3 = Na+(p) + HCO3- HCO3- + H2O CO32- + H3O+; H+ H+
- 72. a) [NH4+] = [OH-] = ? CoNH3∙H2O = 0,025M б) [NH4+] = ? C0 NH4NO3 =
- 74. Скачать презентацию



![Растворимость CaSO4 H2O T = const CaSO4(P) CaSO4(T) [Ca2+(P)+SO42-(P)]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-5.jpg)












![Произведение растворимости [S2-] 1∙10-18 8∙10-18 9∙10-13 моль/л CuS Ag2S Sb2S3 ПР 10-36](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-24.jpg)

![Смещение ионных равновесий малорастворимых веществ PbCl2(T) Pb2+(p)+2Cl-(p) ПРPbCl2=1,7.10-5 (250C) [Pb2+][Cl-]2=1,7.10-5 (250C)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-26.jpg)










![Водородный показатель pH pH = -lg[H3O+] pOH = -lg[OH-] pH= 1 ÷](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-38.jpg)
![Водородный показатель pH Кислые растворы: [H3O+] > 10-7 : 10-6 ÷ 10-1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-39.jpg)
![Протолитические (кислотно-основные) равновесия H2O + H2O OH- + H3O+ H3O+ KB=[H3O+][OH-] [H3O+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-41.jpg)


![Кислоты H2SO4 + 2H2O = SO42- + 2H3O+ 2H+ [H3O+] = 2C0H2SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-44.jpg)

![Кислоты [Al(H2O)6]3+ + H2O [Al(H2O)5(OH)]2+ + H3O+ .. H+ H+ (Al∙H2O)3+ +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-47.jpg)
![Основания NaOH = Na+ + OH- pOH = -lg[OH-] =-lgC0NaOH pH =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-48.jpg)
![H2O+NH3∙H2O OH-+ (NH4∙H2O)+ H+ H+ Основания Ко= [OH-]= pOH=-lg[OH-] = -lg](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-49.jpg)







![Сольволиз и гидролиз Mg3P2+6H2O = 2PH3↑ +3Mg(OH)2(T) Mg(OH)2(T) Mg2+(p)+2OH-(p) x/2 x [Mg2+][OH-]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-63.jpg)



![a) [NH4+] = [OH-] = ? CoNH3∙H2O = 0,025M б) [NH4+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/381609/slide-71.jpg)
 Нанесение раствора каменной штукатурки
Нанесение раствора каменной штукатурки Гражданские правоотношения. Тема №2
Гражданские правоотношения. Тема №2 Электронные ресурсы и электронные библиотеки.
Электронные ресурсы и электронные библиотеки. Устройство грузовых вагонов
Устройство грузовых вагонов Бесконечно убывающая геометрическая прогрессия_. (10 класс)
Бесконечно убывающая геометрическая прогрессия_. (10 класс) Государственные внебюджетные фонды, их место в финансировании социальных потребностей общества
Государственные внебюджетные фонды, их место в финансировании социальных потребностей общества Правовые системы Лумана и Бурдье
Правовые системы Лумана и Бурдье Национальный парк — Самарская Лука
Национальный парк — Самарская Лука Декор фоторамки
Декор фоторамки Little Cat and Little Mouse
Little Cat and Little Mouse Дистанционный практический курс BIM-сметчик
Дистанционный практический курс BIM-сметчик Турлидер. Функции турлидера
Турлидер. Функции турлидера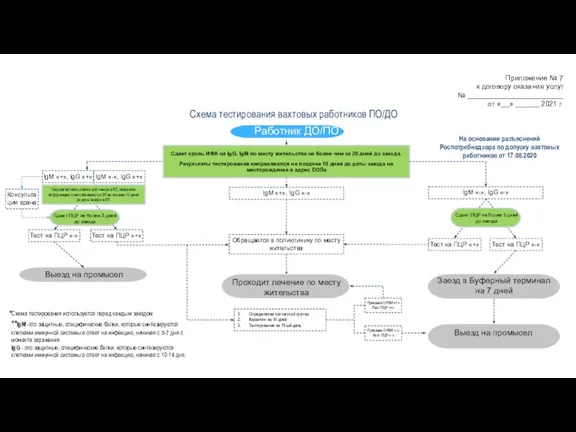 Схема тестирования вахтовых работников ПО/ДО
Схема тестирования вахтовых работников ПО/ДО Резьба по кости
Резьба по кости БАЗОВАЯ АППАРАТНАЯ КОФИГУРАЦИЯ ПЕРСОНАЛЬНОГО КОМПЬЮТЕРА
БАЗОВАЯ АППАРАТНАЯ КОФИГУРАЦИЯ ПЕРСОНАЛЬНОГО КОМПЬЮТЕРА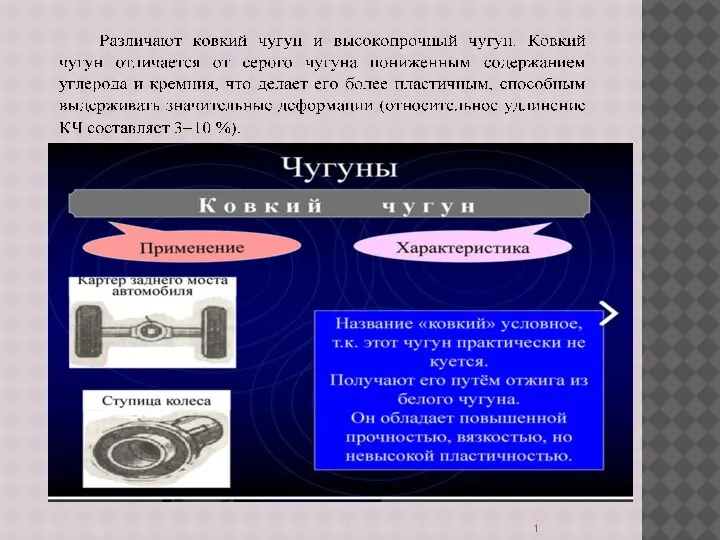 Чугуны. Ковкий чугун. Цветные металлы и их сплавы. Эмаль
Чугуны. Ковкий чугун. Цветные металлы и их сплавы. Эмаль Управление развитием компании
Управление развитием компании Презентация на тему Евгений Онегин (9 класс)
Презентация на тему Евгений Онегин (9 класс) Схема замещения трансформатора и ее параметры
Схема замещения трансформатора и ее параметры Определение оптимального плана замены оборудования
Определение оптимального плана замены оборудования Маркетинговые исследования в системе принятия управленческих решений
Маркетинговые исследования в системе принятия управленческих решений Экономическая и территориальная структура города
Экономическая и территориальная структура города Презентация на тему Названия месяцев и дней недели
Презентация на тему Названия месяцев и дней недели  Презентация на тему Квантовая механика
Презентация на тему Квантовая механика Октябрь 1917
Октябрь 1917 КОНЦЕНТРИРОВАННЫЕ СТИРАЛЬНЫЕ ПОРОШКИ
КОНЦЕНТРИРОВАННЫЕ СТИРАЛЬНЫЕ ПОРОШКИ Публичная презентация результатов педагогической деятельности и инновационной работы.
Публичная презентация результатов педагогической деятельности и инновационной работы. Игра «Что? Где? Когда?»
Игра «Что? Где? Когда?»