Содержание
- 2. Положение в таблице Строение атома Физические свойства История открытия Минералы Получение Химические свойства Применение
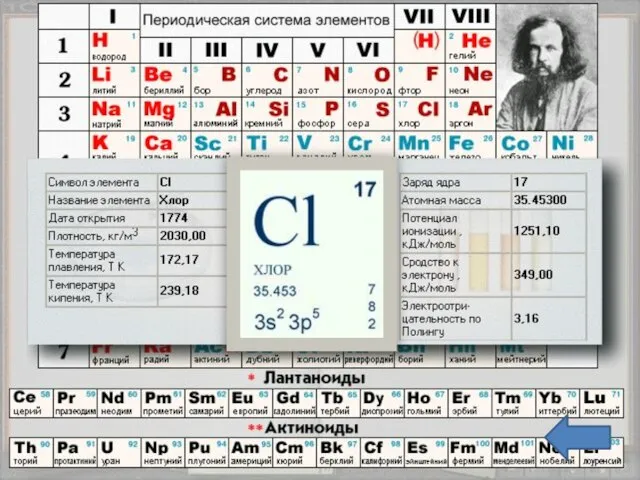
- 3. Положение в таблице Хлор - химический элемент седьмой группы, главной подгруппы, третьего периода периодической системы элементов
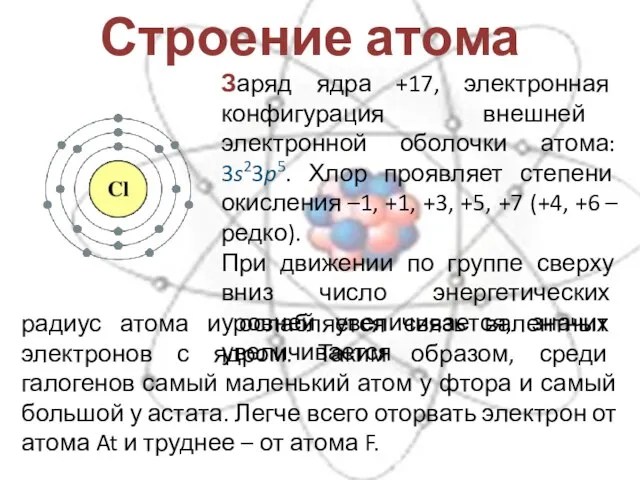
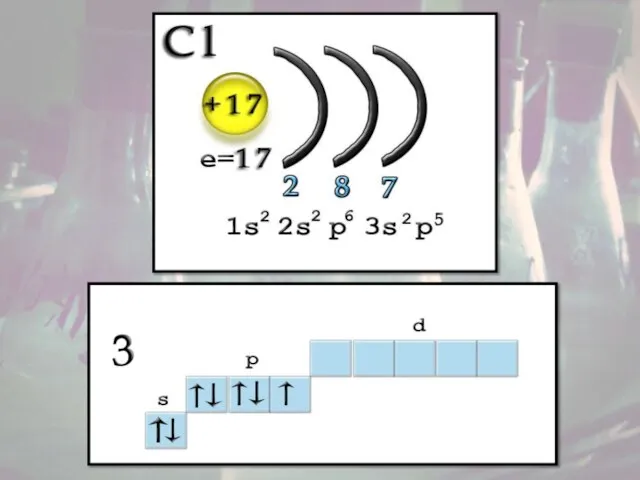
- 5. Строение атома Заряд ядра +17, электронная конфигурация внешней электронной оболочки атома: 3s23p5. Хлор проявляет степени окисления
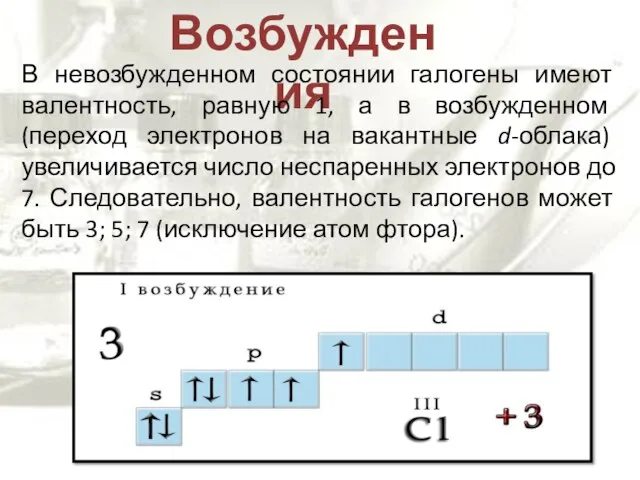
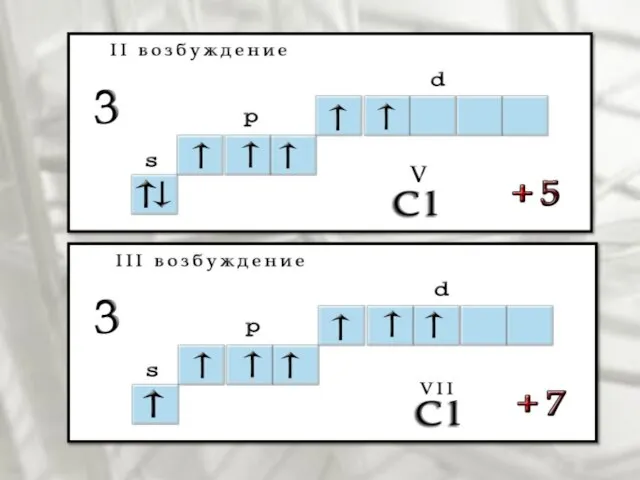
- 7. Возбуждения В невозбужденном состоянии галогены имеют валентность, равную 1, а в возбужденном (переход электронов на вакантные
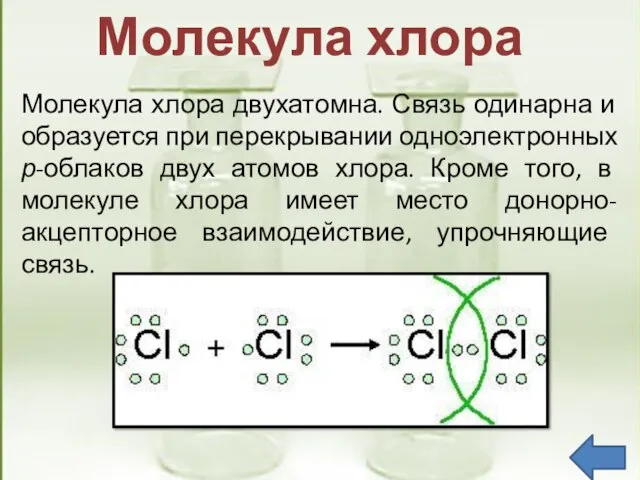
- 9. Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р-облаков двух атомов хлора. Кроме того,
- 10. Физические свойства С возрастанием молекулярной массы температуры плавления и кипения веществ, состоящих из молекул одинакового строения,
- 11. Физические свойства Хлор – ядовитый газ желто-зеленого цвета с резким запахом. Это первое химическое оружие. Во
- 12. Физические свойства
- 13. История открытия Первым из галогенов был открыт хлор (К. Шееле, 1774 год). Полученный желто-зеленый газ шведский
- 14. В природе встречается два стабильных изотопа хлора:35Cl (75,77%) и 37Cl (24,23%). Содержание хлора в земной коре
- 15. Минералы Каменная соль = поваренная соль = галит Карналлит Сильвин
- 16. Получение Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов (NaCl, KCl). Также его получают
- 17. Получение 2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
- 18. Химические свойства Хлор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O2,
- 19. Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr)
- 20. Cu+Cl2=CuCl2 2Fe+3Cl2 = 2FeCl3
- 21. H2 + Cl2 = 2 HCl(на свету) С Неметаллами 2Cl2 + C = CCl4 3Cl2 +
- 22. Образует соединения с другими галогенами: Cl2 + F2 = 2ClF Cl2 + 3F2 = 2ClF3, t
- 23. Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl2
- 24. С Бескислородными Кислотами Cl2 + HBr = 2HCl + Br2 Cl2 + HI = 2HCl +
- 25. Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул
- 26. Применение хлора Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является
- 27. Для обеззараживания воды — «хлорирования». В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов,
- 29. Скачать презентацию




















 Talk for a minute
Talk for a minute Литературная игра для младших школьников по произведениям Н.Н.Носова «Затейники и фантазёры»
Литературная игра для младших школьников по произведениям Н.Н.Носова «Затейники и фантазёры» L`italiano è facile
L`italiano è facile Коммуникации. Техника 3-х касаний
Коммуникации. Техника 3-х касаний Муниципальное образовательное учреждение "Ковылкинская средняя общеобразовательная школа № 1"
Муниципальное образовательное учреждение "Ковылкинская средняя общеобразовательная школа № 1" Грант 2013г
Грант 2013г Тема урока: «Бунташный век».
Тема урока: «Бунташный век». History & Mystery of the English language
History & Mystery of the English language Внутренняя среда организма. Кровеносная система
Внутренняя среда организма. Кровеносная система Современные средства поражений
Современные средства поражений ПЕРСПЕКТИВНАЯ НАЧАЛЬНАЯШКОЛА
ПЕРСПЕКТИВНАЯ НАЧАЛЬНАЯШКОЛА lecture_1
lecture_1 Тукай начал изучать русский язык
Тукай начал изучать русский язык История праздника Новый Год
История праздника Новый Год Проект: видеоблог
Проект: видеоблог Расчет теплоусвоения внутренней поверхности полов
Расчет теплоусвоения внутренней поверхности полов ЭФФЕКТ КАЗИМИРА: ОТ НАНОТЕХНОЛОГИЙ ДО ФИЗИКИ ВСЕЛЕННОЙ
ЭФФЕКТ КАЗИМИРА: ОТ НАНОТЕХНОЛОГИЙ ДО ФИЗИКИ ВСЕЛЕННОЙ Цифровые права
Цифровые права Сетевой маркетинг
Сетевой маркетинг культура и достопримечательности Греции
культура и достопримечательности Греции Мектеп бітірушілердің психологиялық-физиологиялық жағдайын ескере отырып қобалжу деңгейін төмендету
Мектеп бітірушілердің психологиялық-физиологиялық жағдайын ескере отырып қобалжу деңгейін төмендету Решение текстовых задач. Закрепление пройденного
Решение текстовых задач. Закрепление пройденного Традиционная реклама
Традиционная реклама Saint Patricks day
Saint Patricks day КОМПЬЮТЕРНАЯ ДОЛИНА
КОМПЬЮТЕРНАЯ ДОЛИНА Литературная игра по творчеству А.С. Пушкина
Литературная игра по творчеству А.С. Пушкина Презентация на тему Семейство Губоцветные
Презентация на тему Семейство Губоцветные ФИЗИЧЕСКАЯ КУЛЬТУРА
ФИЗИЧЕСКАЯ КУЛЬТУРА